血清葡萄糖调节蛋白78联合肺血管阻力指数对急性肺损伤患者预后的评估价值*
2022-04-06陈运庭王睿雯梁桂林麦明志
陈运庭,王睿雯,梁桂林,麦明志
(三亚市人民医院 呼吸内科,海南 三亚572000)
急性肺损伤(acute lung injury, ALI)广义是指各种肺内外因素作用所引起的急性肺实质结构的破坏和高通透性肺水肿,狭义是指各种肺内、外致病因素导致的双肺急性弥漫性损伤和高通透性肺水肿[1],起病急、进展快,病死率高。尽管目前临床广泛使用呼吸机和液体管理策略,但ALI 病死率仍然高达30%~50%[2],及早评估患者预后对提高生存率具有重要意义。有研究[3]表明,内质网应激参与了内毒素、感染、其他脏器损伤所致ALI 的过程。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)为内质网重要的分子伴侣,其高表达可破坏内质网稳态,引起内质网应激[4]。肺血管损伤为ALI 的始动因素之一[5]。肺血管系统具有高容量、低阻力的特点,其低压灌注由右心室提供,是其正常运行的关键,但这种微妙平衡易受各种病理状态干扰[6]。既往研究[7]证实,ALI 为右心室功能障碍和肺动脉高压的重要原因,肺血管功能障碍如肺血管阻力指数(pulmonary vascular resistance index,PVRI)提升可能与ALI 患者预后相关。本研究拟探讨血清GRP78 水平和PVRI 与ALI 患者预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年6月三亚市人民医院收治的接受正压通气治疗的ALI 患者120 例。其中,男性64 例,女性56 例;年龄33~80 岁,平均(57.48±10.18)岁;体质量指数(BMI)为19~26 kg/m2,平均(23.33±1.95)kg/m2;病因:感染52 例,创伤47 例,胰腺炎2 例,其他19 例;合并疾病:慢性阻塞性肺疾病46 例,缺血性心脏病24 例,高血压48 例,糖尿病31 例。纳入标准:①符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[8]的ALI 诊断标准;②患者及家属均知情同意并签署知情同意书;③病历资料完整;④年龄18~80 岁;⑤可接受肺血管血流动力学监测;⑥近半年内未服用免疫抑制剂类药物。排除标准:①妊娠及哺乳期妇女;②自身免疫性疾病;③恶性肿瘤;④预计6 个月内病死概率>50%;⑤ALI 发病至入院时间>48 h;⑥支气管哮喘、肺结核等其他呼吸系统疾病;⑦血液系统疾病。本研究经医院医学伦理委员会批准。
1.2 方法
1.2.1 收集患者一般资料 包括性别、年龄、BMI、病因、合并疾病、心率、呼吸频率、休克比例(平均动脉压<65 mmHg 或需要血管加压剂维持≥65 mmHg)、ICU 时间、机械通气时间、动脉血气参数[pH 值、吸氧浓度(FiO2)、动脉血氧分压(PaO2)、氧合指数(PaO2/FiO2)]、呼吸机参数[呼气末正压(PEEP)、气道平台压(Plat)]、急性生理学和慢性健康状况评价Ⅱ(APACHE Ⅱ)[9][包括急性生理学评分、年龄、慢性健康状况评价3 个部分,总分0~71 分,得分越高病情越严重]。动脉血气参数、呼吸机参数及APACHE Ⅱ评分均于加入本研究后24 h内测量和评估。
1.2.2 血清GRP78 水平测定 采集患者加入本研究后24 h 内3 mL 静脉血,3 000 r/min 离心10 min,离心半径8 cm,取上清液,置于-80℃冰箱冷冻保存备用。采用酶联免疫吸附试验(ELISA)检测血清GRP78 水平,ELISA 试剂盒购自上海梵态生物科技有限公司(货号:FT-P32152R)。
1.2.3 PVRI 测定 所有患者加入本研究后2 h 内接受肺血管血流动力学管理,连续7 d 或至患者无需辅助呼吸后12 h。若患者没有中心静脉导管,则由主治医师经颈内静脉放置中心静脉导管和血流导向气囊导管(又称Swan-Ganz 导管),连接Vigileo微创血流动力学监护仪(爱德华生命科学世界贸易公司),监测心排血指数(CI)、肺动脉平均压(mPAP)、肺动脉舒张压(dPAP)、肺动脉收缩压(sPAP)、肺动脉楔压(PAWP),计算PVRI,PVRI=(mPAP-PAWP)/CI[10]。
1.3 根据病情和预后评估分组
加入本研究24 h 后采用APACHE Ⅱ评估患者病情,>20 分为高危组(n=42),≤20 分为低中危组(n=78)。所有患者均按照《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[8]的治疗方法进行治疗,死亡为预后不良组(n=31),痊愈出院为预后良好组(n=89)。
1.4 统计学方法
数据分析采用SPSS 26.0 统计软件,计数资料以构成比或率(%)表示,比较用χ2检验;计量资料以均数±标准差(±s)或以中位数(上四分位数,下四分位数)[M(P25,P75)]表示,比较用t检验或秩和检验;相关分析用Spearman 法;绘制受试者工作特征(ROC)曲线;影响因素的分析用多因素逐步Logistic 回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 高危组和低中危组患者血清GRP78 水平和PVRI比较
高危组血清GRP78 水平和PVRI 分别为(127.50±36.74)pg/mL、(30.14±4.58)(kPa·s)/L,低中危组分别为(107.04±36.19) pg/mL、(28.32±3.50)(kPa·s)/L,两组比较,经t检验,差异有统计学意义(t=2.938 和2.428,P=0.004 和0.017),高危组血清GRP78 水平和PVRI 均高于低中危组。
2.2 ALI 患者血清GRP78 水平和PVRI 与APACHEⅡ评分的相关性
经Spearman 相关分析,患者血清GRP78 水平和PVRI 与APACHEⅡ评分均呈正相关(rs=0.425 和0.511,均P=0.000)。
2.3 预后不良组和预后良好组不同临床病理特征的比较
预后不良组和预后良好组休克、ICU 时间、机械通气时间、APACHEⅡ评分、GRP78 水平、PVRI比较,差异有统计学意义(P<0.05),预后不良组休克比例高于预后良好组,ICU 时间、机械通气时间长于预后良好组,APACHEⅡ评分、GRP78 水平、PVRI 高于预后良好组。两组的性别、年龄、BMI、病因、合并疾病、心率、呼吸频率、pH 值、Plat、PEEP、mPAP、dPAP、sPAP、CI、氧合指数比较,差异无统计学意义(P>0.05)。见表1。

表1 预后不良组和预后良好组不同临床病理特征的比较
2.4 ALI 患者预后不良影响因素的多因素Logistic回归分析
以预后为因变量(良好=0,不良=1),休克(是=1,否=0)、ICU 时间、机械通气时间、APACHEⅡ评分(>20 分=1,≤20 分=0)、GRP78(原值录入)、PVRI(原值录入)为自变量,进行逐步多因素Logistic 回归分析(采用后退法,α入=0.05,α出=0.10),结果显示:休克[=4.061(95%CI:1.288,12.806)]、APACHEⅡ评分>20 分[=1.093(95%CI:1.013,1.179)]和高GRP78 水平[=1.035(95%CI:1.016,1.054)]、PVRI[=1.177(95%CI:1.007,1.375)]为ALI 患者预后不良的危险因素(P<0.05)。见表2。

表2 ALI患者预后不良影响因素的多因素Logistics回归分析参数
2.5 血清GRP78 联合PVRI 对ALI 患者预后不良的评估价值
ROC 曲线显示,GRP78 为108.10 ng/mL、PVRI为29.21(kPa·s)/L 时,评估ALI 患者预后不良的曲线下面积(AUC)分别为0.786、0.796,敏感性分别为64.5%(95% CI:0.610,0.687)、84.3%(95% CI:0.811,0.875),特异性分别为71.0%(95% CI:0.673,0.742)、76.0%(95% CI:0.732,0.818)。GRP78+PVRI评估ALI 患者预后不良的AUC 为0.895,敏感性为80.7%(95% CI:0.771,0.849),特异性为85.4%(95%CI:0.819,0.895)。见图1。
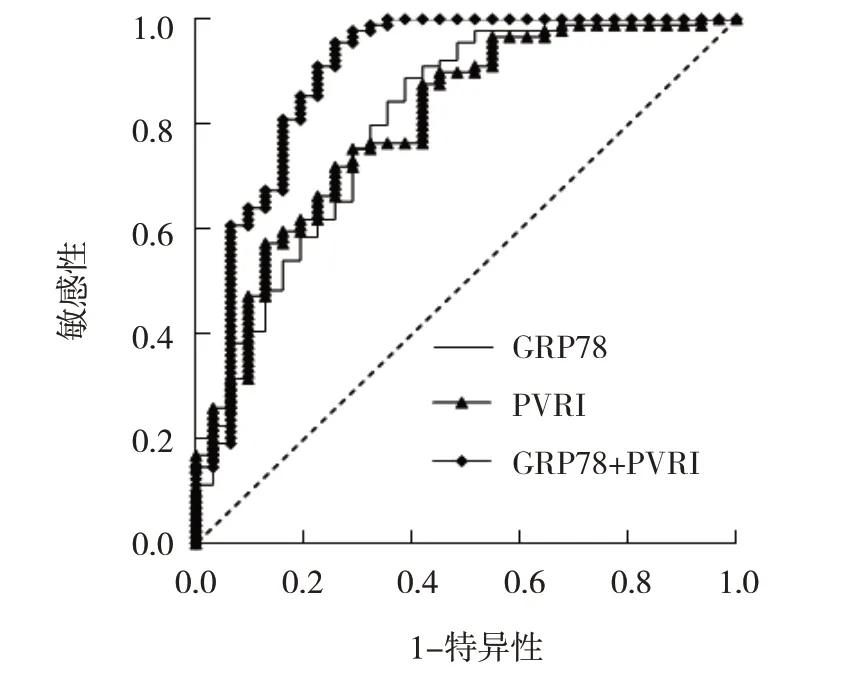
图1 血清GRP78联合PVRI评估ALI患者预后不良的ROC曲线
3 讨论
近年来,随着ALI 病理生理机制研究的深入,肺保护性通气策略运用越发广泛,但并未显著降低病死率[2,8]。ALI 是一种异质性疾病,其发病机制复杂,非单一因素所致,使ALI 的诊断和治疗具有极高挑战性,缺乏特异性生物标志物可能是限制其诊治的重要原因,因此寻找可辅助判断ALI 病情和预后的生物标志物极为重要。
内质网是细胞质内由膜组成,为真核细胞蛋白质折叠、翻译、修饰场所。内质网应激是指在营养缺乏、氧化应激、缺血缺氧等病理状态下,内质网腔内聚集过多未折叠蛋白和错误折叠蛋白,破坏内质网稳态,引起的一系列维持细胞正常功能的应激反应,持续内质网应激可引起内质网功能失代偿,激活内质网相关凋亡程序,诱导凋亡和炎症反应[11]。已有研究[12-13]证实,半胱氨酸天冬氨酸蛋白酶12、CAAT 区/增强子结合蛋白、环磷酸腺苷反应元件结合蛋白、同源蛋白等相关标志物在多种因素所致ALI 小鼠肺组织中表达升高,给予内质网应激拮抗剂处理后,小鼠肺组织损伤显著减轻,证实内质网应激参与了ALI 病理生理过程。GRP78 为热休克70 家族一员,参与蛋白质在内质网正确折叠和转运过程,内质网应激过程中,GRP78 可结合活化转录因子6、蛋白激酶R 样内质网激酶、肌醇需求酶-1 等内质网跨膜传感器,结合未折叠蛋白或错误折叠蛋白的疏水性残基端,使未折叠蛋白和错误折叠蛋白正确折叠并降解,以恢复内质网功能,因此,GRP78 是内质网应激启动标志性蛋白[14]。AKSOY 等[15]研究报道,成人肺气道和肺泡Ⅱ型上皮细胞中GRP78 表达上调,在吸烟所致的肺损伤患者中表达进一步升高。实验发现[16],GRP78 参与了气道上皮细胞和肺泡Ⅱ型上皮细胞的表面活性蛋白处理和转运,为肺功能正常运行所必须。本研究结果显示,高危组血清GRP78水平高于低中危组,与APACHEⅡ评分呈正相关,说明随着血清GRP78 水平的升高,ALI 患者病情严重程度增加。进一步分析显示,预后不良组血清GRP78 水平升高,排除其他因素后仍然是ALI 患者预后不良的独立危险因素,说明血清GRP78 水平可作为评估ALI 患者预后的指标。适度的内质网应激可诱导GRP78 少量表达,以促进错误折叠蛋白质降解,是机体的一种保护性机制,但持续过度内质网应激会影响内质网自身稳态恢复,诱导细胞凋亡,目前公认肺泡上皮细胞、肺内皮细胞等的凋亡为ALI 患者预后不良的重要原因[17],因此推测,预后不良组血清GRP78 水平升高提示严重内质网应激,诱导肺部多种细胞凋亡,影响患者预后。
肺保护性通气策略可避免肺过度牵张引起的肺损伤。但近年研究发现,大多ALI 患者死于循环衰竭,而非低氧血症和肺损伤[18]。ALI 发生过程中,缩血管物质和炎症介质可引起肺血管结构和功能改变,引起肺动脉高压,增加右心室后负荷,最终引起右心功能障碍甚至心力衰竭,是循环衰竭的重要原因[19]。有报道[20]显示,急性呼吸窘迫综合征死亡患者的肺循环阻力较高,存活患者的肺循环阻力在病情改善后逐渐降低,说明肺循环阻力与急性呼吸窘迫综合征患者预后密切相关。PVRI 是对非动脉内膜厚度和弹性的数字化评定,可反映血液在肺血管系统中所受的阻力。本研究结果显示,高危组PVRI 高于低中危组,与APACHEⅡ评分呈正相关,说明随着PVRI 的升高,ALI 患者病情越严重。进一步分析显示,预后不良组PVRI 显著升高,为ALI 患者预后不良的独立危险因素,高PVRI 患者死亡风险增加1.177 倍,其原因是高PVRI 即肺血管阻力较高,右心功能障碍也越严重,引发组织器官灌注不足,影响患者预后。提示临床工作中不仅要关注呼吸力学对ALI 患者的影响,还要关注血流动力学效应。ROC 曲线显示,GRP78、PVRI 均对ALI 患者不良预后具有一定评估价值,可作为预后评估指标,两项联合评估的敏感性、特异性更高,说明血清GRP78 水平和PVRI联合检测有助于更准确评估ALI 患者的预后。
综上所述,血清GRP78 水平和PVRI 与ALI 患者病情严重程度和预后相关,联合检测可提升患者不良预后的评估价值。但本研究为单中心研究,且没有动态监测GRP78 水平和PVRI 的变化,还需多中心大样本研究证实。
