低氧暴露时间的选择与海拔落差对高原肺动脉高压大鼠模型复制的影响*
2022-04-06李生花杨全余嘎琴马兰靳国恩
李生花,杨全余,嘎琴,马兰,靳国恩
(1.青海大学医学院基础医学部 生理教研室,青海 西宁810001;2.青海大学医学院 高原医学研究中心,青海 西宁810001)
高原肺动脉高压是高原地区的常见病和高发病,其病理生理特点为肺动脉压过度升高和严重的低氧血症。肺动脉高压形成包括肺血管持续性收缩和肺血管重构两种方式,严重时可导致右心肥厚,甚至衰竭。高原肺动脉高压的发病机制十分复杂,且尚未完全阐明,严重影响该病的预防和治疗。2004年在西宁举办的第六届国际高原医学大会和低氧生理学术大会暨第五届中华医学会高原医学年会确定了慢性高原病国际诊断标准——“青海标准”[1],该标准明确规定高原肺动脉高压患者平均肺动脉压应≥30 mmHg 或收缩压≥50 mmHg。高原肺动脉高压动物模型的成功复制是研究该病的首要环节,复制是否成功也以其为参考标准。现有模型复制方式包括高原现场模型复制、低压氧舱模型复制和化学缺氧模型复制3 种。其中,高原现场模型复制是最理想的方法,除低压、低氧外,还有寒冷、强紫外线和干燥等因素,能够真实反映高原综合环境对机体的影响,但其费用高,受时间和季节的限制;与高原现场模型复制相比,低压氧舱模型复制不受时间和季节限制,费用较低,对环境因素的可控制性强;化学缺氧模型复制不太符合低压、低氧性高原病的模型特点。许多研究者在选择高原现场模型复制或低压氧舱模型复制,以及对动物暴露低氧多久时间才能成功复制等方面存在较大分歧。前者问题的根源在于寒冷对机体生理活动的影响;后者问题的根源在于模型复制时间差异太大,有低氧暴露20 d 的,有暴露30 d 的,甚至60 d 或更长时间的,这表明大多数研究者对大鼠高原肺动脉高压模型复制成功所需时间是不确定的。本研究比较高原现场模型复制和低压氧舱模型复制所存在的差异,并对大鼠低氧暴露时间、模型复制海拔与模型复制成功率的相关性进行分析,现报道如下。
1 材料与方法
1.1 实验动物及分组
SPF 级SD 雄性大鼠。西安380 只,体 重160~200 g,海拔396 m[西安交通大学动物中心提供,实验动物生产许可证号:SCXK(陕)2017-003];兰州100 只,体重160~200 g,海拔1 517 m(兰州医学院动物所提供);成都73 只,体重150~180 g,海拔505 m[四川大学实验动物中心提供,实验动物生产许可证号:SCXK(川)2009-09];北京50 只,体重140~160 g,海拔50 m(北京维通利华实验动物技术有限公司,动物合格证号:11400700292756)。
1.1.1 西安的SD 大鼠 根据模型复制方式分为高原现场模型复制(228 只)和低压氧舱模型复制(152 只)。其中,高原现场模型复制在海拔4 300 m、4 500 m 和4 614 m 处进行实验,每次76 只;3 次实验根据低氧暴露时间不同分为第1 天组(15 只)、第3 天组(15 只)、第7 天组(15 只)、第15 天组(15 只)和第30 天组(16 只)5 组。低压氧舱模型复制分别在低温6~12℃和常温20~22℃进行实验,每次76 只;2 次实验根据低氧暴露时间不同分为第1 天组(15 只)、第3 天组(15 只)、第7 天组(15 只)、第15 天组(15 只)和第30 天组(16 只)5 组。
1.1.2 兰州的SD 大鼠 根据模型复制方式分为高原现场模型复制(50 只) 和低压氧舱模型复制(50 只)。其中,高原现场模型复制又根据低氧暴露时间不同又分为低氧第1 天、第3 天、第7 天、第15 天和第30 天5 组,每组10 只。低压氧舱模型复制均在20~22℃常温下进行实验,根据低氧暴露时间不同又分为低氧第1 天、第3 天、第7 天、第15 天和第30 天5 组,每组10 只。
1.1.3 成都的SD 大鼠 模型复制方式为高原现场模型复制(73 只)。根据低氧暴露时间不同分为低氧第1 天(18 只)、第3 天(18 只)、第7 天(10 只)、第15 天(10 只)和第30 天(17 只)5 组。
1.1.4 北京的SD 大鼠 模型复制方式为低压氧舱模型复制(40 只),均在20~22℃常温下进行实验。根据低氧暴露时间不同又分为低氧第1 天、第7天、第15 天、第21 天4 组,每组10 只。
1.2 高原现场模型复制
1.2.1 西安的SD大鼠 海拔4 300 m 地点选在青海省果洛州玛多县(低温8~13℃,室温);海拔4 500 m地点选在青海省果洛州玛多县花石峡镇(常温18~20℃,通过电暖器控制);海拔4 614 m 地点选在青海省玉树州曲麻莱县可可西里不冻泉保护站(低温6~12℃,室温)。大鼠室内喂养,定期喂水,排除紫外线和干燥的影响。
1.2.2 兰州和成都的SD 大鼠 现场地点选在青海省果洛州玛多县花石峡镇(常温18~20℃,通过电暖器控制)。
1.3 低压氧舱模型复制
西安、兰州和北京的SD 大鼠均采用青海大学医学院高原医学研究中心的低压氧舱(型号DYC-3000,贵州风雷航空军械有限责任公司),模拟海拔为5 000 m。西安SD 大鼠常温实验室温保持在20~22℃,低温实验将大鼠放置于低压氧舱中的可调温冷藏柜,温度保持在6~12℃;兰州和北京的SD 大鼠常温实验室温保持在20~22℃。
1.4 肺动脉压检测
于低氧暴露不同时间检测不同海拔来源大鼠的肺动脉压:麻醉平稳后,分离出右侧颈外静脉,用肝素化的弯头聚次亚乙烯管(直径0.28 μm)沿颈外静脉插入,直至肺动脉,插管位置利用其典型波形进行确定,压力换能器终端连接MP150 十六导生理信号采集系统(美国Biopac 公司),通过显示器观察波形变化,用AcqKnowledge 3.7.3 软件进行采集和分析。肺动脉压数据采集完后给予大鼠安乐处死。
1.5 统计学方法
数据分析采用SPSS 13.0 统计软件,计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用方差分析,相关性分析采用Pearson 法,P<0.05 为差异有统计学意义。
2 结果
2.1 不同时间组西安SD 大鼠模型不同海拔不同温度下的肺动脉压比较
2.1.1 西安SD 大鼠高原现场模型 相同低氧暴露时间的西安SD 大鼠高原现场模型不同海拔的肺动脉压比较,经方差分析,差异无统计学意义(P>0.05)。同一海拔不同低氧暴露时间西安SD 大鼠的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05)。随着低氧暴露时间的延长,大鼠肺动脉压逐渐升高;低氧暴露第7 天,部分大鼠的肺动脉压超过了30 mmHg;低氧暴露第30 天,所有大鼠的肺动脉压超过30 mmHg,达到了高原肺动脉高压的模型复制标准。见表1。
表1 低氧暴露不同时间组西安SD大鼠不同海拔不同温度下的肺动脉压比较 (mmHg,±s)

表1 低氧暴露不同时间组西安SD大鼠不同海拔不同温度下的肺动脉压比较 (mmHg,±s)
组别n 4 300 m(8~13℃)4 500 m(18~20℃)4 614 m(6~12℃)F 值P 值第1天组第3天组第7天组第15天组第30天组F 值P 值15 15 15 15 16 20.68±3.30 22.82±2.98 27.60±3.23 32.99±3.79 38.14±4.28 60.846 0.000 20.55±2.97 22.01±3.30 28.55±3.68 34.47±3.62 39.41±4.49 68.122 0.000 20.73±3.37 22.46±2.58 28.59±2.97 33.67±4.49 40.57±3.93 73.059 0.000 0.012 0.264 0.405 0.485 1.228 0.989 0.769 0.670 0.619 0.302
2.1.2 西安SD 大鼠低压氧舱模型 相同低氧暴露时间的西安SD 大鼠低压氧舱模型不同温度下的肺动脉压比较,经t检验,差异无统计学意义(P>0.05)。不同低氧暴露时间的西安SD 大鼠同一温度下的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05)。见表2。
表2 低氧暴露不同时间组西安SD大鼠低压氧舱模型不同温度下的肺动脉压比较 (mmHg,±s)
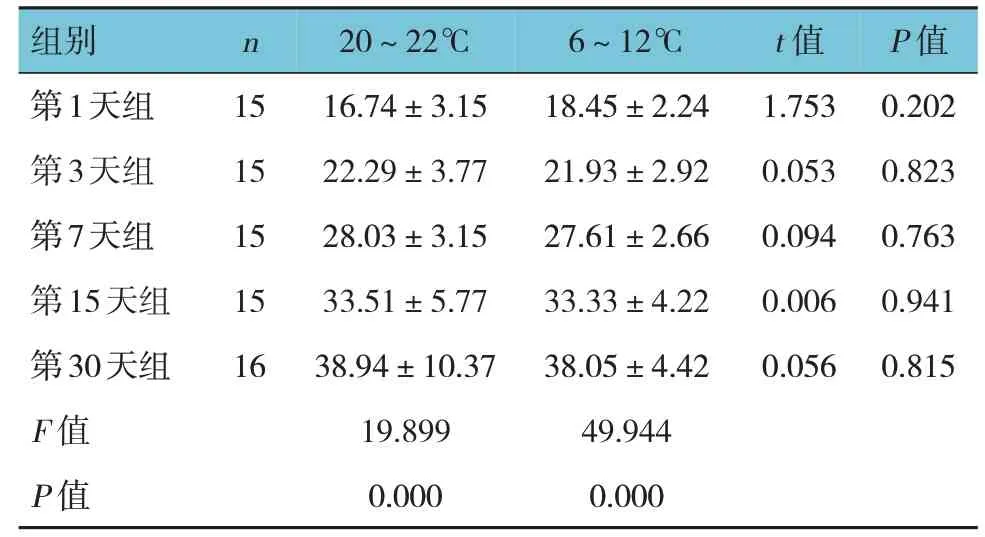
表2 低氧暴露不同时间组西安SD大鼠低压氧舱模型不同温度下的肺动脉压比较 (mmHg,±s)
组别n 20~22℃6~12℃t 值P 值第1天组第3天组第7天组第15天组第30天组F 值P 值15 15 15 15 16 16.74±3.15 22.29±3.77 28.03±3.15 33.51±5.77 38.94±10.37 19.899 0.000 18.45±2.24 21.93±2.92 27.61±2.66 33.33±4.22 38.05±4.42 49.944 0.000 1.753 0.053 0.094 0.006 0.056 0.202 0.823 0.763 0.941 0.815
2.2 相近温度下不同低氧模型大鼠肺动脉压的比较
低氧暴露不同时间组西安SD 大鼠高原现场模型4 300 m(8~13℃)、4 614 m(6~12℃)的肺动脉压数据见表1,低氧暴露不同时间组西安SD 大鼠低压氧舱模型6~12℃下的肺动脉压数据见表2。同样6~12℃低温下低氧暴露同一时间组高原现场和低压氧舱模型大鼠的肺动脉压比较,经t检验,差异无统计学意义(P>0.05)。低氧暴露不同时间组西安SD 大鼠高原现场模型4 300 m(8~13℃)、4 614 m(6~12℃)及低压氧舱模型5 000 m(6~12℃)的肺动脉压变化趋势基本一致(见图1)。低氧暴露不同时间组西安SD 大鼠高原现场模型4 500 m(18~20℃)的肺动脉压数据见表1,低氧暴露不同时间组西安SD 大鼠低压氧舱模型20~22℃下的肺动脉压数据见表2。常温下,低氧暴露同一时间组高原现场和低压氧舱模型大鼠的肺动脉压比较,经t检验,差异无统计学意义(P>0.05)。低氧暴露不同时间组西安SD 大鼠高原现场模型4 500 m(18~20℃)和低压氧舱模型5 000 m(20~22℃)的肺动脉压变化趋势基本一致(见图2)。
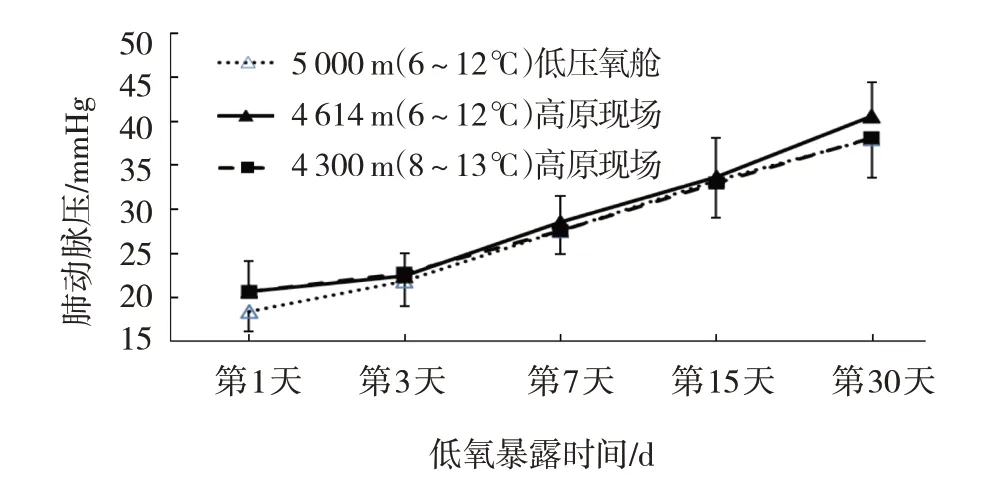
图1 低温下2种复制模型大鼠的肺动脉高压变化趋势
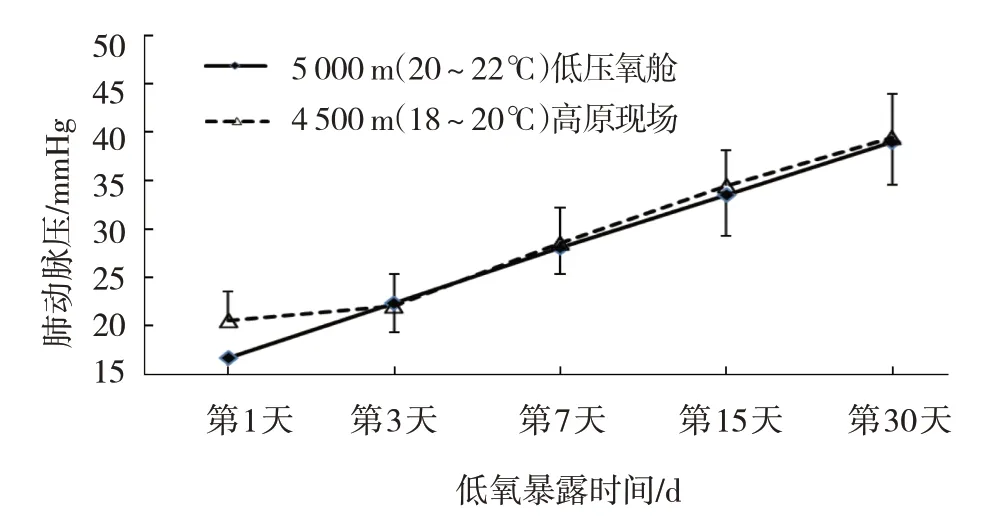
图2 常温下2种复制模型大鼠的肺动脉高压变化趋势
2.3 暴露时间对不同海拔来源大鼠模型肺动脉高压的影响
2.3.1 低氧暴露不同时间组不同海拔来源大鼠4 500 m高原现场模型的肺动脉压比较 低氧暴露第1 天、第7 天、第15 天、第30 天的西安、成都、兰州SD 大鼠的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05),相同低氧暴露时间里来源地海拔较低大鼠的肺动脉压高于来源地海拔较高的大鼠,即西安和成都SD 大鼠的肺动脉压高于兰州SD 大鼠,这种差异,随低氧暴露时间的延长而增大。同一海拔来源大鼠不同低氧暴露时间的肺动脉压,即西安、成都、兰州SD 大鼠低氧暴露第1 天、第3 天、第7 天、第15 天、第30 天的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05)(见表3)。高原现场模型中,西安、成都、兰州3 个不同海拔来源大鼠肺动脉压的总体变化趋势基本一致,来源地海拔较低大鼠的肺动脉压高于来源地海拔较高的大鼠(见图3)。
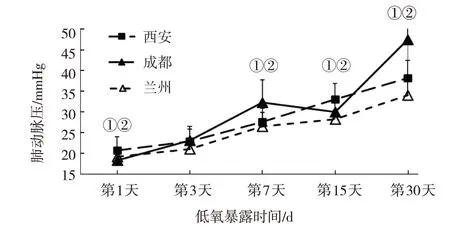
图3 低氧暴露不同时间组不同海拔来源大鼠4 500 m高原现场模型的肺动脉压变化趋势
表3 低氧暴露不同时间组不同海拔来源大鼠4 500 m高原现场模型的肺动脉压比较 (mmHg,±s)
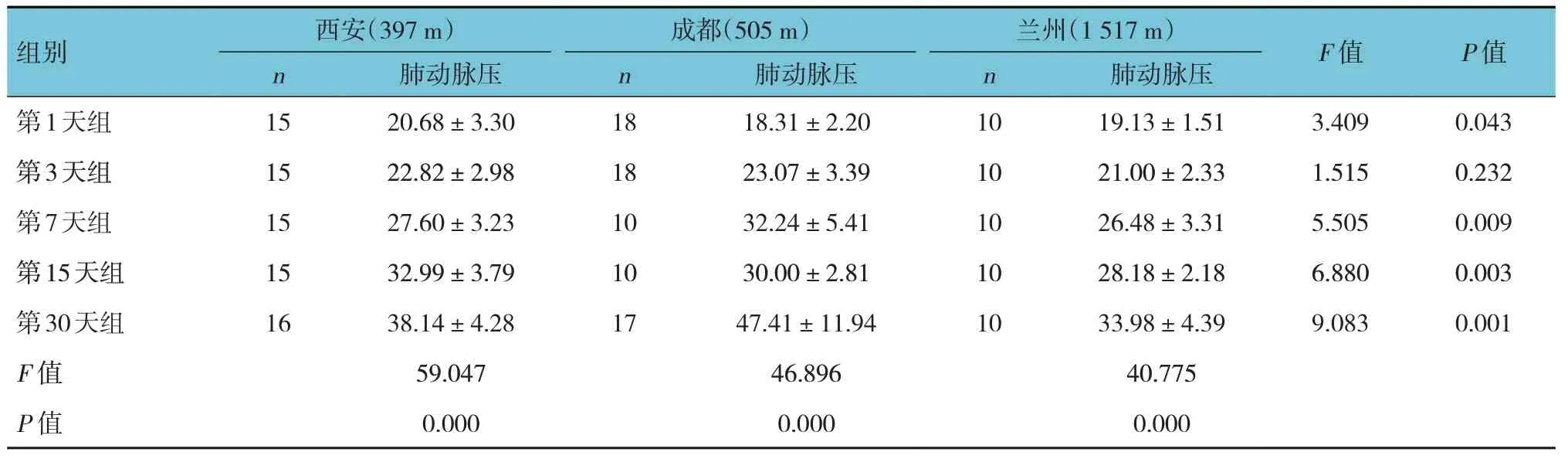
表3 低氧暴露不同时间组不同海拔来源大鼠4 500 m高原现场模型的肺动脉压比较 (mmHg,±s)
?
根据肺动脉压≥30 mmHg 的要求,低氧暴露第7 天,15 只西安SD 大鼠中有6 只达到要求,模型复制成功率为40%;10 只成都SD 大鼠中有6 只达到要求,模型复制成功率为60%;10 只兰州SD 大鼠中只有2 只达到要求,模型复制成功率仅为20%。低氧暴露第15 天,15 只西安SD 大鼠中有12 只达到要求,模型复制成功率为80%;10 只成都SD 大鼠中有8 只达到要求,模型复制成功率也为80%;10 只兰州SD 大鼠只有4 只达到要求,模型复制成功率为40%。低氧暴露第30 天,16 只西安SD 大鼠全部达到要求,模型复制成功率为100%;17 只成都SD 大鼠也全部达到要求,模型复制成功率为100%;10 只兰州SD 大鼠中有8 只达到要求,模型复制成功率80%。
2.3.2 低氧暴露不同时间组不同海拔来源大鼠5 000 m 低压氧舱模型的肺动脉压比较 低氧暴露第1 天、第7 天、第15 天、第21 天北京、西安、兰州SD 大鼠的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05),西安、兰州SD 大鼠低氧暴露第30 天的肺动脉压比较,经t检验,差异有统计学意义(P<0.05)。低氧暴露第7 天,来源地海拔最低的北京SD 大鼠的肺动脉压超过西安和兰州SD 大鼠,与第1 天比较,北京SD 大鼠的肺动脉压升高了21.68 mmHg,西安和兰州SD 大鼠的肺动脉压分别升高了8.53 mmHg 和4.94 mmHg。低氧暴露第21 天,与第1 天比较,北京SD 大鼠的肺动脉压升高了29.39 mmHg,西安和兰州SD 大鼠的肺动脉压分别升高了18.59 mmHg 和8.62 mmHg。同一海拔来源大鼠不同低氧暴露时间的肺动脉压,即北京SD 大鼠低氧暴露第1 天、第7 天、第15 天、第21 天的肺动脉压比较,西安、兰州SD 大鼠低氧暴露第1 天、第7 天、第15 天、第21 天、第30 天的肺动脉压比较,经方差分析,差异有统计学意义(P<0.05)(见表4)。低压氧舱模型中,北京、西安、兰州3 个不同海拔来源大鼠肺动脉压的总体变化趋势基本一致,但不同低氧暴露时间的增幅并不相同,低氧暴露第1 天的大鼠肺动脉压的结果显示,来自海拔越低的大鼠,其初始平均肺动脉压就越低(见图4)。
表4 低氧暴露不同时间组不同海拔来源大鼠5 000 m低压氧舱模型的肺动脉压比较 (±s)

表4 低氧暴露不同时间组不同海拔来源大鼠5 000 m低压氧舱模型的肺动脉压比较 (±s)
?
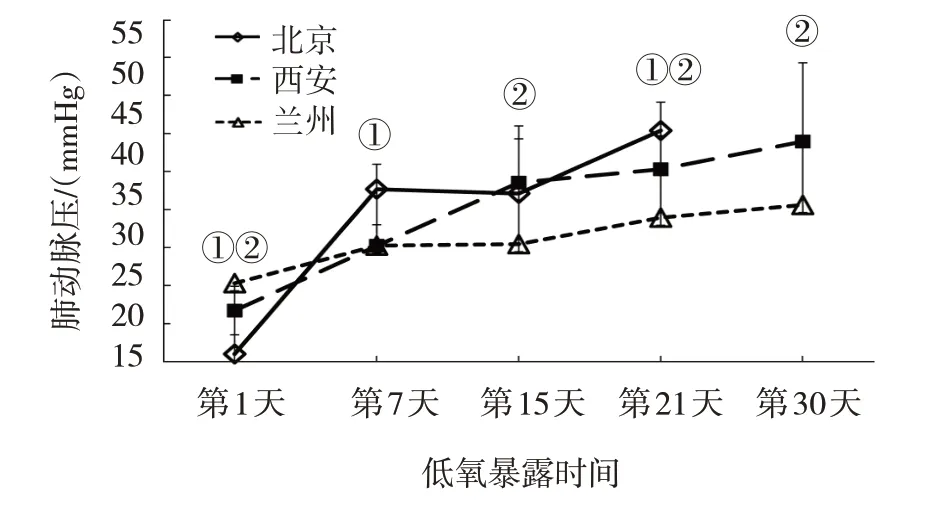
图4 低氧暴露不同时间组不同海拔来源大鼠5 000 m低压氧舱模型的肺动脉压变化趋势
根据肺动脉压≥30 mmHg 的要求,低氧暴露第7天,10 只北京SD 大鼠中有7 只达到要求,模型复制成功率为70%;10 只西安SD 大鼠中有3 只达到要求,模型复制成功率为30%;10 只兰州SD 大鼠中只有1 只达到要求,模型复制成功率为10%。低氧暴露第21 天,10 只北京SD 大鼠全部达到要求,模型复制成功率为100%;10 只西安SD 大鼠中有9 只达到要求,模型复制成功率为90%;10 只兰州SD大鼠中,只有7 只达到要求,模型复制成功率为70%。低氧暴露第30 天,10 只西安SD 大鼠全部达到要求,模型复制成功率为100%;10 只兰州SD 大鼠中只有8 只达到要求,模型复制成功率为80%。
2.4 大鼠来源地海拔和模型复制海拔的海拔落差与肺动脉增幅的相关性
肺动脉压升高的趋势显示,来源地海拔越低的大鼠,越容易出现肺动脉高压。对兰州、西安、北京大鼠来源地海拔和模型复制时海拔之间的高度落差与肺动脉压升高幅度(增幅)进行相关性分析,结果表明,两者呈正相关(r=0.875,P=0.000),即高度落差越大,其肺动脉压升高幅度就越大。见图5。
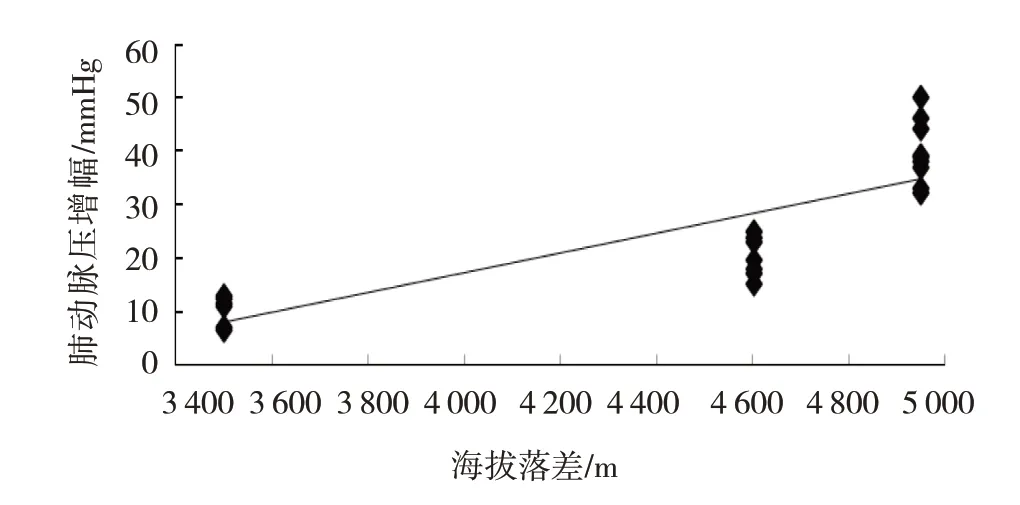
图5 海拔落差与肺动脉增幅的相关性
3 讨论
高原环境下除低压低氧对机体有影响之外,寒冷也是重要的影响因素[2-4]。对低压氧舱模型复制(5 000 m)和高原现场模型复制(4 300~4 614 m)的前期研究进行比较发现在同一海拔或相近海拔,无论常温还是低温,同一来源地大鼠的肺动脉压增幅效果基本一致,说明寒冷并不参与高原肺动脉高压的形成机制。有研究报道低压氧舱模型复制和高原现场模型复制指标无论从生理学指标、分子生物学或肺血管平滑肌增厚的形态学等方面均获得一致性结果[5-7]。这里值得注意的是,大鼠来源地海拔与模型复制时海拔之间的海拔落差是影响高原肺动脉高压动物模型复制的重要因素,本研究结果表明,就海拔而言,北京、西安、兰州的大鼠来源地海拔与现场模型复制或低压氧舱模型复制时海拔落差依次降低,而肺动脉压增幅和模型复制成功率也依次下降。其中北京大鼠在5 000 m 海拔低压氧舱复制模型第21 天即可达到100%的成功率,因此提示,与北京同一海拔或更低海拔的大鼠进行高原肺动脉高压模型复制时,只需21 d 即可,无须30 d,避免不必要的时间、经济和精力上的浪费。而与西安同一海拔来源大鼠进行高原肺动脉高压模型复制时,仍以30 d 复制模式为主[8-9],否则就达不到模型复制效果,有研究高原型肺动脉高压时将西安大鼠低氧暴露(6 000 m)21 d,平均肺动脉压并不能达到模型复制的要求[10],但也有研究将模型复制时间在此基础上延长15 d,以获得更好的效果[11]。兰州的大鼠进行高原肺动脉高压模型复制,30 d 模型复制时间略显不足,有必要再延长7~14 d。
海拔落差是影响模型复制成功的核心问题,海拔落差越大,大气氧含量下降就越显著,机体需要更强大的代偿能力才能获得足够满足机体活动的氧气,然而机体的代偿能力是有限的。因此,一般情况下海拔越高,代偿能力不足(或下降)也就越明显,也就更容易发生高原病。有研究[12]发现,从平原进入海拔3 700 m 和4 200 m 的两组人,4 200 m组人用力肺活量和6 min 步行实验显著下降,而与高原肺动脉高压形成密切相关的低氧诱导因子1 和内皮素1 显著升高,这就表明随着海拔落差的增大,机体的代偿能力也随之降低,海拔落差增大,会促进肺动脉平滑肌增厚的血管内皮生长因子上调[13]。而影响这些因子改变的外在因素是低氧,有研究[14]通过大鼠实验发现其内在因素在于平原大鼠对高原的习服能力,即遗传补偿能力不足。而模型复制地的海拔,高原现场以4 300 m 以上为宜[15],低压氧舱以5 000 m 为宜。
综上所述,无论是高原现场模型或低压氧舱模型,模型复制的成功率与大鼠的来源地海拔和暴露低氧时间密切相关,在同一海拔进行模型复制时,大鼠来源地海拔越低,其暴露低氧所需时间就越短,反之就越长。而温度并不影响高原肺动脉高压模型的复制。
