经导管行二尖瓣生物瓣毁损并重度主动脉瓣狭窄双瓣置换1 例
2022-04-06杨杰王斌陈翔程龙王焱
杨杰 王斌 陈翔 程龙 王焱
1 临床资料
患者 女,76岁。因“二尖瓣换瓣术后15年,胸闷气促1年”于2021年11月8日就诊于厦门大学附属心血管病医院。患者15年前因风湿性心脏瓣膜病行二尖瓣生物瓣置换术(置入瓣膜:Medtronic HANCOCK Ⅱ PROCINE 25 mm),术后一般情况好转;1年前开始出现胸闷、气促,活动后明显并逐渐加重,遂再次就诊于厦门大学附属心血管病医院。既往有心房颤动、慢性阻塞性肺病、肾功能不全、左心耳血栓、高血压病、糖尿病、脑梗死等病史。入院查体:血压105/49 mmHg(1 mmHg=0.133 kPa),脉搏64次/分,呼吸20次/分,半卧位,心律不齐,心室率约76次/分,主动脉瓣听诊区可闻及4/6级收缩期杂音,向颈部传导,伴震颤,二尖瓣听诊区可闻及舒张期隆隆样杂音。
实验室检查:超敏心肌肌钙蛋白T 28.1 ng/L(参考值:0~100 ng/L),N末端B型脑钠肽前体972 pg/ml(参考值:0~125 pg/ml),血红蛋白96 g/L,肌酐64.8 μmol/L,估算的肾小球滤过率79.85 ml/(min·1.73 m2),谷丙转氨酶8.1 U/L,白细胞计数、血小板计数、血电解质均在正常范围。心电图示:心房颤动,部分导联ST-T改变。超声心动图示:左心房及左心耳未见血栓形成,二尖瓣生物瓣置换术后再狭窄(mitral stenosis,MS)(重度)并反流(中重度),主动脉瓣狭窄(aortic stenosis, AS)(重度),主动脉瓣峰值压差(PGmax)64 mmHg,平均压差(PGmean)41 mmHg,收缩期主动脉瓣峰值血流速度4.0 m/s,连续方程计算主动脉瓣口面积0.6 cm2;二尖瓣PGmax39 mmHg,PGmean12 mmHg,舒张期二尖瓣峰值血流速度3.11 m/s,连续方程计算二尖瓣口面积1.16 cm2;重度三尖瓣反流收缩期最大反流速度 4.07 m/s,反流压差41 mmHg,计算肺动脉压力为76 mmHg;左心室舒张末期内径46 mm;左心房内径55 mm;右心室内径31 mm;右心房内径55 mm;左心室射血分数64%(图1 A、B)。冠状动脉CT血管造影示:左前降支轻度狭窄,余未见明显狭窄。CT评估参数:左心房扩大并明显钙化,二尖瓣环周长89.5 mm,二尖瓣环面积490 mm2,主动脉瓣瓣环周长66.2 mm,主动脉瓣面积331.7 mm2,左冠状动脉高度12.6 mm,右冠状动脉高度13.2 mm,二尖瓣-主动脉瓣角度120.9°,重建后左心室流出道(neoleft ventricular outf low tract, neo-LVOT)面积188.1 mm2(图1 C~I)。

图1 患者超声心动图参数 A. 术前主动脉瓣超声心动图参数;B. 术前二尖瓣超声心动图参数;C~I. CT 评估参数:左心房扩大并明显钙化,二尖瓣环周长89.5 mm,二尖瓣环面积490 mm2,主动脉瓣瓣环周长66.2 mm,主动脉瓣面积331.7 mm2,左冠状动脉高度12.6 mm,右冠状动脉高度13.2 mm,二尖瓣-主动脉瓣角度120.9°,重建后左心室流出道面积188.1 mm2;J.术后主动脉瓣超声心动图参数;K. 术后二尖瓣超声心动图参数
初步诊断:风湿性心脏瓣膜病、二尖瓣外科生物瓣置换术后、重度AS、重度MS(伴中重度反流)、重度三尖瓣反流、纽约心脏病协会心功能分级Ⅲ级、冠状动脉粥样硬化,心房颤动、高血压病、糖尿病、慢性阻塞性肺病、肾功能不全、脑梗死个人史。
入院后评估外科再次瓣膜置换手术风险高,美国胸外科医师协会评分高危;此外,患者及其家属拒绝再次外科手术。经我院结构性心脏病团队讨论后,考虑对患者经微创途径行双瓣膜置换术。术前CT血管造影和经食管超声心动图评估提示:冠状动脉阻塞风险低,二尖瓣与主动脉瓣生物瓣之间夹角>120°,模拟置入双瓣中瓣后,测定收缩期最小neo-LVOT的可用面积>150 mm2,LVOT梗阻风险也非常小。结合患者意愿、测量尺寸及模拟置入结果,拟采用VenusA Plus联合Edwards SAPIEN 3瓣膜行双瓣膜置换。因导管或器械进入左心或动脉系统需要肝素化,遂在穿刺股动、静脉成功并放置鞘管后,先行房间隔穿刺成功后予以肝素化。再经股动脉路径行经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR),然后经股静脉路径行经导管二尖瓣置换术(transcatheter mitral valve replacement,TMVR)。
手术在杂交手术室进行,对患者进行全身麻醉后,并用经食管超声心动图及X线监测指引。经右颈内静脉植入心脏临时起搏电极,穿刺右侧股动脉作为TAVR路径,穿刺右侧股静脉作为TMVR路径。患者左心房扩大并明显钙化,为房间隔穿刺造成了一定的困难,通过经食管超声心动图和X线透视,精准评估房间隔穿刺点和高度后,于外科电刀辅助下在房间隔穿刺点局部“放电”,在卵圆窝偏下后方位置顺利进入左心房,留置钢丝后予以肝素化。通过右侧股动脉送入20 F Gore鞘管,按照常规TAVR流程,在主动脉瓣位置成功进行TAVR(VenusA Plus 23 mm瓣膜),测定术后PGmean为12 mmHg(图1 J)。然后通过左心房留置钢丝交换8.5 F Agilis可调弯鞘管,帮助顺利跨瓣,再次将鞘管交换为14 F Edwards E-sheath后,在二尖瓣生物瓣位置顺利完成瓣中瓣置换术(valve in valve,VIV)(Edwards SAPIEN 3 23 mm瓣膜),术后即刻二尖瓣PGmean降至7 mmHg(图1 K),双瓣置换手术顺利完成(图2)。
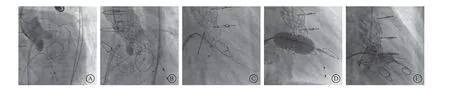
图2 患者造影影像 A.术前主动脉根部造影;B.经导管主动脉瓣释放后复查造影;C.输送系统跨二尖瓣;D. 经导管二尖瓣球囊释放; E.瓣膜释放后造影
术后随访:患者术后无特殊不适,未发生房室传导阻滞、心肌梗死、卒中、肾功能不全加重等不良事件。术后第6天复查超声心动图示:人工主动脉瓣及二尖瓣活动正常,压差未见明显增加,无瓣周反流。患者于术后第8天顺利出院。术后2个月随访,患者瓣膜工作、状态良好,心功能得到进一步改善,纽约心脏病协会心功能分级Ⅰ级(表1)。

表1 患者术前及术后超声心动图参数比较
2 讨论
近年来,随着TAVR在临床上的成功开展,TMVR亦备受关注[1]。与早期TAVR在临床应用类似,目前TMVR主要作为二尖瓣生物瓣毁损后再次外科手术高危患者的安全、有效替代治疗策略[2]。众所周知,生物瓣毁损后再次外科手术干预会带来术后发病率和死亡率的额外风险,这在老年患者尤其是75岁以上患者中尤为明显,其预计死亡率可能超过10%[3]。目前,经导管介入治疗已成为传统复杂瓣膜病变需要再次外科VIV的有效替代治疗策略,但因该类手术难度较高,风险较大,对术者及其团队要求极高,且主动脉瓣与二尖瓣的解剖相邻性,因此少有主动脉瓣及二尖瓣联合介入置换报道[4-5]。
主动脉瓣与二尖瓣狭窄绝大多数系风湿性心脏病所致,其临床诊治也具有较高的迷惑性。因单个主动脉瓣或二尖瓣重度狭窄均会降低心脏射血量,可能会导致另一个瓣膜血流量下降,降低跨瓣压差,导致瓣膜病变程度的低估。超声心动图及有创血流动力学检查对于瓣膜病变的评估和临床决策具有重要意义。本病例系风湿性心脏病、15年外科二尖瓣生物瓣毁损后再次瓣膜狭窄合并主动脉瓣狭窄患者,合并心房颤动,需要充分评估瓣膜病变严重程度及获益-风险比。在完善经食管超声心动图和CT血管造影重建分析后,明确主动脉瓣及二尖瓣均为重度狭窄,且左心房扩大并明显钙化,外科手术风险高危,neo-LVOT梗阻风险较小,具有较高的经导管瓣膜介入治疗获益-风险比,遂行经导管主动脉瓣及二尖瓣联合置换,并取得了较好的临床效果。同时,左心房扩大且钙化明显,对TMVR房间隔穿刺造成了一定的困难,在反复经食管超声心动图和X线透视后精准定位房间隔穿刺点,予以外科电刀“放电”局部消融辅助后顺利穿刺房间隔,具有较好的安全性和实用性。
在联合瓣膜介入治疗过程中,常需关注以下几点:(1)对于TAVR术,术前精确测量瓣膜大小至关重要。选择合适的瓣膜类型及释放高度,有利于减少严重的自体-假体瓣膜不匹配或严重瓣旁漏的风险;(2)对于球扩式瓣膜,合适的瓣膜尺寸十分重要,一般建议根据毁损瓣膜内支架直径最少增加1 mm;(3)与TAVR类似,合适的瓣膜尺寸及释放高度亦是TMVR术的关键,以减少装置心房迁移或LVOT梗阻的风险。在后者方面,二尖瓣-主动脉瓣成角小于115°、neo-LVOT面积小于150 mm2、室间隔肥厚和左心室偏小等被认为是LVOT梗阻的术前危险因素[6];(4)随着TMVR输送系统缩小化和可调弯等技术的进步,经股静脉房间隔穿刺路径已成为首选,因此对于部分房间隔外科或修补术后的患者,可能会增加手术难度,可尝试外科电刀局部消融辅助房间隔穿刺,但应注意房间隔穿刺点的解剖位置避免重要组织以及穿刺力度的把握,以避免严重的心脏穿孔;(5)TAVR联合TMVR时,因解剖限制,TMVR常用瓣膜为球囊扩张瓣膜(如Edwards SAPIEN 3),而TAVR可选用自膨式瓣膜或球囊扩张瓣膜,二者选择上除考虑经济因素外,更需要关注瓣膜支架对LVOT及邻近TMVR瓣膜等影响,球囊扩张瓣膜因瓣膜支架较小,在这点上具有一定的优势,但术前详细充分地CT血管造影分析和超声心动图评估[7]LVOT梗阻的风险后,亦可考虑置入自膨式瓣膜;(6)对于LVOT梗阻高危的患者,TMVR术前可尝试室间隔酒精化学消融以增加LVOT面积;(7)对于二尖瓣前叶冗长增加LVOT梗阻风险的患者,可尝试行瓣叶射频消融[8];(8)对于TMVR术后医源性房间隔缺损一般不常规封堵,但当有显著右向左分流或肺动脉高压伴右心衰竭时,可尝试经皮房间隔缺损封堵术[9];(9)瓣膜置换先后顺序十分重要,因导丝或导管进入动脉或左心系统后需常规肝素化,故应在TMVR房间隔穿刺成功后予以肝素化,以避免栓塞事件发生。在完成TAVR手术,增强心脏耐受后再继续行TMVR。
总之,随着瓣膜中心的建设和经导管瓣膜介入治疗的普及,外科手术高危、生物瓣毁损、联合瓣膜病变等越来越多的患者获益于该技术,术前详细的评估,采取个体化的治疗决策是取得良好临床结局的重要保证。
利益冲突 所有作者均声明不存在利益冲突
