沉默CD44表达对鼻咽癌细胞周期及凋亡的影响
2022-04-06李云霄周海波许新华
苏 进 梅 君 郑 洲 李云霄 周海波 许新华
(1. 三峡大学 第一临床医学院[宜昌市中心人民医院] 肿瘤科 & 三峡大学 肿瘤防治中心, 湖北 宜昌 443003; 2. 湖北三峡职业技术学院附属医院 口腔科, 湖北 宜昌 443000)
鼻咽癌好发于我国华南地区,以同步放化疗为主的非手术治疗是其治疗的主要手段,目前晚期鼻咽癌的治疗效果仍不理想。近年来多项研究显示,隶属于黏附分子家族的白细胞分化抗原44(cluster of differentiation 44,CD44),不仅在鼻咽恶性肿瘤中高表达,且广泛参与鼻咽癌的发生、发展、转移及预后[1]。
本研究拟采用小干扰RNA(small interfering RNA,siRNA)技术抑制CD44基因表达,并研究CD44在鼻咽癌细胞周期和凋亡方面的作用。
1 材料和方法
1.1 材料
鼻咽癌SUNE-1 5-8F细胞购自中南大学高等研究中心细胞室;siRNA转染试剂购自上海吉玛基因公司;RPMI-1640培养基和胎牛血清购自美国Hyclone公司;RNA提取试剂盒、逆转录试剂盒购自日本Takara公司;兔抗人CD44单克隆抗体购自武汉博士德生物工程有限公司;DEPC-Treated Water购自美国AmBion公司;碘化丙啶液购自美国Biolegend公司;Rnase A购自生工生物工程(上海)有限公司;light cycler 480 SYBR Green I Master购自瑞士Roche公司;AnnexinV-FITC细胞凋亡检测试剂盒购自东仁化学科技(上海)有限公司。
1.2 实验方法
1.2.1 细胞的分组和转染
根据siRNA系列分别命名为:NC组、实验组(siRNA组)和空白对照组(Blank组)。Blank组为正常培养的SUNE-1 5-8F细胞,不转染任何RNA。NC组和实验组转染步骤严格参照Lipofectamine®RNAiMAX Reagent试剂盒说明书执行。根据既往研究,采用Real-time qPCR检测CD44 mRNA的表达,引物序列见表1,Western blot检测CD44蛋白的表达[2]。
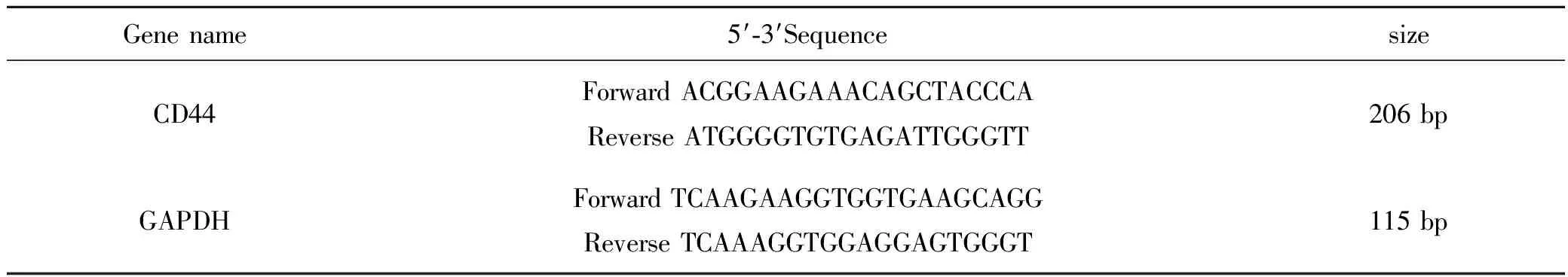
表1 引物序列表
1.2.2 流式细胞仪分析细胞周期情况
预先配置DNA染液,将碘化丙啶液20 μL、Triton X-100 1 μL、Rnase Asolution 0.2 μL,加入PH 7.4的PBS定容至1 mL,混匀,4℃避光保存。收集细胞,制成终浓度为1×106个/mL的细胞悬液,离心去上清,加入1 mL -20℃保存的70%乙醇,涡旋振荡使细胞分散,4℃固定过夜。离心弃上清,PBS清洗细胞2次,加入200 μL预先配好的DNA 染液,室温避光孵育15 min,尽快上机检测,计算细胞增殖指数(proliferation index,PI),PI(%)=[DNA合成(S)期细胞数+DNA合成后期(G2)细胞数/细胞分裂(M)期细胞数]/[DNA合成前(G1)期细胞数+S期细胞数+G2期细胞数/M期细胞数]×100%。
1.2.3 流式细胞仪分析细胞凋亡情况
借助Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡情况。转染48 h后,收集各组细胞的上清液及清洗液, 0.25%胰蛋白酶(不含EDTA)消化细胞,会同上述上清液及培养液一并离心,PBS洗涤2次,加入预先配好的1×Annexin V Binding液,制成终浓度为1×106个/mL的细胞悬液。取细胞悬液100 μL,加入Annexin V-FITC结合物5 μL,碘化丙啶液5 μL,室温避光孵育15 min;加入400 μL 1×Annexin V Binding液,1 h内上机检测,采用BeckmanCytExpert流式细胞仪检测凋亡率,凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.3 统计学方法

2 结果
2.1 CD44 siRNA抑制细胞CD44 mRNA表达
Real-time qPCR检测结果显示,siRNA组鼻咽癌SUNE-1 5-8F细胞中CD44 mRNA下调达96.4%,较NC组、Blank组的表达显著降低,差异均有统计学意义(均P<0.05),见图1。
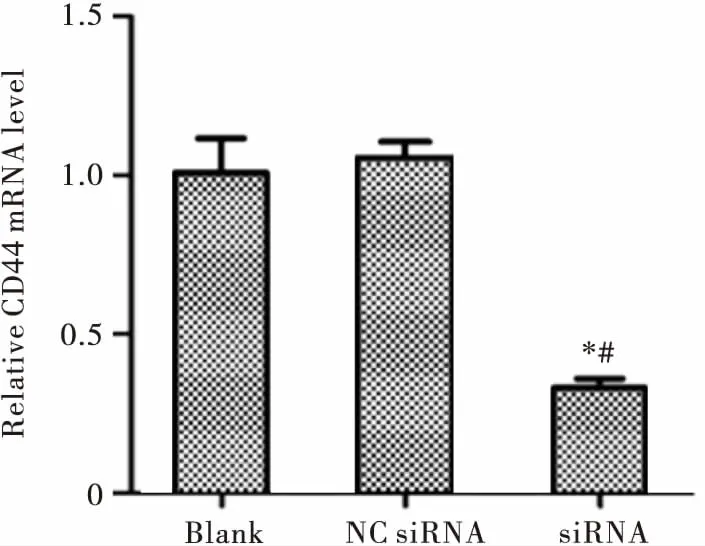
注:与Blank组相比,*P<0.05;与NC组相比,#P<0.05图1 Real-time qPCR检测SUNE-1 5-8F细胞中CD44 mRNA的表达
2.2 CD44 siRNA抑制细胞CD44蛋白表达
Western blot检测结果显示,siRNA组鼻咽癌SUNE-1 5-8F细胞中CD44蛋白表达下调达79.4%,较NC组、Blank组的表达显著降低,差异均有统计学意义(均P<0.05),见图2。
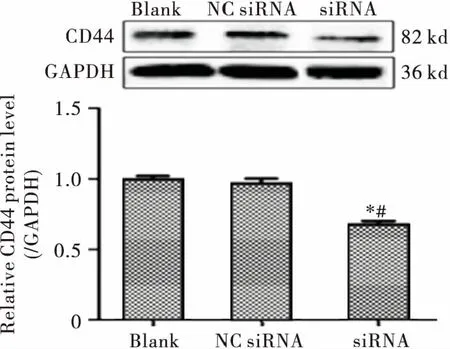
注:与Blank组相比,*P<0.05;与NC组相比,#P<0.05图2 Western blot检测SUNE-1 5-8F细胞中CD44蛋白的表达
2.3 流式细胞仪分析各组细胞周期分布情况
流式细胞仪检测结果显示,与NC组和Blank组相比,siRNA组细胞中处于G0/G1期细胞的比例明显升高(均P<0.05);而S期细胞的比例明显下降(均P<0.05),见图3。研究结果表明,CD44 siRNA抑制鼻咽癌SUNE-1 5-8F细胞增殖,使细胞生长阻滞于G0/G1期。

注:与Blank组相比,*P<0.05;与NC组相比,#P<0.05图3 CD44 siRNA对SUNE-1 5-8F细胞周期的影响
2.4 流式细胞仪分析细胞凋亡情况
流式细胞仪检测结果显示siRNA组、NC组、Blank组的凋亡率分别为8.62%、4.53%和4.35%;siRNA组细胞凋亡率明显高于NC组和Blank组,差异有统计学意义(均P<0.05),见图4。该结果表明,下调CD44的表达可以诱导SUNE-1 5-8F细胞凋亡。
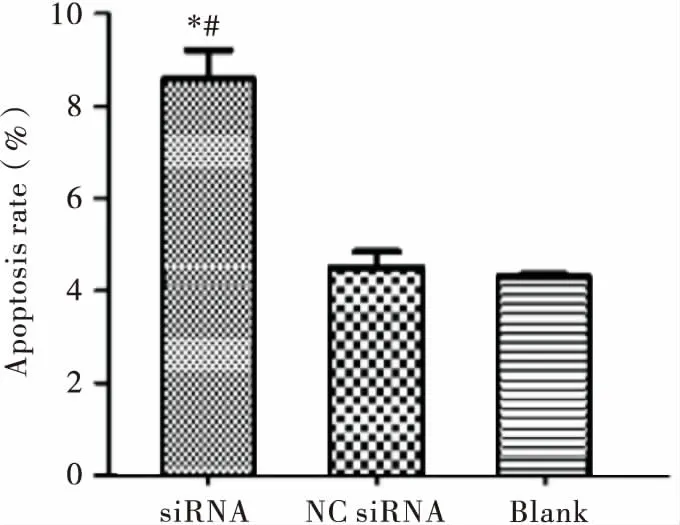
注:与Blank组相比,*P<0.05;与NC组相比,#P<0.05图4 CD44 siRNA对SUNE-1 5-8F细胞凋亡的影响
3 讨论
CD44通过多种途径广泛参与细胞-细胞/基质间黏附、细胞内外信号转导及淋巴细胞归巢等重要功能。CD44过表达与多种肿瘤的发生、生长、侵袭、转移和预后密切相关[3]。近年研究表明,调控肿瘤细胞中CD44基因的表达可影响细胞增殖、侵袭、凋亡、放化疗敏感性等生物学特性。Günthert等[4]报道,转染CD44后的淋巴瘤细胞转移能力明显提高。张映城等[5]研究发现,CD44+MKN-45胃癌细胞较CD44-细胞拥有更强的侵袭和增殖力、更易成瘤及转移。胡琛等[6]发现,CD44的表达与鼻咽癌细胞转移能力呈正相关,且CD44可通过调控上皮-间质转化进程影响其转移能力。Lun等[7]报道,CD44+NPC细胞较CD44-细胞对化疗药物更具抵抗性,具有更高的克隆形成率。我们的前期研究亦证实,CD44+鼻咽癌细胞具备高增殖能力、高表达干细胞标志物、放化疗抵抗等特性[8]。
现有众多研究报道,沉默或减弱CD44基因表达可抑制胃癌[9]、乳腺癌[10]、胆囊癌[11]、喉癌[12]、脑胶质瘤[13]、骨肉瘤[14]等细胞的增殖、侵袭和迁移。刘彦平等[15]报道,特异性CD44 siRNA可有效逆转白血病多药耐药细胞株K562/A02的多药耐药性。Wang等[16]报道,CD44v6基因敲低可通过促进凋亡和抑制自噬来增强HT29细胞的化学敏感性。胡杨丽等[17]亦报道,敲减CD44可调控乳腺癌细胞周期,促进细胞凋亡和坏死,降低细胞侵袭力。另有学者报道[18],通过下调人EGFR野生型非小细胞肺癌H460细胞株中CD44表达,可减弱EGFR信号转导,增加H460细胞对顺铂的化疗敏感性,使细胞周期阻滞于G0/G1期,并诱导细胞凋亡。
在本研究中,CD44 siRNA抑制鼻咽癌SUNE-1 5-8F细胞增殖,使细胞生长阻滞于G0/G1期,并诱导细胞凋亡,实验结果与既往研究结果一致,其具体机制有待更深层次的研究。另外,siRNA沉默CD44表达后,对细胞迁移、侵袭及放化疗敏感性等其他生物学特性的影响也值得我们进一步探索。
