CT引导下肝异位脾脏穿刺1例
2022-04-05李盖潘红红陈伟彬
李盖 潘红红 陈伟彬
华北理工大学附属医院CT室 河北唐山 063000
脾脏异位种植是指发生外伤性脾破裂或脾脏切除术后,脾脏组织自体种植在脾脏周围、结肠周围或腹腔其他部位。多数患者无临床症状,仅在体检或其他检查时无意中发现。其中脾脏的肝异位种植十分罕见,临床无明显症状,影像学表现无特异性,易误诊为肝脏肿瘤等,无创性检查诊断十分困难,所以CT引导下穿刺取病理活检从而定性诊断成为一种较为直接有效的诊断方法。
1 病历报告
患者,女,38岁,既往行脾脏切除术。2021年6月8日因无明显诱因出现间断咳嗽、少痰,伴气短,无发热,自服莫西沙星等药物后症状有所缓解来我院就诊。查体神志清楚,精神尚可,全身皮肤及巩膜无黄染,腹平软,全腹无压痛、反跳痛及肌紧张,移动性浊音阴性,下肢无水肿;行胸部CT平扫检查见肝内低密度灶,见图1。后遵循患者及家属意愿行CT引导下穿刺,取病理活检。
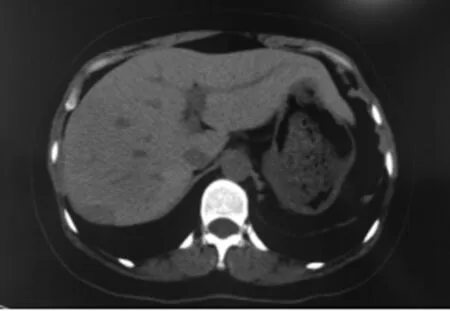
图1 CT胸部平扫见肝右叶被膜下低密度灶
术前与患者家属交代穿刺风险及意义,患者家属知情同意。于CT选定的右腹壁处穿刺,患者仰卧位,于穿刺点处常规消毒皮肤,铺无菌孔巾,2%利多卡因局麻后,垂直进入穿刺针,取出两条血样组织条,拔出穿刺针。消毒术区,应用无菌敷贴覆盖局部。组织条送病理检查。患者术后未诉不适,随后观察。
送检标本大体所见为灰黄线状组织两条,长约0.4cm、0.8cm,光镜下可见两种成分,一种为正常肝组织,结构基本存在;另一种为小灶富含血窦样的淋巴组织,其中可见淋巴滤泡和大量的红细胞,考虑血淋巴结,Heppar-1(肝细胞+)、CK8/18(+)、CD34(-)、CD3(T细胞+)、CD20(B细胞+)、MPO(中性粒细胞+)、CD68(组织细胞+),结合临床,考虑为异位种植的脾脏组织,见图2。

图2 光镜下正常肝组织及小灶富含
2 讨论
脾脏血窦十分丰富、再生能力强,游离破碎的脾组织可以种植于肝包膜表面或肝包膜有破口时种植于肝内,也可经门静脉系统血源性播散入肝脏,低氧环境诱导其增殖形成肝内异位脾脏[1]。多病例总结提示,异位的脾组织在CT平扫上类似于肝脏或肌肉的密度,强化扫描时可呈明显强化或类似于脾脏的花斑样强化,也可与脾脏强化不同。核磁共振成像(MRI) 平扫呈T1WI等或稍低信号,T2WI呈等或稍高信号,强化特点也可类似脾脏组织。但在 CT及 MRI 上的表现均无特异性,易与肿瘤等疾病相混淆,因此临床上一直寻找更为有效的诊断技术[2]。
CT引导下经皮穿刺活检技术已经日臻成熟,在许多疾病的定性诊断方面发挥重要作用。其操作安全,虽然少数患者出现穿刺部位疼痛、低热、肝包膜少量出血等并发症,但症状相对轻微,大部分均可自行缓解。CT引导下穿刺,可全面了解套管针在肝内的位置,实现准确定位、定向,提高一次性穿刺成功率,弥补单纯影像学诊断的局限性,且诊断有较高的准确率。
脾脏是淋巴器官,在免疫功能方面发挥至关重要的作用;脾破裂或者脾脏切除后的患者免疫功能会有所下降,容易发生爆发性感染;脾组织碎片异位种植的患者发生爆发性感染的几率会降低。因此,腹腔异位脾种植有其一定的生理意义。肝内异位脾脏种植多数情况下只需定期随访,若为血液病脾切除者,则需根据病情决定是否切除病灶。另外,脾脏的异位种植要和副脾相区分,前者后天种植形成,可以发生在腹腔任何部位,没有脾门,由穿透异位组织结节的小血管供血;而前者为先天性的,有脾门,位于脾脏周围系膜处,由脾动脉的分支供血。
脾脏切除术后的脾组织肝异位种植十分罕见,有时在CT增强和MRI检查下均难以排除肝脏肿瘤,单纯影像诊断十分困难。本例患者行CT引导下穿刺取病理活检,结合既往脾脏切除史,证实为脾组织的肝异位种植,弥补了单纯影像诊断的不足,更为直接有效;避免了不必要的检查和手术,为疾病的诊治带来了新的经验。另外,因异位的脾组织能特异性摄取放射性核素99mTc-DRBC(99mTc-热变性红细胞),从而实现选择性脾显像,所以也是目前诊断异位脾种植较为有效的一种方法。
