游离SiO2粉尘对小鼠BMDCs细胞因子表达影响的体外实验
2022-04-05曲高阳陈雨刘姿张国冰郝小惠沈福海李金龙
曲高阳 陈雨 刘姿 张国冰 郝小惠 沈福海 李金龙
华北理工大学公共卫生学院(河北省器官纤维化重点实验室) 河北唐山 063210
游离二氧化硅(silicon dioxide,SiO2)粉尘俗称矽尘,是我国采矿、隧道、建筑、喷砂、陶瓷等行业中存在的主要职业性有害因素。据国家卫生健康委员会公布的2020年我国卫生健康事业发展统计公报显示,2020年全国共报告各类职业病新病例17064例,其中职业性尘肺病及其他呼吸系统疾病14408例,而职业性尘肺病14367例,占各类新发职业病的84.19%(14367/17064),可见防治尘肺病是职业病防治工作的重中之重。矽肺是一种由于生产过程中长期吸入游离SiO2粉尘而引起的以肺部弥漫性纤维化为主的全身性疾病,其进展快、死亡率高且影响范围广。近年来,国内外学者围绕矽肺发生的免疫学机制进行了相关研究后发现,矽肺的发生早期始于巨噬细胞识别和吞噬SiO2粉尘后激活的固有免疫反应,然后凋亡和崩解的巨噬细胞释放大量促炎活性因子,引起适应性免疫应答失衡并扩大炎症反应,继而影响肺组织损伤修复过程,最终导致不可逆的肺部间质纤维化[1-3]。目前关于游离SiO2粉尘效应靶细胞的研究大多集中于巨噬细胞、中性粒细胞和T淋巴细胞等免疫细胞,然而对于能够初始和调节适应性免疫反应,且专职抗原提呈功能最为强大的树突状细胞(dendritic cells,DCs)的研究较为少见。因此,本研究以DCs为研究对象,初步探讨游离SiO2粉尘对小鼠骨髓源树突状细胞(bone marrow-derived dendritic cells,BMDCs)细胞因子表达的影响,试图从适应性免疫应答初始环节为探讨游离SiO2粉尘致肺部炎症和矽肺的发生提供理论线索。
1 材料与方法
1.1主要仪器与试剂 BioTek Epoch全波长酶标仪(美国BioTek公司)、QuantStudioTM 6实时荧光定量PCR仪(美国ABI公司)、NanoDrop2000核酸浓度测定仪(美国Thermo公司)HF90 CO2培养箱(美国Thermo公司)、SW-CJ-1CU超净工作台(苏州安泰空气技术有限公司)。
SiO2(美国SIGMA公司),RPMI-1640培养基(美国Gibco公司),青链霉素混合液、谷氨酰胺(以色列BI公司),HEPES缓冲液(以色列BI公司),胎牛血清(以色列BI公司),细胞增殖检测试剂盒(Cell Counting Kit-8,CCK-8,上海碧云天生物技术有限公司),TNF-α、IL-6、IL-1β、IL-12、IL-10、IL-23、TGF-β Mouse Uncoated ELISA Kit(美国Invitrogen公司),TMB显色终止液(上海碧云天生物技术有限公司),M5 Super plus qPCR RT kit(北京聚合美生物科技有限公司),2×M5 HiPer Realtime PCR Super mix(北京聚合美生物科技有限公司)。
1.2BMDCs细胞培养及分组 健康SPF级C57BL/6小鼠(6~8周,雌性),体质量18~22 g。小鼠及饲料均购自北京华阜康生物科技股份有限公司,实验动物生产许可证号:SCXK(京)-2019-0008。于华北理工大学医学实验动物中心屏障实验室饲养,动物室温度控制在(20 ± 2)℃,照明时间为(12 ± 2)h/d,相对湿度为50%~60 %。颈椎脱位法处死,分离后肢股骨。5mL注射器针头贯通股骨后,用1mL注射器吸取无菌PBS反复冲洗3~5遍,收集细胞后300 g离心力离心弃上清液。经红细胞裂解操作后PBS冲洗2~3遍,加入含10%胎牛血清、1%青链霉素混合液、1%谷氨酰胺、1%HEPES、GM-CSF (20 ng/mL)和IL-4(10 ng/mL)的RPMI1640培养液,经70 μm滤网过滤后将细胞接种于10cm2细胞培养皿中。当天记为第一天,将细胞培养板放入37 ℃,含5% CO2的饱和湿度孵箱中培养过夜,于第二天更换新鲜培养液后继续培养,隔天半量换液,于第八天用吸管轻轻吹打培养皿后收集悬浮细胞,CD11c+-FITC抗体流式细胞术鉴定BMDCs纯度>80%[4],可满足后续实验需要。
游离SiO2粉尘(粒径0.5~10 μm,1μm<80%粒径<5 μm,纯度>99%)经玛瑙研钵充分研磨2 h后进行高压灭菌处理,使用前用无菌PBS溶解 并经超声处理后进行染毒实验。将获得的BMDCs分为对照组、LPS阳性活化组、SiO2(10 μg/cm2)+ LPS处理组、SiO2(25 μg/cm2)+ LPS处理组、SiO2(50 μg/cm2)+ LPS处理组、SiO2(75 μg/cm2)+ LPS处理组、SiO2(150 μg/cm2)+ LPS处理组。具体处理方案:BMDCs经不同浓度SiO2预处理2 h后,加入25 ng/mL LPS继续孵育6 h或24 h,收集悬浮细胞或细胞上清液后进行相关指标的测定。
1.3BMDCs细胞活力测定 将收集的BMDCs按照1×105/mL细胞密度接种到96孔板中,每组设置4个平行样,并保证每孔RPMI1640培养液体积为100 μL。BMDCs经不同浓度SiO2预处理2 h后,加入25 ng/mL LPS继续孵育24 h,24 h后每孔加入CCK-8溶液10 μL,37 ℃, 5% CO2的环境下孵育3 h。于全波长酶标仪490 nm下读取吸光度值。
1.4BMDCs上清液中细胞因子含量检测 将收集的BMDCs按照5×105个/mL细胞密度接种到24孔板中,每组设置4个平行样。BMDCs经不同浓度SiO2预处理2 h后,加入25 ng/mL LPS继续孵育24 h,24 h后收集细胞上清液,300 g/min,离心5min后收集细胞上清液,置于-80 ℃冰箱保存待用。采用酶联免疫吸附法(enzyme-linked immuno sorbent assay,ELISA)测定BMDCs上清液中细胞因子含量。按照ELISA试剂盒使用说明依次进行包被抗原、阻断、样品加样、加酶标抗体和底物显色等操作,每孔加入TMB显色终止液50 μL,450 nm波长读数,制作标准曲线后分析数据。
1.5BMDCs目的基因转录水平测定 采用实时荧光定量PCR(real-time fluorescence quantitative PCR,Real-time qPCR)法测定BMDCs目的基因转录水平。将收集的BMDCs按照5×106/mL细胞密度接种到6孔板中,每组设置4个平行样。BMDCs经不同浓度SiO2预处理2 h后,加入25 ng/mL LPS继续孵育,6 h后轻轻吹打收集BMDCs,300 g离心力离心5 min后加入Trizol试剂,混匀静置5 min后-80 ℃冻存待用。取出经Trizol裂解的BMDCs室温解冻,12000 g/min离心10min(2~8 ℃),取上清液于1.5 mL离心管中,冰上孵育5 min,室温孵育5 min。每1 mLTrizol加氯仿0.2 mL。密闭后涡旋仪剧烈振摇15 s后常温孵育2~3 min,12000 g/min离心10min后液体分为三层。吸取上层无色水相,加入0.5 mL异丙醇使RNA沉淀,颠倒混匀,常温下(15~30 ℃)孵育10 min后12000 g/min离心10min。弃上清液,于定性滤纸上轻轻叩敲,吸干管内剩余的液体,1 mL 75 %乙醇洗RNA,7500 g/min,离心5 min,洗两遍。干燥后将RNA溶于DEPC水,测其浓度和纯度。
依次混合500 ng RNA模板、1 μL 10×gDNA plus remover mix,用DEPC水补足至10 μL后将反应液混匀,短暂离心后42℃温育2 min,然后置于冰上冷却。继续加入4mL 5×M5 RT Super plus Mix和DEPC水6mL,轻轻混匀,短暂离心后37℃孵育15 min,85℃加热 5 s使酶失活,置于冰上进行后续实验或-80 ℃保存。按照10 ng cDNA、10 mL 2 × M5 HiPer Realtime PCR Super mix、上下游引物(10 μm)各0.5 μL,引物序列见表1。无菌双蒸水补足致20 μL配置PCR扩增体系。反应条件:95℃预变性60 s,95℃变性15 s,55℃退火15 s,72℃延伸60 s,变性至延伸步骤循环40次,循环数(Ct值)≤35为有效扩增,记录荧光信号到达所设定的阈值时所经历的Ct值。以Gapdh为内参,按照△Ct值=目的基因△Ct值-内参基因Ct值,△△Ct值=(实验组目的基因Ct值-实验组组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值)方法依次计算出2-△△Ct值,即为目的基因的相对表达量。

表1 引物序列
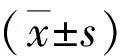
2 结果
2.1小鼠BMDCs细胞活力测定结果 与对照组相比, LPS阳性活化组BMDCs的细胞活力增强,差异具有统计学意义(P<0.05)。与LPS阳性活化组相比,75、150 μg/cm2SiO2抑制LPS活化的BMDCs细胞活力,差异具有统计学意义(P<0.05)。其余各浓度SiO2组未对BMDCs细胞活力产生明显影响。见图1。因此本研究选择10、25和50 μg/cm2三个浓度梯度进行后续实验。
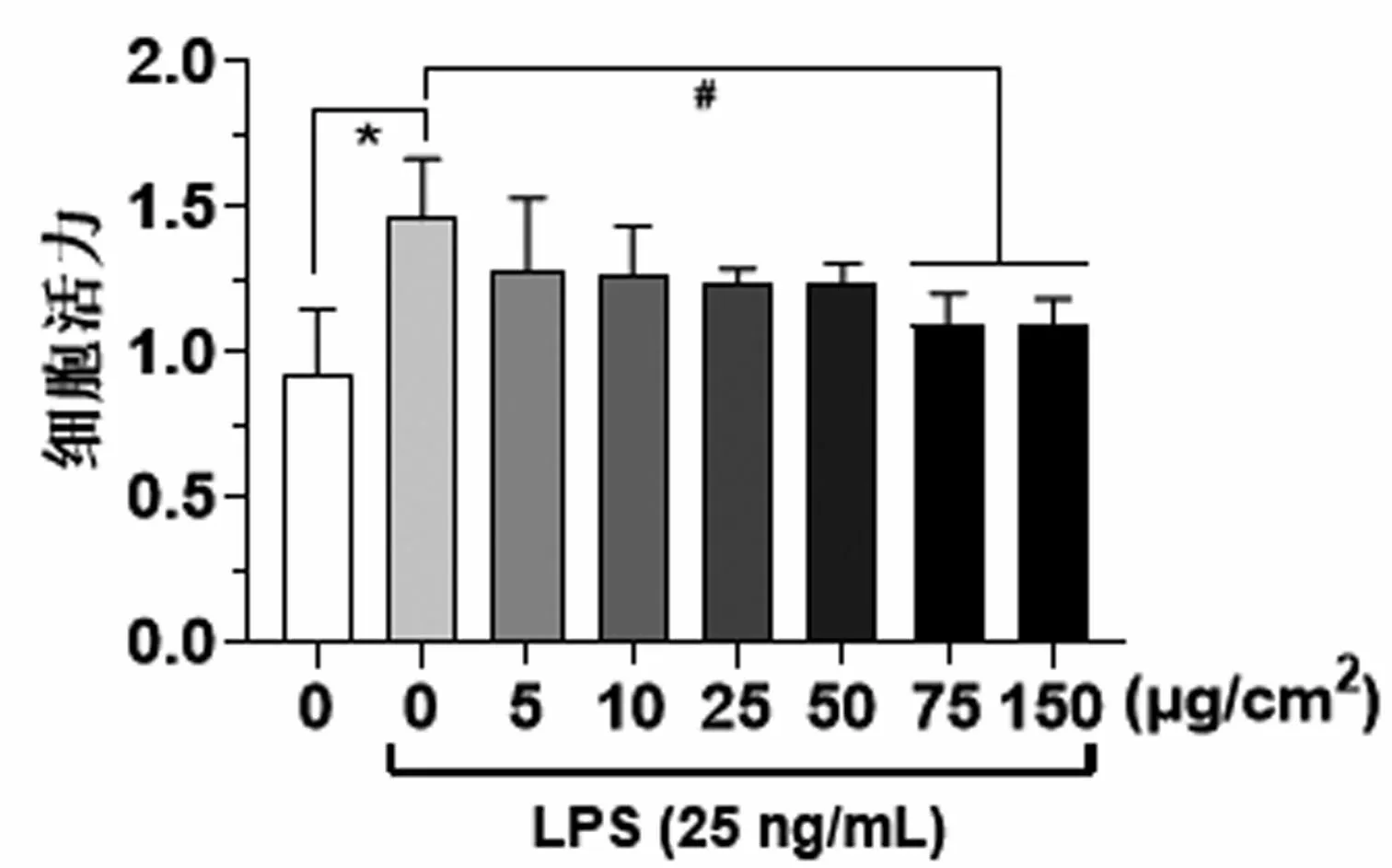
图1 各组BMDCs细胞活力比较
2.2游离SiO2粉尘对小鼠BMDCs分泌炎症因子的影响 与对照组相比,LPS阳性活化组TNF-α、IL-6和IL-1β水平升高,差异均有统计学意义(P<0.05)。与LPS阳性活化组相比,SiO2(10、25、50 μg/cm2)+ LPS处理组TNF-α水平升高,差异均具有统计学意义(P<0.05); SiO2(25、50 μg/cm2)+ LPS处理组IL-6水平升高而SiO2(10 μg/cm2)+ LPS处理组降低,差异均具有统计学意义(P<0.05);SiO2(10、25、50 μg/cm2)+ LPS处理组 IL-1β水平差异均无统计学意义(P>0.05)。见表2。
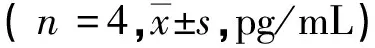
表2 游离SiO2粉尘对小鼠BMDCs分泌炎症因子的影响
2.3游离SiO2粉尘对小鼠BMDCs中炎症因子基因表达的影响 与对照组相比,LPS阳性活化组BMDCs中炎症因子TNF-α、IL-6和IL-1β的基因表达显著上调,差异均有统计学意义(P<0.05)。与LPS阳性活化组相比,SiO2(10、25、50 μg/cm2)+ LPS处理组BMDCs中炎症因子IL-6的基因表达均上调,差异均有统计学意义(P<0.05); 而TNF-α和Il-1β的基因表达未发生显著差异。见表3。
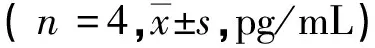
表3 游离SiO2粉尘对小鼠BMDCs中炎症因子基因表达的影响
2.4游离SiO2粉尘对小鼠BMDCs分泌T淋巴细胞诱导型细胞因子的影响 与对照组相比, LPS阳性活化组IL-12、IL-10、IL-23水平升高,差异均有统计学意义(P<0.05);而TGF-β水平差异无统计学意义(P>0.05)。与LPS阳性活化组相比,SiO2(10、50 μg/cm2) + LPS组IL-12水平降低,差异均具有统计学意义(P<0.05);SiO2(10 μg/cm2)+ LPS处理组IL-10水平降低,而SiO2(25 μg/cm2)+ LPS组IL-10水平升高,差异均具有统计学意义(P<0.05);SiO2(10、25 μg/cm2)+ LPS组IL-23水平升高,且差异均具有统计学意义(P<0.05);SiO2(25 μg/cm2)+ LPS组TGF-β水平升高,差异有统计学意义(P<0.05)。见表4。
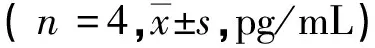
表4 游离SiO2粉尘对小鼠BMDCs分泌T淋巴细胞诱导型细胞因子的影响
2.5游离SiO2粉尘对小鼠BMDCs中T淋巴细胞诱导型细胞因子基因表达的影响 与对照组相比,LPS阳性活化组IL-12b、IL-10和IL-23α的基因表达上调,差异均有统计学意义(P<0.05)。与LPS阳性活化组相比,SiO2(10、25 μg/cm2)+ LPS处理组IL-12b和IL-23α的基因表达下调,SiO2(25、50 μg/cm2)+ LPS处理组IL-10的基因表达下调,且差异均具有统计学意义(P<0.05)。见表5。
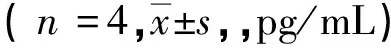
表5 游离SiO2粉尘对小鼠BMDCs中T淋巴细胞诱导型细胞因子基因表达的影响
3 讨论
矽肺是一种长期吸入游离SiO2粉尘所致的职业性疾病,可引起肺部慢性炎症、进行性肺纤维化以及全身性免疫功能失常[5]。国内外学者近些年从机械刺激学说、氧化应激学说以及免疫学说等多角度阐述了游离SiO2粉尘致肺部炎症和矽肺的发病机制。从免疫学角度出发,游离SiO2粉尘作为职业性有害因素经呼吸道吸入肺部之后,患者迅速进入急性炎症反应阶段,主要表现为大量炎性细胞浸润和肺泡屏障的破坏,同时伴有趋化因子和细胞因子的大量释放。在此炎症反应阶段,DCs是连接固有免疫反应和适应性免疫反应的桥梁,在初始和调节幼稚T淋巴细胞介导的适应性免疫反应中发挥重要作用。随着游离SiO2粉尘的反复暴露,肺部早期的炎症反应进入纤维修复期,肺部的成纤维细胞增殖活化并释放胶原蛋白,逐渐出现弥漫性间质纤维化,并最终形成矽结节。基于以上矽肺演进的病理过程,本研究以小鼠BMDCs为研究对象,建立游离SiO2粉尘暴露的DCs体外模型,从适应性免疫应答初始环节为探讨游离SiO2粉尘致肺部炎症和矽肺的发生提供理论线索。
与经典的炎性刺激物LPS相比,已有研究报道SiO2不能有效地诱导巨噬细胞和DCs表达炎症因子TNF-α和IL-1β[6-7]。因此,本研究为了较为敏感的观察SiO2对BMDCs细胞因子表达的影响,我们首先给予BMDCs不同浓度SiO2预处理2 h后,加入25 ng/mL LPS继续孵育6 h或者24 h,收集悬浮细胞或细胞上清液后进行相关指标的测定。本研究结果显示25和50 μg/cm2SiO2明显促进LPS活化的BMDCs分泌炎症因子TNF-α和IL-6,而对IL-1β的表达无明显影响。与此研究结果相类似,Beamer 等[8]发现,100 μg/mL SiO2可以显著诱导经1 μg/mL LPS刺激的BMDCs分泌炎症因子TNF-α。Zhao和Chan等[9-10]的研究结果也分别证实,游离SiO2粉尘暴露的C57BL/6小鼠早期肺泡灌洗液中IL-6含量明显升高,且SiO2能够明显诱导巨噬细胞分泌炎症因子TNF-α和IL-6。He等[11]研究证实,与巨噬细胞相比,DCs细胞似乎具有更强大的IL-1β分泌能力,而关于SiO2诱导还是抑制巨噬细胞和DCs等免疫细胞表达IL-1β的研究结论目前尚不完全一致[12-14],猜测可能是与实验中所采用的SiO2粒径、浓度以及不同的细胞模型有关。
矽肺的发生是多种细胞与分子共同参与的免疫学过程,涉及固有免疫、适应性免疫以及非特异性免疫功能的异常变化。近年来研究发现,T淋巴细胞在矽肺发生发展过程中发挥调节作用[15]。T淋巴细胞主要分为CD4+T淋巴细胞、CD8+T淋巴细胞、细胞毒性T 细胞(cytotoxic T cell,CTL)等亚型。其中,CD4+T淋巴细胞又可进一步分为 Th1、Th2、Th17和Treg型细胞,此四类细胞的增殖分化除与DCs细胞表面主要组织相容性复合体(major histocompatibility complex,MHC)II和协同刺激分子CD86/CD80的表达密切相关外,还接受免疫微环境中复杂的细胞因子调控。DCs细胞分泌的Th1诱导型细胞因子IL-12能够诱导幼稚T淋巴细胞分化为Th1细胞,进而在炎症早期发挥作用;DCs细胞分泌的Th2诱导型细胞因子IL-4和IL-10能够诱导幼稚T淋巴细胞分化为Th2细胞,同时辅助B淋巴细胞活化,发挥体液免疫的作用;DCs细胞分泌的Th17诱导型细胞因子IL-6和IL-23则能够诱导幼稚T淋巴细胞向Th17细胞分化,在自身免疫性疾病和机体防御反应中具有重要意义;DCs细胞分泌的Treg诱导型细胞因子TGF-β能够诱导幼稚T淋巴细胞向Treg细胞分化,参与成纤维细胞的活化,在肺损伤的纤维修复期发挥作用。
本研究结果显示,与LPS阳性活化组相比,经10 μg/cm2SiO2染毒的BMDCs中IL-12和IL-10的蛋白和基因表达水平均降低,而25 μg/cm2SiO2染毒的BMDCs细胞上清液中IL-23和TGF-β的含量明显升高。Beamer 等[8]的研究结果也证实,与LPS阳性活化组相比,经 SiO2染毒的BMDCs细胞上清液中IL-10的含量明显降低。Bao等[16]在建立的小鼠矽肺模型早期炎症反应中也发现,小鼠肺组织中Th1诱导型细胞因子Il-12基因表达下降。本实验中发现SiO2诱导TNF-α分泌;而有研究发现TNF-α可以调节Th17细胞分泌[17],推测经SiO2染毒的BMDCs通过上调TNF-α、IL-6和IL-23表达,很可能为Th17细胞的增殖和分化提供合适的免疫微环境,此推测也简介佐证了Song和Re SL等的研究结论[15, 18]。除此之外,本研究观察到SiO2能够诱导小鼠BMDCs分泌少量TGF-β,此结果与关于矽肺成因的主流观点不谋而合。近年来,部分学者认为CD4+ T淋巴细胞介导的适应性免疫反应在矽肺演进中的作用多体现在矽肺早期的炎症反应阶段,然中性粒细胞、巨噬细胞和成纤维细胞交织的固有免疫反应在矽肺晚期间质纤维化和矽结节形成中的作用更为重要,此观点目前尚不统一[15, 19]。
综上所述,游离SiO2粉尘可促进小鼠BMDCs分泌炎症因子TNF-α,以及Th17诱导型细胞因子IL-23和Treg诱导型细胞因子TGF-β,同时抑制BMDCs分泌Th1诱导型细胞因子IL-12。
