慢性阻塞性肺疾病急性期血清白细胞介素-6、白细胞介素-13和白细胞介素-17A水平与GOLD分级的关系
2022-04-04庄兰妹陈海华朱婷季志娟王瑾
庄兰妹,陈海华,朱婷,季志娟,王瑾
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是临床常见的慢性呼吸系统疾病,炎症反应是COPD发生发展过程中最主要致病机制,由于长期进行性加重不可逆的气流受限,反复吸入有害气体或颗粒物后导致呼吸道形成慢性炎症[1-2]。COPD急性发作期(acute exacerbations of COPD,AECOPD)是指稳定期呼吸系统症状的恶化,尤其是出现呼吸困难、痰量增加和咳脓痰,需要改变原来的治疗方案。急性加重期的症状变化与严重程度相关,持续时间和严重程度直接影响病人的治疗,也增加了病人的住院时间和病死率。引起AECOPD的主要因素是细菌和病毒感染[3]。对COPD 病人仅凭临床症状判断是否合并细菌感染准确性较低,主观性强。而由于痰培养和药敏的滞后,细菌感染无法及时诊断,给临床治疗增加难度,使用经验性抗生素治疗往往受到争议。了解导致疾病进展的潜在免疫机制和相关呼吸道感染的易感因素是指导治疗的至关重要的因素。本研究通过检测COPD 稳定期和急性期病人血清炎症标志物的表达水平,探讨其与不同COPD 全球创议(GOLD)分级的关系,以期为临床病情判断、制定治疗方案和预后评估提供参考。
1 资料与方法
1.1 一般资料选取2017 年1 月至2018 年6 月上海市静安区市北医院呼吸内科收治的AECOPD 病人42 例为AECOPD 组,经过抗感染及对症治疗后COPD 稳定期病人42 例设为COPD 组,其中男性40例,女性2例,中位年龄70(60~88)岁。
纳入标准:①既往已明确诊断COPD 病人,肺功能:第一秒呼气容积/用力肺活量(FEV1/FVC)<70%;②近三个月未有急性发作;③心、肝、肾等重要脏器功能基本正常。排除标准:①合并其他呼吸系统慢性疾病者,如肺间质纤维化、肺结核等;②合并心血管、肝、肾、神经、血液或肿瘤等严重基础疾病病人;③有酗酒或药物滥用史,有听力障碍者。
入组42 例COPD 病人中超过70 岁有22 例(52.4%,22/42),吸烟28 例(66.7%,28/42),按照肺功能GOLD 分级:1 级(预测的FEV1%≥80%):7 例(16.7%,7/42);2 级(预测的FEV1%≥50%,FEV1%<80%):12 例(28.6%,12/42);3 级(预测的FEV1%≥30%,FEV1%<50%):12 例(28.6%,12/42);4 级(预测的FEV1%<30):11例(26.2%,11/42)
1.2 方法
1.2.1 标本采集及处理 AECOPD组收治入院时和治疗后稳定出院时分别抽取肘静脉血4 mL 放置于促凝管内,待血液完全凝固,4 000 rpm(1 700 g)离心15 min,收集上清液-80 ℃保存,避免反复冻融。
1.2.2 试剂与仪器 白细胞介素6(IL-6)、白细胞介素13(IL-13)、白细胞介素17A(IL-17A)试剂盒为Sunny ELISA Human IL-6、HumanIL-13 和Human IL-17A 购于上海联科生物技术有限公司,Mutishan Go酶标仪购自美国Thermo公司。
1.2.3 实验操作 标本检测IL-6、IL-13、IL-17A 严格按照说明书要求进行操作,采用酶联免疫双抗体夹心法双孔检测后取均值,IL-6、IL-13、IL-17A 的检测下限分别为0.37 ng/L、0.90 ng/L、0.55 ng/L。
1.2.4 肺功能检查 病人经过治疗稳定后进行肺功能评估,肺功能采用1 s呼气量容积占预计值的百分比(FEV1%)及1 s 呼气容积与用力肺活量的比值(FEV1/FEV)进行评价。采用GOLD 分级对稳定期病人进行分级。
1.3 观察指标对比两组之间血清PCT、C-反应蛋白(CRP)、IL-6、IL-13、IL-17A 和血液白细胞计数、嗜酸性粒细胞计数、红细胞沉降率水平的差异;分析各观察指标与不同GOLD分级的相关性。
1.4 统计学方法采用SPSS 21.0 统计软件进行实验数据处理与分析,经正态性检验和方差性检验,呈正态分布的计量资料以计量表示,进行两个独立样本的t检验,配对样本的比较采用配对t检验;呈非正态分别的计量资料以中位数(四分位数)[M(P25,P75)]表示,各组总体水平差异采用Kruskal-Wallis 法检验。两个独立样本的比较采用Mann-WhitneyU检验,配对样本的比较采用Wilcoxon 检验,相关性分析采用Person 相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 COPD 稳定期和急性期的感染相关血液指标的比较COPD 稳定期和急性期之间CRP、血沉(ESR)、PCT、白细胞计数(WBC)、中性粒细胞计数(Neu)、IL-6、IL-13和IL-17A的差异有统计学意义(P<0.01),嗜酸性粒细胞计数无明显统计学差异(P>0.05)见表1。COPD 急性期CRP、ESR、PCT、白细胞计数、中性粒细胞计数、IL-6、IL-13 和IL-17A 均显著高于COPD稳定期(P<0.05)见表1。
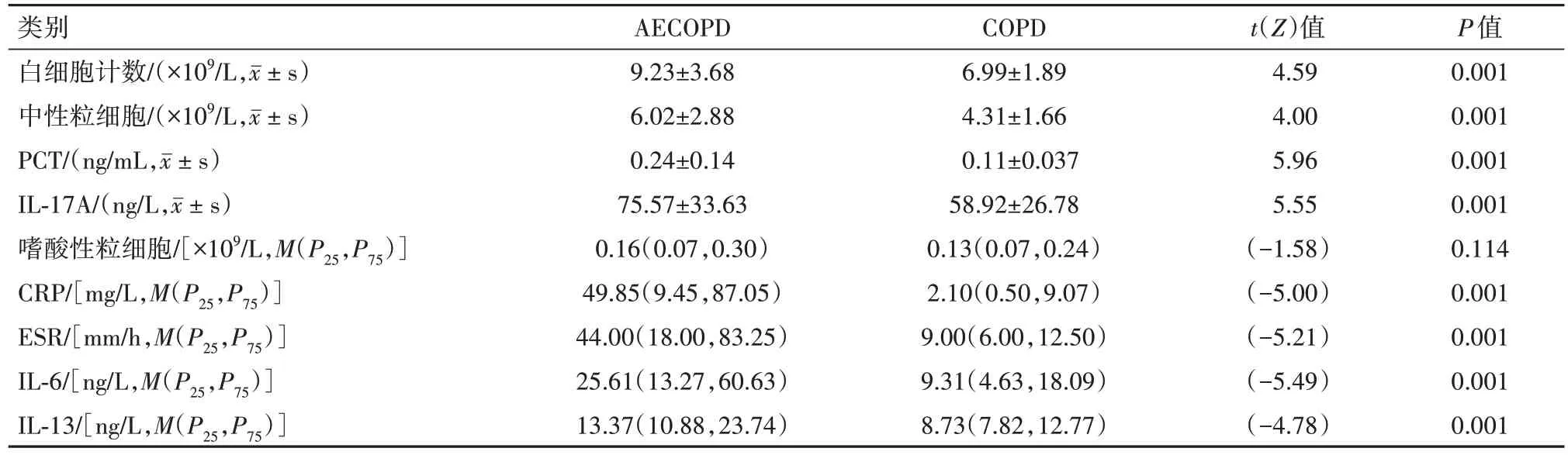
表1 COPD稳定期和急性期的感染相关血液指标
2.2 IL-6、IL-13 和IL-17A 与GOLD 分级的相关分析和比较经直线相关性分析,随着GOLD 分级的级别增高,急性期病人血清IL-13 和IL-17A 是增高的,GOLD 分级与急性期病人血清IL-13 呈正相关(r=0.58,P<0.01),与IL-17A水平呈正相关(r=0.53,P<0.01),与IL-6水平不相关(r=0.25,P=0.114)。GOLD-3 和GOLD-4 急性期病人血清IL-17A 水平显著高于GOLD-1 和GOLD-2(t=-4.78,P<0.01),GOLD-3 和GOLD-4 血清IL-13 水平明显高于GOLD-1 和GOLD-2(Z=-2.47,P=0.014),GOLD 分级各组血清IL-6 水平差异无统计学意义(P>0.05)。稳定期病人血清IL-17A 与GOLD 分级差异有统计学意义(F=3.29,P<0.05),其中稳定期病人IL-17A 水平与GOLD 分级呈正相关(r=0.57,P<0.01),GOLD-3 和GOLD-4 稳定期病人血清IL-17A水平显著高于GOLD-1 和GOLD-2(t=-2.50,P<0.05),见表2。
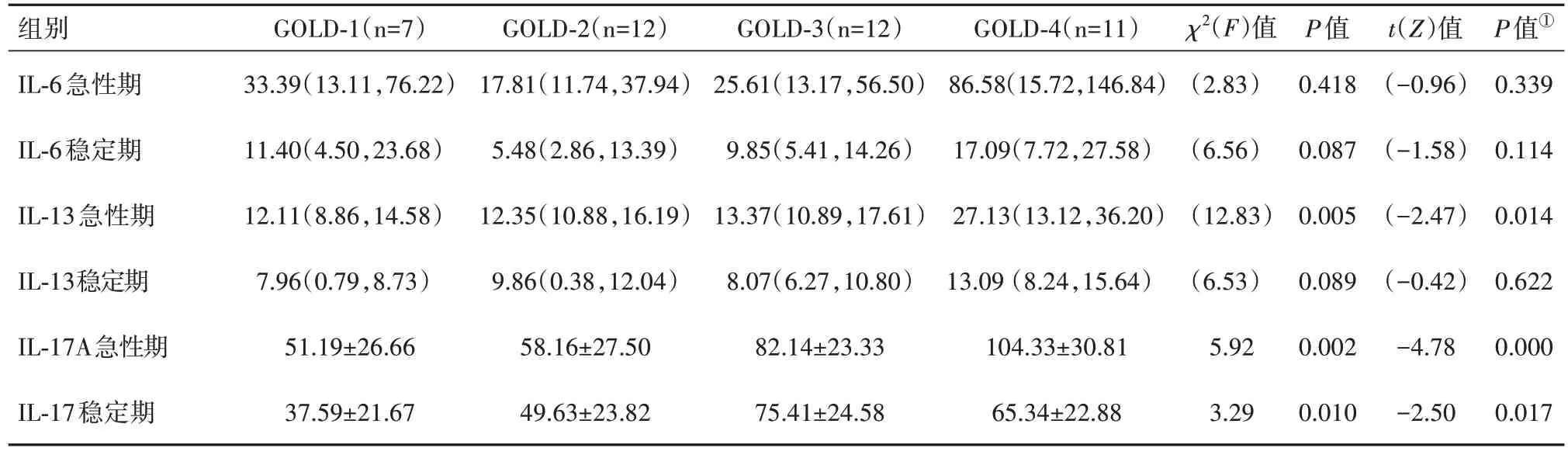
表2 GOLD分级各组间血清IL-6、IL-13和IL-17A水平表达差异/[ng/L,M(P25,P75)]
3 讨论
COPD 的病因和发病机制尚未发生完全解释。COPD 目前认为是一种气道的慢性炎症疾病,其特征是持续气流受阻[4]。COPD 仍然是全世界患病率和死亡率的主要原因[5]。吸烟是COPD 进展的主要危险因素,此外还有室内外污染和遗传因素。该疾病的特征是进行性持续的气道受限,临床急性加重主要与细菌和病毒感染相关[3]。感染加重了病人的临床症状导致运动能力、肺功能降低和病死率增加[6-7]。临床上AECOPD 主要是由下呼吸道的细菌感染引起,对COPD 病人仅凭临床症状判断是否合并细菌感染准确性较低,主观性强。临床中常用的血常规、CRP 和PCT 可辅助诊断急性感染。本研究中AECOPD 病人治疗前血清CRP 水平显著高于治疗后和对照组。但临床实际运用发现CRP 的特异性较低,因此英国胸科协会(BTS)指南不推荐使用CRP 作为肺部感染严重程度的标志物[8]。PCT 作为一个全身细菌感染的特异性生物标志物,但机体受创伤后也发现有PCT 升高,本研究AECOPD 病人血清经过抗菌治疗后显著降低。目前临床已常规使用PCT 指导对AECOPD、社区获得性肺炎和脓毒症病人的经验抗菌治疗,同时可辅助评价经验抗菌疗法的疗效[9]。
AECOPD 病人细菌感染时巨噬细胞不能及时清除凋亡细胞及细菌,从而引起严重炎症反应,造成炎性细胞和炎性递质如IL-13、IL-17、IL-8、IL-6,及肿瘤坏死因子(TNF-α)等升高,这些炎症递质可以破坏肺组织的正常结构、促进中性粒细胞的炎症反应[10-11]。因此,这些炎症相关的炎性因子指标联合诊断可能成为有效诊断的血清学标志物,并可指导AECOPD 的治疗及疗效评估。目前研究表明COPD 急性加重期的炎症反应的病理生理机制是由大量炎性细胞包括中性粒细胞,巨噬细胞聚集于呼吸气道及肺部终端组织内部,释放各种炎性递质如IL-8,TNF-α,IL-6,IL-13,IL-17 等最终造成肺部损伤[11-12]。IL-6 是急性促进炎症反应的细胞因子,可诱导细胞毒性T 淋巴细胞的增殖分化。IL-13 主要由Th2(CD4+)细胞分泌产生的,是一种具有免疫调节功能的细胞因子,参与多种免疫细胞因子的调控[12]。在COPD 中,IL-13 的主要生物学作用直接和间接导致气道高反应性、嗜酸粒细胞性炎症、支气管杯状细胞黏液分泌增多,引发气道管壁及周围炎症,破坏与修复持续存在,最终导致气管狭窄,肺气肿形成[12-14]。目前研究发现血清IL-13 可以作为COPD 气道狭窄的生物学标志物[15-16],给临床在今后治疗及监测COPD带来了新的契机[17]。在本组研究中急性期COPD病人随着GOLD 分级的级别增高,血清IL-13 逐渐增高,与GOLD 分级呈正相关,GOLD Ⅲ和Ⅳ级血清IL-13 水平明显高于GOLD Ⅰ和Ⅱ。IL-17 主要由外周血T 细胞(尤其是Th17 细胞)产生,IL-17 是体内最重要的促炎因子之一,参与机体多项炎症反应[18]。急性期和稳定期COPD 病人血清IL-17A均有较高水平,而COPD 病人血清中IL-17A 升高的原因是与Th17(T-helper cell 17,Th17)细胞和产IL-17 的CD8+细胞(IL-17-producing CD8+T-cellsT,c17)数增多相关[19]。研究证实COPD 病人气道痰中高浓度水平IL-17A 与中性粒细胞趋化因子CXCL8、IL-6 和气道阻塞相关,IL-17A 高表达于COPD病人气道壁和肺组织中的Th17 和Tc17 细胞[19-20]。IL-17A 通过诱导人表皮细胞、内皮细胞和成纤维细胞等多种效应细胞分泌IL-6、IL-8 和G-CSF,促进人成纤维细胞表达ICAM-1,趋化中性粒细胞形成炎症反应和促进血管形成,从而加重气道反应[18-22]。目前已有的研究证实IL-17 和IL-6 在内的炎症因子与气道炎症反应和重塑呈正相关[23]。AECOPD 病人血清IL-17A 水平显著高于稳定期,GOLD Ⅲ和Ⅳ级血清IL-17A 水平显著高于GOLDⅠ和Ⅱ。血清IL-17A 水平反映了COPD 急性发作期中炎症反应过程,也佐证了IL-17 与气道炎症反应和重塑密切相关,可以成为COPD 急性加重的临床观察重要指标。
参与COPD 的分子和细胞机制尚不完全清楚,目前临床没有有效的药物治疗、预防和控制COPD的进展。近年来对该疾病的治疗中使用长效支气管扩张剂,但是这类药物不能减少肺部黏膜和气道的慢性炎症反应,而广谱抗炎药的使用如皮质类固醇均出现治疗敏感性下降,由于部分病人血清中IL-17A 增多导致糖皮质激素受体β(glucocorticoid receptor-beta,GR-beta)上调,从而使糖皮质激素治疗的敏感性下降[24]。然而在COPD 稳定期病人血清IL-17A 水平与GOLD 分级呈正相关,GOLD Ⅲ和Ⅳ级稳定期病人血清IL-17A 水平显著高于GOLDⅠ和Ⅱ,检测血清IL-17A 水平在一定程度上间接反应GOLD 分级,给治疗带来了新契机,因而抑制IL-17A 的产生将成为COPD 病人治疗的新靶点。
总的来说,COPD 以进行性持续的气道受限为特征,血清IL-13、IL-17A 升高与GOLD 分级相关,而在急性加重期病人细菌感染时引起严重炎症反应,造成炎性细胞和炎性递质增多导致肺组织和肺功能的损伤,检测IL-6、IL-13 和IL-17A 相关细胞因子可指导COPD 病人的管理和治疗,将给临床在今后治疗及监测COPD带来了新的契机。
