益生菌补充剂对妊娠糖尿病患者炎症和氧化应激生物标志物的影响
2022-04-01梁芳娟焦蕾蕾刘梦云
梁芳娟,焦蕾蕾,刘梦云
1.北京中医药大学孙思邈医院妇产科,陕西 铜川 727100;2.陕西省森工医院妇产科,陕西 西安 710300
妊娠期糖尿病(gestational diabetes mellitus,GDM)属于糖尿病中常见的类型之一,该病主要是外周胰岛素的抵抗使机体的葡萄糖代谢异常,使胰岛细胞的功能减退,胰岛素的分泌受到抑制,从而引发血糖升高[1-2]。门冬胰岛素是临床降糖药中的一种,对餐后血糖、空腹血糖调节具有一定效果,且不易增加患者体质量,但长期使用可能会诱发低血糖,因此需要考虑引入其他药物进行替代治疗[3]。益生菌补充剂中的有效成分益生菌有助于提高胰岛素敏感性和维持良好的胆固醇水平,减少腹部脂肪堆积,帮助患者减轻体质量,尤其对于存在代谢障碍的人群[4]。本研究旨在探讨益生菌补充剂对GDM患者炎症和氧化应激生物标志物的影响,现报道如下:
1 资料与方法
1.1 一般资料 选取2019年6月至2020年10月北京中医药大学孙思邈医院收治的176 例妊娠期糖尿病患者进行前瞻性研究。纳入标准:①符合GDM的诊断标准者[5];②临床表现为“三多一少”,血糖>13.9 mmol/L、血酮体>5 mmol/L 者;③诊疗依从性较好,精神状况正常,能够遵从医嘱者。排除标准:①合并生殖系统疾病;②免疫功能障碍,合并重要内脏器官的功能性障碍;③高血压;④凝血功能障碍;⑤诊疗依从性差,不能配合研究者。按随机数表法将患者分为对照组和观察组,每组88 例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经我院伦理委员会批准,所有患者均知情并签署知情同意书。
表1 两组患者的一般资料()
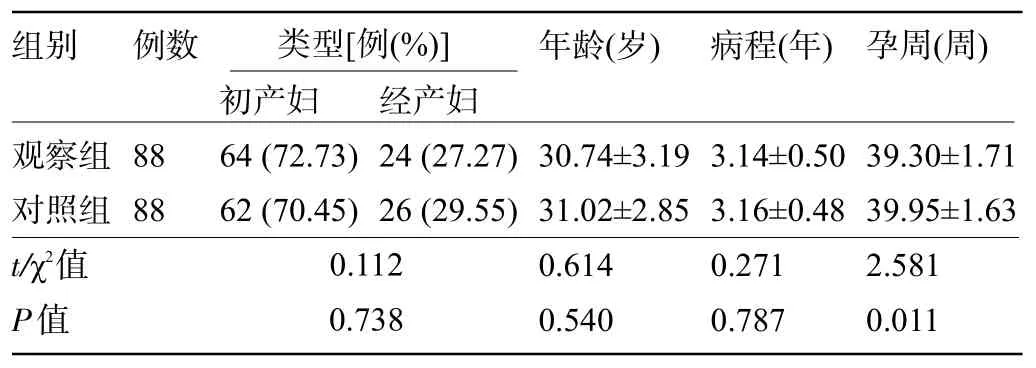
表1 两组患者的一般资料()
组别 例数 类型[例(%)]年龄(岁)病程(年)孕周(周)初产妇 经产妇观察组对照组t/χ2值P值88 88 64(72.73)62(70.45)24(27.27)26(29.55)0.112 0.738 30.74±3.19 31.02±2.85 0.614 0.540 3.14±0.50 3.16±0.48 0.271 0.787 39.30±1.71 39.95±1.63 2.581 0.011
1.2 治疗方法 对照组患者采用门冬胰岛素[规格:3 mL:300 U,厂家:诺和诺德(中国)制药有限公司,国药准字J20150073]皮下注射治疗,初始剂量为0.8~1 U/kg,2 次/d,可根据患者的病情程度逐渐调整剂量。观察组患者在对照组治疗基础上给予给予Protocol for Life Balance 益生菌补充剂(规格:60 片/瓶,厂家:Protocol for Life Balance Inc,产品编号:39400610253)口服治疗,1片/次,3次/d;两组患者的治疗时间为1个月。
1.3 观察指标与检测方法 (1)血糖:采用全自动生化分析仪对两组患者治疗前、治疗1 个月后空腹血糖(FBG)、餐后2 h血糖(2 hPG)、糖化血红蛋白(HbA1c)进行检测,并记录各项指标的变化情况;(2)胰岛素抵抗:治疗前、治疗1 个月后进行分析。胰岛β细胞分泌指数(HOMA-β)=(30 min 胰岛素-FINS)/(30 min 血糖-FPG),胰岛素抵抗指数(HOMA-IR)=FBG×空腹胰岛素(FNIS)/22.5;(3)炎症因子:治疗前、治疗1个月后,采用酶联免疫吸附法检测血清C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平;(4)氧化应激生物标志物:治疗前、治疗1个月后,采用酶联免疫吸附法检测丙二醛(MDA)的测定使用硫代巴比妥酸法,超氧化物歧化酶(SOD)、过氧化物酶(GSH-Px)的水平;(5)不良反应:比较两组治疗期间不良反应发生情况。
1.4 疗效评价标准 参照《国家基层糖尿病防治管理指南(2018)》[6]中的疗效标准评价。显效:治疗后,患者FBG 和2 hPG 水平与治疗前比较,下降幅度超过10%;有效:治疗后,患者FBG 和2 hPG 的水平与治疗前比较,下降幅度在5%~10%;无效:患者病情无改善。总有效率=(显效例数+有效例数)/总例数×100%。
1.5 统计学方法 采用SPSS18.0 进行统计学分析。计量资料以均数±标准差()表示,组间比较采用t 检验,计数资料比较采用χ2检验。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者的临床疗效比较 观察组患者的临床治疗总有效率为96.6%,明显高于对照组的90.9%,差异有统计学意义(χ2=8.911,P=0.002<0.05),见表2。

表2 两组患者的临床疗效比较(例)
2.2 两组患者治疗前后的血糖比较 治疗前,两组患者的血糖指标比较差异无统计学意义(P>0.05);治疗后,两组患者的血糖指标均低于治疗前,且观察组患者明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的血糖比较()

表3 两组患者治疗前后的血糖比较()
注:与本组治疗前比较,aP<0.05。
组别 例数FBG(mmol/L) 2 hPG(mmol/L) HbA1c(%)观察组对照组t值P值88 88治疗前9.85±1.84 9.89±1.82 0.085 0.933治疗后5.40±0.55a 7.82±0.47a 18.321 0.001治疗前13.59±2.41 13.62±2.37 0.049 0.961治疗后8.06±1.37a 11.15±1.92a 7.176 0.001治疗前7.54±2.49 7.58±2.60 0.061 0.952治疗后6.28±1.13a 6.94±1.06a 2.333 0.023
2.3 两组患者治疗前后的胰岛素抵抗比较 治疗前,两组患者的HOMA-β、HOMA-IR水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的HOMA-β水平明显高于治疗前,HOMA-IR 水平明显低于治疗前,观察组患者治疗后的HOMA-β水平明显高于对照组,HOMA-IR水平明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的胰岛素抵抗比较()
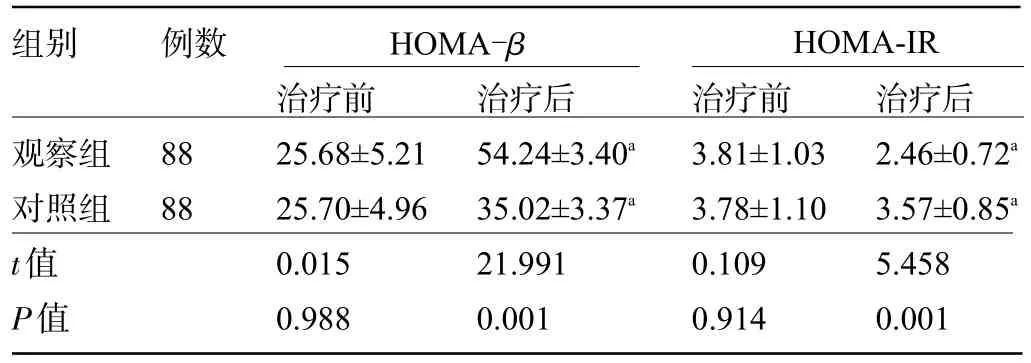
表4 两组患者治疗前后的胰岛素抵抗比较()
注:与本组治疗前比较,aP<0.05。
组别 例数HOMA-β HOMA-IR观察组对照组t值P值88 88治疗前25.68±5.21 25.70±4.96 0.015 0.988治疗后54.24±3.40a 35.02±3.37a 21.991 0.001治疗前3.81±1.03 3.78±1.10 0.109 0.914治疗后2.46±0.72a 3.57±0.85a 5.458 0.001
2.4 两组患者治疗前后的炎症因子水平比较 治疗前,两组患者的炎症因子水平比较差异无统计学意义(P>0.05);治疗后,两组患者的炎症因子水平明显低于治疗前,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的炎症因子水平比较()

表5 两组患者治疗前后的炎症因子水平比较()
注:与本组治疗前比较,aP<0.05。
组别 例数CRP(ng/mL) TNF-α(pg/L) IL-6(pg/L)观察组对照组t值P值88 88治疗前9.26±0.74 9.18±0.52 0.580 0.563治疗后3.60±0.57a 5.09±0.41a 13.915 0.001治疗前110.52±6.59 114.07±7.73 2.292 0.024治疗后72.44±3.13a 86.29±3.90a 18.162 7.927治疗前9.50±0.85 9.63±0.91 0.685 0.495治疗后3.28±0.37a 4.54±0.70a 10.435 0.001
2.5 两组患者治疗前后的氧化应激生物标志物比较 治疗前,两组患者的氧化应激生物标志物比较差异均无统计学意义(P>0.05);治疗后,两组患者的MDA 明显高于治疗前,SOD、GSH-Px 水平明显高于治疗前,且观察组患者治疗后的MDA 水平明显低于对照组,SOD、GSH-Px 水平明显高于对照组,差异均有统计学意义(P<0.05),见表6。
表6 两组患者治疗前后的氧化应激生物标志物比较()
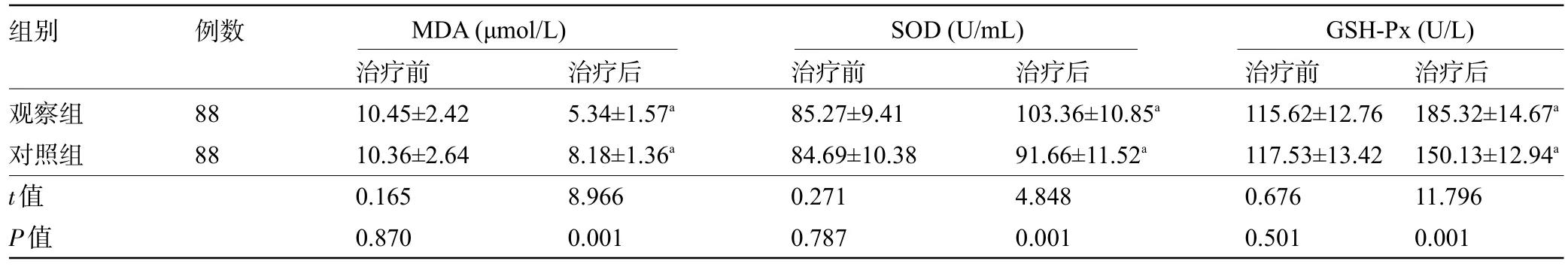
表6 两组患者治疗前后的氧化应激生物标志物比较()
注:与本组治疗前比较,aP<0.05。
组别 例数MDA(μmol/L) SOD(U/mL) GSH-Px(U/L)观察组对照组t值P值88 88治疗前10.45±2.42 10.36±2.64 0.165 0.870治疗后5.34±1.57a 8.18±1.36a 8.966 0.001治疗前85.27±9.41 84.69±10.38 0.271 0.787治疗后103.36±10.85a 91.66±11.52a 4.848 0.001治疗前115.62±12.76 117.53±13.42 0.676 0.501治疗后185.32±14.67a 150.13±12.94a 11.796 0.001
2.6 两组患者的不良反应比较 在治疗过程中,观察组患者发生2 例食欲不振,对照组患者分别发生低血糖和食欲不振各2 例,两组患者的总不良反应发生率分别为2.27%、4.55%,差异无统计学意义(χ2=0.690,P=0.406)。
3 讨论
GDM 主要指妊娠期发生的糖代谢异常,随着人群中糖尿病发病率的日益升高,及妊娠期GDM 筛查诊断受到广泛重视,其发生率不断上升[7-8]。GDM患者血糖长期处于较高的状态,会引发并加重胰岛素B细胞功能的衰退,增加胰岛素抵抗率,增加胎儿高胰岛素血症、新生儿低血糖等不良妊娠结局的发生率[9-10]。
门冬胰岛素是一种速效胰岛素类似物,主要可起到降低血糖的作用。门冬胰岛素的降血糖作用主要是通过门冬胰岛素分子与肌肉和脂肪细胞上的胰岛素受体结合以后促进葡萄糖的吸收,同时抑制肝糖元释放来实现降低血糖作用[11]。益生菌补充剂中的有效成分益生菌直接增加肠道内一种或数种益生菌的数量,从而调节肠道菌群平衡,促进肠道内的菌群环境恢复,且有助于增强机体抵抗力、促进胃肠道蠕动,缓解不耐乳糖症状、降低总胆固醇和低密度胆固醇、吸收体内过剩的营养成分的作用[12]。
GDM 患者的炎症始于脂肪细胞本身,脂肪细胞直接作用于脂肪组织,脂肪组织能活跃地分泌各种激素和TNF-α和IL-6 等炎症因子,当脂肪量增加时,炎症反应加剧[13]。另一种机制则是氧化应激,当更多的葡萄糖被输送到脂肪细胞时,它们会产生过量的活性氧,人体内活性氧过剩会对细胞造成伤害,诱发各种心血管疾病,从而在细胞内引发炎症级联反应。
本研究结果显示,益生菌补充剂治疗的患者血糖指标 FBG、2 hPG、HbA1c 和 HOMA-IR 均低于对照组,HOMA-β的指标水平高于对照组。通过分析是由于GDM患者在妊娠的过程当中糖皮质激素、胎盘泌乳素等激素分泌与合成增多,激素水平的增加导致了GDM患者体内胰岛素的相应不足,从而发生血糖升高的情况;而益生菌在门冬胰岛素的作用下持续性服用,可以有效阻断胰岛β细胞机能减弱的恶性循环,从而改善胰岛素抵抗和与其相关的代谢紊乱,促进人体胰岛素的合成与释放,从而降低血糖水平[14]。此外,接受益生菌补充剂治疗的患者血清CRP、TNF-α、IL-6、MDA水平均明显低于对照组,通过分析是由于,益生菌可提高免疫力,益生菌中的脂磷壁酸、肽聚糖可直接对免疫系统发挥激活的作用,通过分泌免疫激活剂,从而增强患者的免疫细胞和自然杀伤细胞的活性,削弱炎症反应和氧化应激反应的发生[15]。本研究不足之处在于未分析营养物质吸收情况以及患者的血脂、血压、血液流变力学指标,因此本研究方案有待加强研究范畴。
综上所述,采用益生菌补充剂治疗GDM 患者能抑制炎症和氧化应激因子MDA 的表达,提高患者的HOMA-β 指标水平,显著降低患者血糖代谢和HOMA-IR指标水平,值得推广。
