小脑重复经颅磁刺激对缺血性脑卒中患者步行障碍、平衡功能和磁共振波谱指标的影响
2022-04-01丁晓晨袁婕陈杰郭华峰
丁晓晨,袁婕,陈杰,郭华峰
陕西省中医医院影像中心1、脑病科2,陕西 西安 710003
缺血性脑卒中(ischemic stroke,IS)多发生于老年人,致残率和致死率均较高。调查显示,80%左右的IS患者治疗后伴有一定程度的肢体功能障碍,其中步行和平衡功能障碍为常见临床表现[1]。通过常规康复治疗可改善运动功能障碍,但是治疗时间长,部分患者依从性较差,且对精细运动和步行障碍等的疗效有限[2]。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)具有无创、痛苦小、安全性高等特点,能够促进IS患者大脑运动功能的重组,改善言语、运动等功能障碍,但是目前关于rTMS 的研究多集中于大脑初级运动区(primary motor cortex,M1 区),对小脑的研究较少[3]。小脑与机体平衡功能明显相关,有研究发现,对小脑使用rTMS能够同时对人体小脑皮质和M1区产生调控效果,可作为rTMS治疗的新型靶点[4]。本研究以我院近年来收治的IS患者为研究对象,分析小脑rTMS对IS患者步行障碍、平衡功能的影响,并拟通过比较患者治疗前后磁共振波谱(magnetic resonance spectroscopy,MRS)指标的变化,了解 rTMS 小脑对 IS 的相关作用机制,以期为IS患者的康复治疗方法提供参考。
1 资料与方法
1.1 一般资料 选取2020年1~12月陕西省中医医院收治的76例IS患者为研究对象。纳入标准:均经CT或MRI检查,首次确诊为IS[5];生命体征平稳;单侧偏瘫,下肢Brunnstrom 分期≥Ⅱ期;病程≥2 周;站立位平衡≥1 级;右利手。排除标准:癫痫;下肢深浅感觉异常;认知功能障碍;其他神经系统病变;失语;伴心脏起搏器等金属植入物;颅骨缺损;严重膝关节等部位挛缩;颅内压增高;近期骨骼肌松弛药物使用史;恶性肿瘤;合并躯体疾病;严重颈椎病变者。按随机数表法将患者分为常规组和观察组各38例。常规组患者中男性24例,女性14例;病灶位于左侧17例,右侧21例;年龄39~71 岁,平均(56.31±9.14)岁;病程2~9 周,平均(5.37±1.78)周;下肢 Brunnstrom 分期为Ⅱ期 12 例,Ⅲ期19 例,Ⅳ期7 例。观察组患者中男性26 例,女性12 例;病灶位于左侧18 例,右侧 20 例;年龄 41~72 岁,平均(56.65±9.54)岁;病程3~9 周,平均(5.43±1.54)周;下肢 Brunnstrom 分期为Ⅱ期 11 例,Ⅲ期 22 例,Ⅳ期5例。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,所有患者均知情同意。
1.2 治疗方法 两组患者均进行营养神经、抗血小板、降压、控制血糖等的常规药物治疗,同时开展康复训练,包括平衡训练、步态矫正训练、肌肉拉伸、下肢负重训练等,30 min/次,1 次/d。观察组在此基础上使用武汉依瑞德YRD CCI-ⅡrTMS治疗仪进行rTMS治疗,获取静息状态下运动阈值(resting motor threshold,RMT)后,将使线圈与头皮相切,将患侧枕骨粗隆旁开3 cm、下移1 cm 处作为刺激位点,以80% RMT进行刺激,频率10 Hz,每个序列50 脉冲,间歇2~5 s,1 200 脉冲/次,1次/d。常规组在常规康复治疗基础上进行假刺激,使线圈垂直于刺激位点,刺激方法同观察组,患者仅可获取刺激器声音。两组均治疗3周。治疗过程中均对患者的生命体征变化保持关注。
1.3 观察指标与评价方法 (1)步行障碍指标:分别于治疗前和治疗3 周后使用DC-G-200 步态分析系统(江苏德长医疗科技有限公司)检测步幅、步频、步态周期。同时进行起立步行(time up and go,TUG)测试,要求患者完成从椅子站起—步行3 m—返回椅子整个过程,记录完成时间。(2)平衡功能:分别于治疗前和治疗3 周后使用B-PHY 平衡功能检测系统(安徽鸿众医疗器械有限公司)测定患肢负重占比和闭眼稳定性指数(stability index,SI)。使用 Berg 平衡量表(Berg Balance Scale,BBS)[6]分析总体平衡能力,该量表主要从起立、转身向后、无支撑站立、转移等14个条目进行评价,每项0~4 分,分值越高,则提示患者的平衡能力越好。(3)MRS指标:分别于治疗前和治疗3周后使用日本东芝Atlas1.5T磁共振仪对病灶区域进行MRS分析,应用多体素扫描成像进行数据采集。参数设置:层间距1.5 mm,层厚5 mm,TR 2 000 ms,层数14 层。记录胆碱(choline,Cho)、乳酸(lactic Acid,Lac)、N-乙酰天冬氨酸(N-Acetyl-L-aspartic acid,NAA)以及肌酸(creatine,Cr)水平。
1.4 统计学方法 应用SPSS17.0统计学软件分析数据。计量资料符合正态分布,以均数±标准差()表示,组间比较采用独立样本t检验,组内治疗前后比较使用配对样本t 检验,计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后的步行障碍指标比较 治疗前,两组患者的步幅、步频、步态周期、TUG 比较差异均无统计学意义(P>0.05);治疗3 周后,两组患者的步幅、步频明显增加,步态周期、TUG 明显下降,其中观察组患者的步幅、步频、步态周期、TUG明显优于常规组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后的步行障碍指标比较()
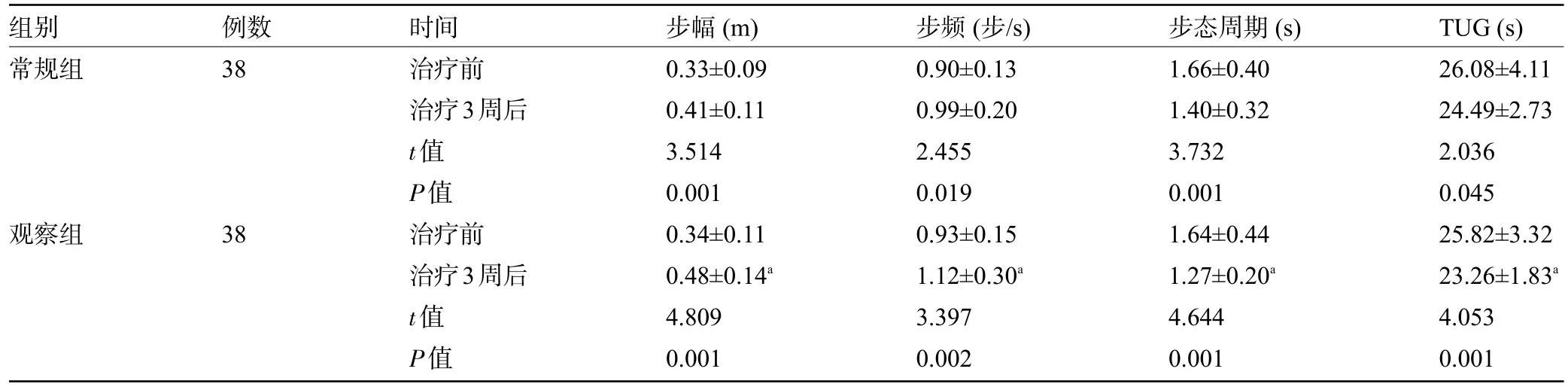
表1 两组患者治疗前后的步行障碍指标比较()
注:与常规组治疗3周后比较,aP<0.05。
组别常规组例数38观察组38时间治疗前治疗3周后t值P值治疗前治疗3周后t值P值步幅(m)0.33±0.09 0.41±0.11 3.514 0.001 0.34±0.11 0.48±0.14a 4.809 0.001步频(步/s)0.90±0.13 0.99±0.20 2.455 0.019 0.93±0.15 1.12±0.30a 3.397 0.002步态周期(s)1.66±0.40 1.40±0.32 3.732 0.001 1.64±0.44 1.27±0.20a 4.644 0.001 TUG(s)26.08±4.11 24.49±2.73 2.036 0.045 25.82±3.32 23.26±1.83a 4.053 0.001
2.2 两组患者治疗前后的平衡功能比较 治疗前,两组患者的患肢负重占比、闭眼SI、BBS评分比较差异均无统计学意义(P>0.05);治疗3周后,两组患者的患肢负重占比、BBS评分明显增加,闭眼SI明显下降,其中观察组患者的患肢负重占比、BBS评分、闭眼SI均明显优于常规组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后的平衡功能比较()
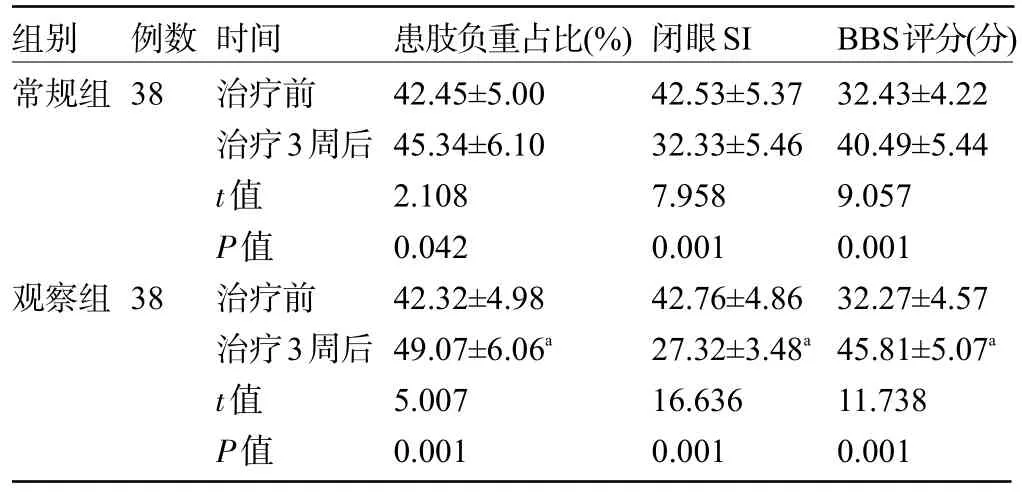
表2 两组患者治疗前后的平衡功能比较()
注:与常规组治疗3周后比较,aP<0.05。
组别常规组例数38观察组38时间治疗前治疗3周后t值P值治疗前治疗3周后t值P值患肢负重占比(%)42.45±5.00 45.34±6.10 2.108 0.042 42.32±4.98 49.07±6.06a 5.007 0.001闭眼SI 42.53±5.37 32.33±5.46 7.958 0.001 42.76±4.86 27.32±3.48a 16.636 0.001 BBS评分(分)32.43±4.22 40.49±5.44 9.057 0.001 32.27±4.57 45.81±5.07a 11.738 0.001
2.3 两组患者治疗前后的MRS 指标比较 治疗前,两组患者的Cho/Cr、Lac/Cr、NAA/Cr比较差异均无统计学意义(P>0.05)。治疗3 周后,两组患者的Cho/Cr、Lac/Cr 明显降低,NAA/Cr 明显增加,其中观察组患者的Cho/Cr、Lac/Cr、NAA/Cr均明显优于常规组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的MRS指标比较()
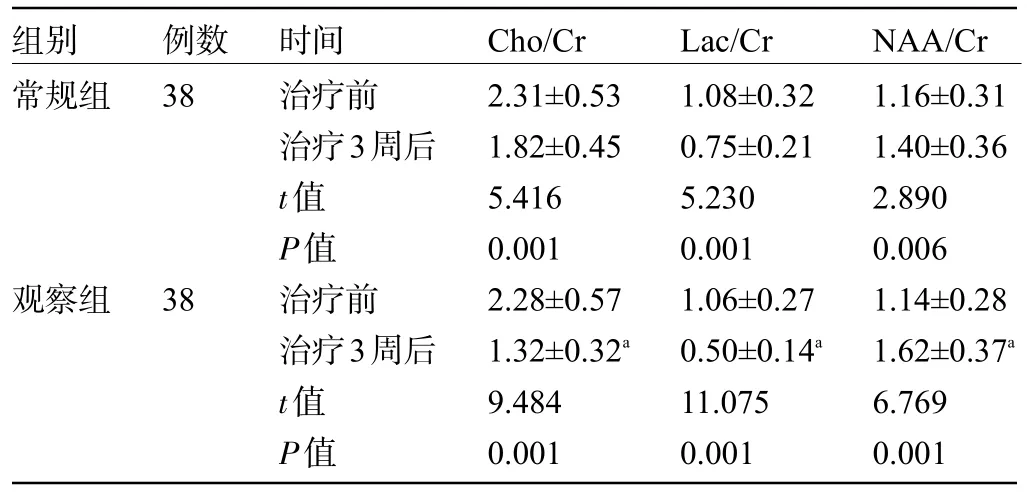
表3 两组患者治疗前后的MRS指标比较()
注:与常规组治疗3周后比较,aP<0.05。
组别常规组例数38观察组38时间治疗前治疗3周后t值P值治疗前治疗3周后t值P值Cho/Cr 2.31±0.53 1.82±0.45 5.416 0.001 2.28±0.57 1.32±0.32a 9.484 0.001 Lac/Cr 1.08±0.32 0.75±0.21 5.230 0.001 1.06±0.27 0.50±0.14a 11.075 0.001 NAA/Cr 1.16±0.31 1.40±0.36 2.890 0.006 1.14±0.28 1.62±0.37a 6.769 0.001
3 讨论
IS为脑卒中的主要类型,其中步行和平衡功能障碍为IS 患者治疗后的常见并发症,可增加跌倒风险,影响患者生存质量[7]。如何通过治疗有效改善患者步行和平衡功能障碍,提高其自理能力,已成为IS 康复治疗中重点关注的问题。IS 患者健侧大脑皮层过度兴奋,使其对患侧的抑制作用加强,影响患者运动功能的恢复[8]。rTMS 主要通过磁刺激技术改变患者大脑皮层的神经网络活性,其中通过采用高频磁刺激,可增强患侧皮层兴奋性,促使大脑半球间平衡的恢复[9]。小脑在躯体运动协调、平衡等的控制方面起到重要作用,目前认为,对于IS患者,小脑激活程度与患者的神经系统功能恢复情况明显相关[10]。通过明确小脑rTMS对IS患者步行障碍、平衡功能以及MRS指标的影响,可为小脑rTMS在临床中的应用提供参考。
IS 患者步行障碍主要表现为步长缩短、步频减慢、步态周期增加等特征,其中IS 患者因对高位中枢的控制能力减弱,机体对肌群的协调能力下降,使患肢负重占比调低,引发平衡功能障碍[11]。目前认为,机体平衡能力障碍是导致IS 患者步行能力下降的主要原因[12]。Berg 平衡量表为评估IS 患者平衡功能的常用工具,主要通过患者的姿势改变评估平衡功能。本研究发现,治疗3周后,观察组患者的平衡功能和步行障碍参数改善程度均优于常规组,这可能是由于常规组患者通过平衡训练、步态矫正训练等康复训练方法可促使肢体功能重建,提高双侧肢体的协调性和稳定性,进而有助于神经系统功能重组。小脑rTMS 一方面可通过感应电流调控远隔运动皮质和M1区的兴奋性,提高患侧大脑半球的兴奋性;另一方面,γ-氨基丁酸(γ-amino butyric acid,GABA)受体在小脑中的数量最多,高频rTMS刺激下,可通过促进GABA和GABA受体水平的提高,抑制胼胝体通路,减轻大脑半球对小脑的过度抑制[13]。在常规组的基础上联合小脑rTMS下,通过康复训练可提高本体感受能力,增强下肢力量,改善肢体协调性;通过rTMS,可促进神经系统敏感性的提高,以及大脑-小脑、大脑半球间平衡状态的改善。两者联合应用从不同的作用机制发挥协同效果,可增强患者神经系统的可塑性,促进神经功能恢复,进而使患者平衡功能和步行能力恢复效果更佳。但是,本研究中采用Berg平衡量表评估患者的平衡功能,可能与日本东京大学康复部平衡评定量表相比,在平衡功能评估中具有一定的局限性,该量表是从翻身、坐位、抬足等22项内容进行评估,在IS患者平衡功能评价中,可能具有更好的实用价值[11]。关于不同类型平衡功能评估量表在IS 患者平衡功能评估中的应用,仍需深入研究。
MRS中,Cho、Lac、NAA、Cr均为大脑皮层活动时分泌的代谢产物,其中Cho与细胞膜代谢相关,水平增加提示细胞膜降解、髓鞘脱失;Lac水平增加提示神经元缺氧缺血加重,与脑卒中患者运动功能障碍严重程度呈正相关;NAA 水平下降表明神经元功能异常加重;Cr水平较为稳定,一般作为基准线,用来评估各指标的变化[14]。本研究发现,治疗3周后,观察组患者的Cho/Cr、Lac/Cr、NAA/Cr水平均优于常规组,这可能是由于常规康复训练可通过建立脑侧枝循环与神经轴突之间的关系,增强神经传导效率,促使神经系统反应的改善以及功能的重组,进而使大脑皮层代谢发生改变;小脑rTMS 可增加小脑血流量,减轻小脑缺氧、缺血,有助于小脑微循环的改善,促使小脑功能的恢复,并可通过小脑-丘脑-皮质神经网络,促进大脑皮质区与平衡和步行能力相关区域的功能重组[15]。两者联合下可增强IS患者梗死区代谢,使病灶区域代谢加快,神经元损伤减少,神经功能得以重建,进而使Cho/Cr、Lac/Cr、NAA/Cr水平进一步改善。
综上所述,小脑rTMS操作简单、无创、无衰减,能够有效改善IS 患者的步行障碍、平衡功能,这可能与其能够调节大脑皮层代谢相关。然而,本研究仍然存在一定的局限性,包括未对小脑高频、低频rTMS以及高、低频rTMS联合应用下治疗IS的效果进行比较,如何明确相关刺激参数,以达到对IS患者的最佳治疗效果,仍需深入研究。
