耐甲氧西林金黄色葡萄球菌杀白细胞素基因亚型的流行及MLST分子分型
2022-04-01毛剑锋张传领
毛剑锋,张传领,楚 旭
杀白细胞素(Panton-Valentine leukocidin,PVL)是一种双组分成孔毒素,能导致白细胞溶解和组织坏死[1-2],常与严重的金黄色葡萄球菌皮肤软组织感染和坏死性肺炎相关[3]。PVL编码基因(包括LukS-PV和LukF-PV)内部会发生变异,由于其527位核苷酸的单核苷酸多态性(A→G)导致176位的组氨酸(His176)被精氨酸(Arg176)所取代,根据这种氨基酸不同可将PVL分为H和R变异型[4]。除527位核苷酸变异外,其他位点变异情况也多有报道,目前已发现至少22个核苷酸位点的突变[5-6]。
尽管PVL对金黄色葡萄球菌疾病严重程度的作用已被公认[13],但PVL亚型对蛋白质毒性和疾病结局的影响仍不清楚。分子模型研究表明,R亚型可能改变PVL编码基因孔隙的形成,增加PVL的白细胞毒性[4]。更重要的是毒力相关基因突变除了增加细菌的分子多样性外,还可能导致蛋白质功能的获得或丧失。由于PVL在金黄色葡萄球菌疾病转归中的重要性[7],了解PVL基因的结构和多样性对于理解金黄色葡萄球菌的致病性和改进特异性治疗药物的靶点设计至关重要。因此,本研究旨在确定本地区临床分离的金黄色葡萄球菌PVL基因亚型的分布,并了解其分子特性。
1 材料与方法
1.1 菌株来源 287株MRSA来自于我院各临床科室送检的血液、尿液、痰液、脓液、伤口分泌物、耳道分泌物、无菌体液等标本,已剔除同一患者相同部位来源菌株。所有菌株经VITEK-2 Compact全自动微生物鉴定系统进行菌种鉴定,根据美国临床和实验室标准委员会(CLSI)推荐的方法,采用头孢西丁纸片法,若抑菌圈直径≤21 mm初步判断为MRSA,再以PCR扩增mecA基因进行分子确认,引物序列参照文献[8]。上述菌株保存于30%甘油肉汤,-70 ℃冰箱备用。ATCC 49775(阳性质控)和MRSA N315(阴性质控)为上海市第一人民医院刘庆中博士馈赠。
1.2 主要仪器和试剂 VITEK-2 Compact全自动微生物鉴定仪为法国Bio-Merieux公司产品,EPS-100电泳仪为上海天能科技有限公司产品,GeneAmp PCR System 9600为美国ABI公司产品(Applied Biosystems),Lysostaphin为日本TaKaRa公司产品,UV-3B紫外成像仪为珠海黑马医学仪器有限公司产品,Premix Taq Version 2.0及DNA Marker购自宝生物工程(大连)有限公司,引物合成及PCR扩增产物测序委托上海生物工程有限公司完成。
1.3 研究方法
1.3.1 感染类型判断 按照美国CDC的CA-MRSA定义:患者在社区或入院48 h内分离到MRSA菌株;1年内无住院或与医疗机构接触史;没有留置各种导管及其他穿刺皮肤的医用装置[9],同时具有以上条件者可做出CA-MRSA感染的临床诊断。根据此定义将临床分离的MRSA菌株分为CA-MRSA和HA-MRSA。
1.3.2 MRSA基因组DNA制备 采用细菌基因组DNA提取试剂盒(美国 Axygen)提取MRSA菌株的基因组DNA,紫外分光光度法测定其浓度和纯度[10]。
1.3.3pvl基因检测与序列分析 采用文献报道的pvl基因PCR引物,上游引物序列:5′-ATCATTAGGTAAAATGTCTGGACATGATCCA-3′(luk-PV-1),下游引物序列:5′-GCATCAASTGTATTGGATAGCAAAAGC3′ (luk-PV-2)[11]。引物由上海生工生物工程有限公司合成。PCR总体积25 μL,反应条件:94 ℃预变性5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,30 个循环;72 ℃ 10 min (GeneAmp PCR System 9600,美国ABI)。采用溴化乙锭预染色的1.5%琼脂糖凝胶电泳、UV-3B紫外成像仪和凝胶成像系统检测并分析PCR产物,目的扩增片段长度为433 bp。经上述检测符合要求的PCR扩增产物委托上海生工生物工程有限公司测序,采用在线BLAST软件分析测序结果并确定其基因型。
1.3.4pvl基因亚型确认 根据Boakes等[5]方法,设计了3对引物,分别扩增出3个片段(核苷酸长度分别为654、718和680)。所有PCR扩增产物均由上海生工生物工程有限公司进行双向测序,测序结果参照O’Hara等[4]方法判断亚型。
1.3.5 CC克隆分型 参考Enright等[12]方法分型,PCR扩增7个管家基因(arcC、aroE、glpF、gmk、pta、tpiand、yqiL),产物双向测序,根据MLST数据库(http://www.mlst.net)分析确定其类型(STs);MLST克隆型别(MLST-CCs)通过网络eBURST (enhanced based upon related sequence types)程序进行(http://eburst.mlst.net/)。
1.4 统计学方法 分析相关数据采用SPSS17.0软件分析,两组数据进行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1pvl+MRSA检出率 287株MRSA中,51株为pvl+菌株(17.8%,51/287),其中29株为CA-MRSA(56.9%,29/51),22株为HA-MRSA(43.1%,22/51)。
2.2pvl亚型分型 对51株MRSA的pvl基因扩增产物双向测序,共发现4个位点(lukS序列的527和663位点,lukF序列的1 396和1 729位点)存在核苷酸的变异(图1),核苷酸527位的突变导致176位的组氨酸(His)被精氨酸(Arg)取代,根据氨基酸的变化将pvl分为R和H亚型。除527位点发生变异外,再根据1 396和663位点是否发生变异细分为H1(GenBank:EF571669)和H2(GenBank:EF571668);USA300属于R亚型,根据1 729位点是否发生变异分为R1(GenBank:EF571829)和R2亚型(GenBank:EF571830)(表1)。本资料51株pvl+MRSA中,90.2% (46/51)的菌株属于H亚型(6株H1、40株H2),而R型仅占9.8% (5/51)(1株R1、4株R2)(图1)。
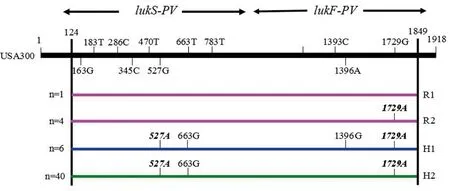
图1 51株临床分离MRSA pvl基因序列变异分布Fig.1 Sequence variants of lukSF-PV observed in 51 MRSA clinical isolates
2.3 MLST分子分型 51株pvl+MRSA共分成11种STs,经eBURST软件分析11种STs型属于7种CCs。最主要的流行株为CC59 (ST59/338),占68.6%(35/51),其次为CC22(ST22/217)(9.8%,5/51)、CC88(ST88)(5.9%,3/51)、CC5(ST25/149)、CC1(ST1/188)(5.9%,3/51)、CC9 (ST9)、CC30 (ST30)(2.0%,1/51)。46株H型菌株的主要克隆型为CC59,占69.6%(32/46),其次为CC22和CC1,占10.9%和6.5%;5株R型菌株的主要克隆型为CC59,占60%(3/5),其余为CC88和CC5(表2)。
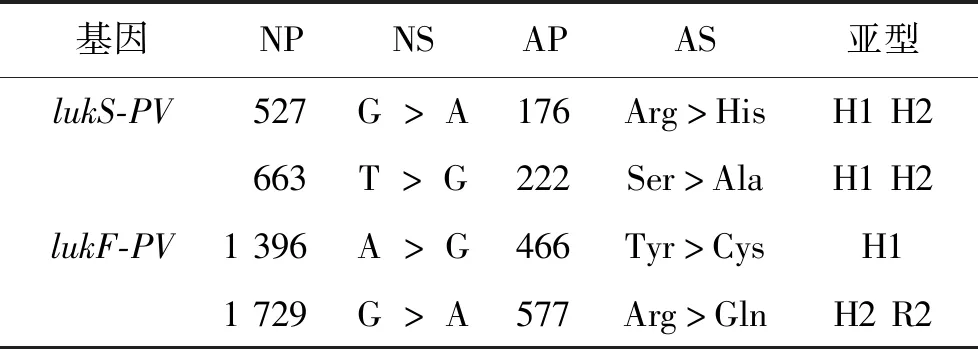
表1 pvl基因亚型核苷酸位点突变及相关氨基酸的非同义替换Tab.1 Nucleotide site mutations of PVL gene subtypes and nonsynonymous substitution of related amino acids
2.4 MRSA感染类型 51株pvl+MRSA菌株中,29株CA获得株 (56.9%,29/51)和22株HA获得株 (43.1%,22/51);CA获得株中H亚型25株 (86.2%,25/29),R亚型4株 (13.8%,4/29);HA获得株中H亚型21株 (95.5%,21/22),R亚型1株 (4.5%,1/22),CA株和HA株携带的pvl均以H亚型为主,分别占86.2%(25/29)和95.5%(21/22),两组差异无统计学意义(χ2=0.390,P>0.05)(表2)。
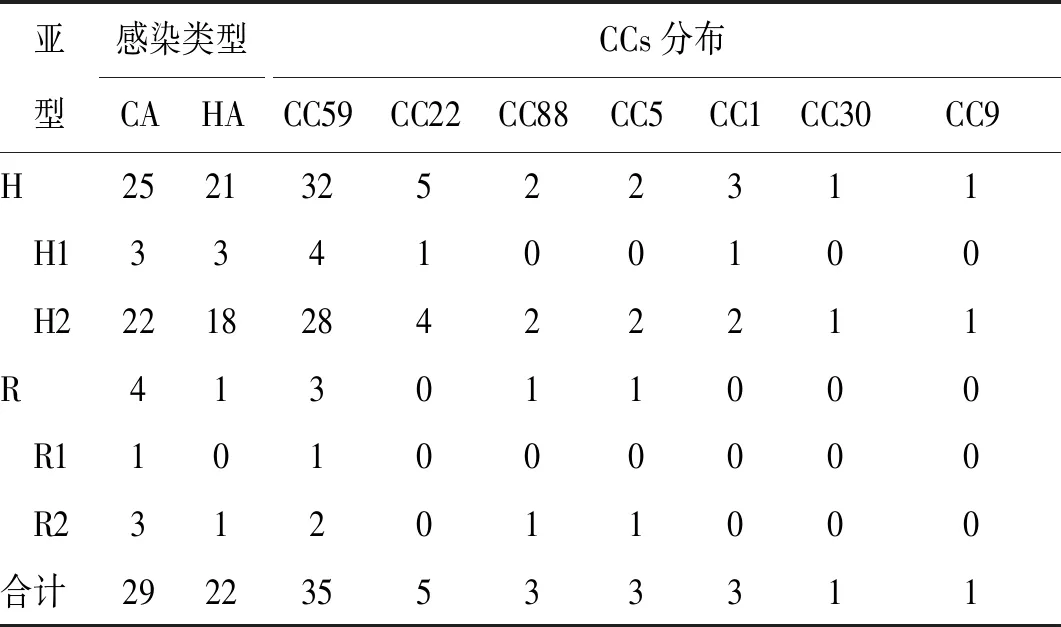
表2 pvl亚型的感染类型及CCs克隆型别Tab.2 Infection types of PVL subtypes and clonal types of CCS
3 讨 论
自1932年PVL从金黄色葡萄球菌中首次分离以来,关于PVL的研究遍及全球。MRSA的pvl基因携带率在不同地区的报道有所差异[13-14]:阿富汗高达59.2%,加拿大亦有30.1%,而日本仅13.5%。我们的检测结果显示,本地区MRSA的pvl基因携带率为17.8%(51/287),低于北京地区和福建地区的报道[15-16],但明显高于本省其他城市,如绍兴地区为15.5%,温州地区仅7.4%[17-18]。究其原因,可能与省会城市杭州人口密度高、旅游业发达带来的人口流动幅度大,环境卫生易处于高污染水平有关。
pvl基因在金黄色葡萄球菌中的作用已明确[7]。然而,不同亚型对PVL毒性的影响尚不清楚。O’Hara FP等[4]提出176位核苷酸的非同义替换而导致的R亚型可能会增加PVL的白细胞毒性。而另外一些学者认为,R和H亚型可能具有相同的诱导孔形成和白细胞毒性的能力[19]。近期,巴西学者[20]发现分离自新生儿血液的H2b亚型pvl+USA1100/ST30/CC30菌株表达的PVL毒素量是其他谱系的5倍,这一结果强调了进一步研究PVL亚型的分布及其克隆谱系的重要性。目前,世界范围内已有PVL亚型分布的报道,不同地区的作者已经证明了PVL之间的相关性亚型、金黄色葡萄球菌谱系及其在全球的地理分布[4-6]。一般来说,R亚型主要与USA300有关,金黄色葡萄球菌谱系广泛分布于美国[21],而H亚型与来自亚洲等非美国地区的其他克隆型别的金黄色葡萄球菌有关,如CCs 1、5、6、22、25、30、59、88和121[4,6,19]。在来自四大洲的52株金黄色葡萄球菌CC30PVL分离株中分离出H1、H2/H2a、H2b、H2c、H2d、R1、R2和R3 PVL亚型。巴西学者[20]分析了39株金黄色葡萄球菌的四个不同克隆谱系(STs/CC1、5、8和30)中的LukSF-PVL基因,发现了一种新的H亚型并命名为H2e。然而,到目前为止,关于我国金黄色葡萄球菌PVL基因亚型的情况还少见报道。笔者首次在杭州地区收集pvl+MRSA进行亚型分析,共发现有4个位点(lukS序列的527和663位点,lukF序列的1 396和1 729位点)存在核苷酸变异,根据其中氨基酸的变化将pvl分为R和H亚型,再根据变异位点不同将亚型进一步细分。研究结果显示,51株pvl+MRSA中,90.2%(46/51)的菌株属于H亚型,其中又以H2亚型为主(6株H1、40株H2),而R亚型仅占9.8% (5/51)(1株R1、4株R2),说明本地区临床分离MRSA携带的pvl基因以亚洲流行的H亚型(H2)为主。这一结果与上述文献报道相似。
分子生物学分型对分析菌株的同源性和遗传背景,明确暴发流行菌株的基因型并推断扩散趋势具有十分重要的意义。在世界不同地区,携带pvl的优势克隆谱系有所不同[22]:亚洲以ST59(CC59)克隆为主,非洲以ST88(CC88)克隆为主,ST80(CC80)主要在欧洲流行,大洋洲常见ST30(CC30)克隆,ST22(CC22)克隆主要流行于印度,而美国以ST8(USA300)克隆为主。本资料显示,pvl阳性的克隆型别以ST59(CC59)为主(68.6%,35/51),与亚洲流行型别克隆一致。并且由表2可见,无论是H亚型还是R亚型,其在pvl+MRSA的分离株均以CC59为主,分别占69.6%(32/46)和60.0%(3/5)。因本研究中R亚型的数量较少,而要明确pvl亚型分子型别的流行特征,有必要分离更多的菌株进一步深入研究。
有研究认为[23],pvl基因是CA-MRSA的特征性分子,而在HA-MRSA中少见。但越来越多学者发现,pvl+MRSA在社区感染患者和医院感染患者中均有检出[14,24]。本资料51株pvl+MRSA菌株中,29株为CA获得株(56.9%,29/51),22株为HA获得株(43.1%,22/51),提示CA-MRSA克隆已经播散到医院环境并引起医院获得性相关感染。然而,关于CA-MRSA和HA-MRSA两者间pvl亚型分布差异的报道较少,我们的资料中,CA获得株中H亚型25株 (86.2%,25/29),HA获得株中H亚型21株 (95.5%,21/22),表明本地区CA-MRSA和HA-MRSA携带的pvl均以H亚型为主,两组差异无统计学意义。
综上所述,目前国内关于金黄色葡萄球菌pvl基因的亚型分布还鲜有报道。本研究首次明确杭州地区临床分离MRSA携带的pvl以H亚型(H2)为主,主要克隆型别为CC59,CA-MRSA和HA-MRSA携带的pvl亚型没有明显差异,这有助于更好地了解本地区pvl+金黄色葡萄球菌菌株的分子流行病学和进化特征,为该类菌株的防控提供临床数据。
