屋尘螨8类变应原(Der p 8)克隆表达、纯化及免疫原性鉴定
2022-04-01刘慧婷袁如意陈献雄刘晓宇
刘慧婷,袁如意,陈献雄,刘晓宇
随着社会经济的发展,人们生活水平的提高,越来越多的人遭受过敏性疾病的困扰。过敏性疾病发病率在全球呈上升趋势,是重要的世界卫生问题。而尘螨是引起许多过敏性疾病的重要过敏原之一,现研究证明与尘螨过敏原相关的过敏性疾病有许多,如过敏性哮喘、过敏性鼻炎和过敏性皮炎等[1-3]。居室内的优势螨类主要有屋尘螨(Dermatophagoidespteronyssinus,Derp)和粉尘螨(Dermatophagoidesfarina,Derf),研究表明屋尘螨在温带以及热带的沿海、湿润地区有较多的分布,是室内尘螨过敏原中多种过敏原的主要来源[4]。目前临床上治疗过敏主要应用过敏原特异性免疫治疗(Allergen-specific immunotherapy,ASIT),以改变疾病的进程,然而ASIT制剂多是过敏原、非过敏原和其他蛋白质的混合物,且大部分过敏患者对于不同尘螨过敏原呈现交叉反应,难以完全标准化,可能引起严重的副作用[5-6]。目前研究者致力于开发重组过敏原,重组或纯化的天然变应原代替天然提取物,能有效还原原有的免疫原性,使得过敏治疗更加安全有效[7-8]。
谷胱甘肽-S-转移酶(glutathione S-transferases,GSTs)是一类生物广泛存在的解毒酶家族,其作用是催化谷胱甘肽(GSH)与多种亲电子化合物的结合,保护生物大分子免受亲电试剂的氧化破坏攻击[9]。因其可能与宿主的免疫反应以及寄生虫对药物的耐药性有关,已在许多寄生虫中进行了研究[10-12]。此前已有研究克隆表达了与GSTs具有很大同源序列的过敏原Der p 8,并鉴定了它的过敏原性[10],但国内未见对GSTs基因及其蛋白特征的相关报道。考虑到不同地域的过敏原之间可能存在差异性,有必要对其变化性和差异性进行研究。因此,本实验希望通过对屋尘螨Der p 8蛋白的克隆、表达及纯化,并鉴定重组蛋白的免疫原性,分析其同源性,为临床上尘螨过敏性疾病的特异性诊断和治疗提供依据。
1 材料与方法
1.1 材 料
1.1.1 螨、载体和菌株 屋尘螨为本实验室纯培养,表达载体为pET-32a,表达菌株为大肠埃希菌BL21(DE3)。
1.1.2 主要试剂和实验材料 RNA提取试剂盒和核酸胶回收试剂盒(QIAGEN,奥格生物技术有限公司),反转录试剂盒(生工生物工程股份有限公司),质粒DNA 提取试剂盒和 DNA 胶纯化试剂盒(美国OMEGA公司);T载体、T4DNA连接酶、限制性内切酶BamHⅠ及XhoⅠ(Takara,宝日医生物技术有限公司);镍离子亲和层析柱,Mouse anti human IgE-HRP(美国Southem Biotech公司),其余试剂为国产、进口分析纯试剂。
1.1.3 血清 Western blotting所用血清取自广州医学院第二附属医院变态反应科Der p IgE阳性患者。
1.2 方 法
1.2.1 尘螨饲养 收集室内尘样本,根据屋尘螨形态学特征,显微镜下挑取雌雄各半的屋尘螨,放在装有尘螨饲料的培养瓶中湿度(70±2)%、温度(25±2)℃条件下进行培养3个月,再进行收集纯屋尘螨。
1.2.2 尘螨鉴定 称取1 g尘螨用液氮研磨,研磨好的粉末PBS溶解冰上摇2 h,8 000 r/min离心30 min。上清取样进行SDS-PAGE鉴定。
1.2.3 设计引物 根据GenBank数据库中Der p 8的核酸序列信息,利用GeneTool软件设计合适引物,引物交由生物工程(上海)股份有限公司合成。
1.2.4 提取屋尘螨总RNA和RT-PCR扩增 按照说明书,将冻存的屋尘螨于液氮中研磨至粉状后按RNA提取试剂盒(QIAGEN公司)说明书提取屋尘螨总RNA。根据逆转录引物,以提取出的总RNA为模板,按反转录试剂盒说明书进行RT-PCR扩增(反应条件:42 ℃ 60 min、70 ℃ 5 min),得到屋尘螨的cDNA。
1.2.5 PCR扩增及其克隆产物的鉴定 以合成的cDNA为模板,根据设计的特异性引物,进行PCR扩增。反应条件为:94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸90 s,共 31 个循环,再以72 ℃延伸10 min。PCR扩增产物凝胶电泳鉴定,胶回收并连接至T载体,转化入大肠埃希菌(E.coliTop10),涂板培养15 h,挑选合适的菌落37 ℃摇菌过夜培养,取样送至公司测序。
1.2.6 构建重组表达质粒和重组表达菌 将测序正确的菌液于37 ℃摇菌过夜培养(LB培养液),提取质粒用BamHⅠ及XhoⅠ双酶切,核酸电泳后胶回收。连接产物与表达载体pET-32a得到重组质粒,并转化入大肠埃希菌(E.coliTop 10)中,培养后取样重复测序一次,测序正确后提取质粒进行双酶切鉴定。
1.2.7 诱导表达重组蛋白Der p 8 鉴定正确后的序列转入表达菌大肠埃希菌BL21(DE3)中,涂板培养,挑选合适的菌落接种于LB50 mL+AMP50 μL(LB∶AMP=1 000∶1)液体培养基中,37 ℃振摇(150 r/min)过夜培养。第2 d于新鲜液体培养基中扩大培养,当细菌处于对数生长期时(OD600=0.6~0.8),应用1 mmol/L的诱导剂异丙基硫代半乳糖苷(IPTG)诱导目的蛋白的表达。4~5 h后离心弃上清,菌体用平衡液重悬。菌液冰上超声破碎、4 ℃离心后,收集上清及沉淀,取部分进行SDS-PAGE电泳,以检测Der p 8的表达情况。
1.2.8 亲和层析法纯化重组蛋白Der p 8 将收集到的沉淀于6 mol/L盐酸胍中混匀,超声破碎15 min,于4 ℃放置过夜,离心(10 000 r/min)20 min后弃沉淀取上清。将上清上样至用平衡缓冲液(50 mmol/L Tris-HCl、200 mmol/L NaCl)预平衡好的镍-氨三乙酸亲和层析柱(Ni-NTA)上,上样速度为2 mL/min。上样后,用平衡缓冲液平衡10倍柱体积,然后分别用低浓度咪唑(40 mmol/L)和高浓度咪唑(300 mmol/L)的平衡缓冲液洗脱杂质蛋白和目的蛋白Der p 8,取部分高浓度咪唑的洗脱液用于SDS-PAGE电泳。纯化后的重组蛋白保存于-20 ℃冰箱。
1.2.9 Western blotting鉴定重组蛋白Der p 8免疫原性 SDS-PAGE电泳将纯化后的Der p 8重组蛋白分离,转移蛋白至硝酸纤维素膜(PVDF膜)上,室温下将膜于5% BSA+TBS中孵育2 h,以Der p IgE阳性患者的血清作为一抗,以辣根过氧化物酶标记的鼠抗人IgE(Mouse anti human IgE-HRP)作为二抗孵育,TBST 将膜清洗5次后,加入化学发光试剂(ECL)显色,根据显色结果鉴定Der p 8重组蛋白的免疫原性。
1.2.10 生物信息学分析Derp8基因 将本实验得到的Derp8基因(图5)与NCBI中公布的Derp8序列进行比对,比较两者的同源性。
2 结 果
2.1 Der p 8重组表达载体的鉴定 将测序正确的Der p 8重组质粒用BamHⅠ及XhoⅠ双酶切,进行核酸电泳。结果显示目的基因的分子量约为700 bp,与Der p 8 的cDNA片段大体一致,证明Der p 8重组表达载体成功构建(图1)。
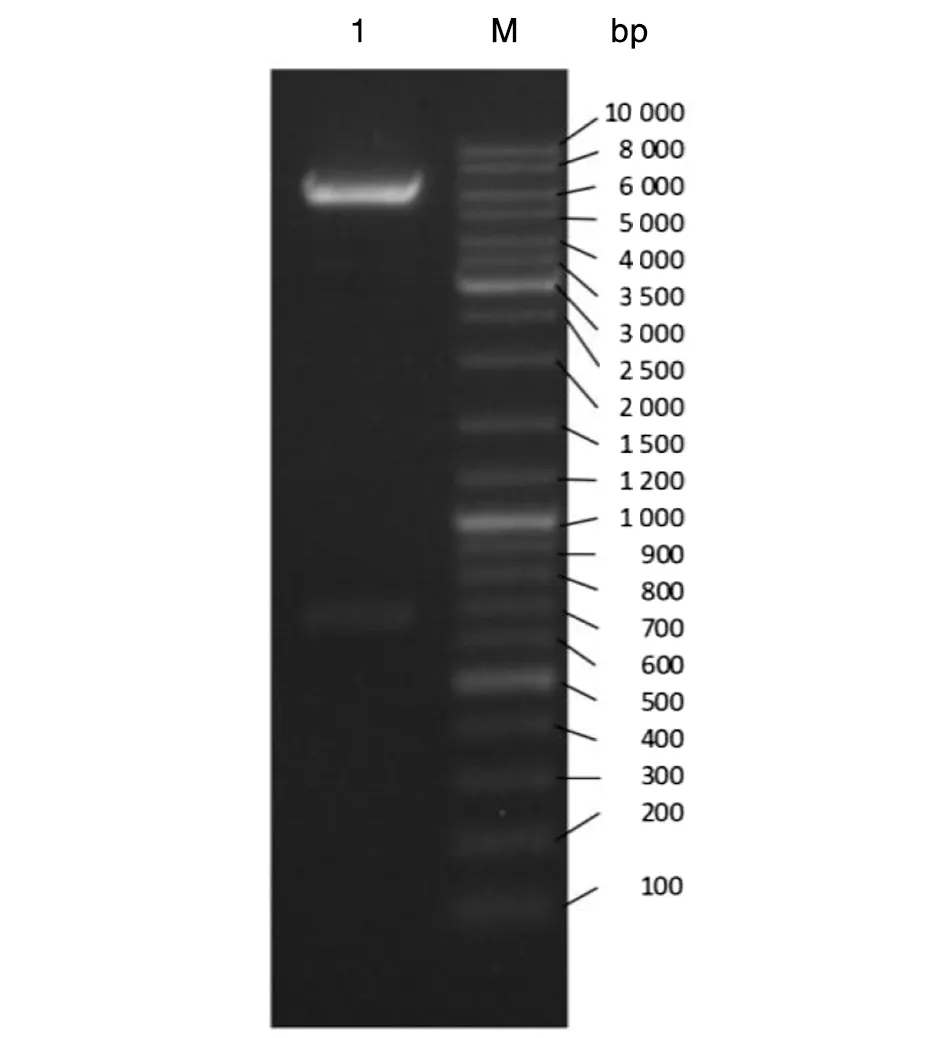
注:M为DNA marker:1为PET-32a-Der p 8重组质粒的双酶切结果。图1 重组Der p 8质粒酶切后琼脂糖电泳结果Fig.1 Identification of Der p 8 cDNA
2.2 Der p 8的大量表达 用1 mmol/L的IPTG诱导重组蛋白Der p 8的表达,诱导前后Der p 8重组蛋白产物经 SDS-PAGE电泳(图2)。结果显示诱导后的菌液中,在分子量约 38 kDa 处可见明显的条带,与 Der p 8预期分子量相近。根据诱导后的上清液和沉淀电泳结果,诱导后沉淀有较明显条带而上清未见明显条带,且样品未做盐酸胍溶解处理,因此可知Der p 8重组蛋白为包涵体。

注:M为蛋白marker;1为诱导前菌液;2为诱导后菌液;3为诱导后上清液;4为诱导后沉淀。图2 不同诱导时间Der p 8基因产物的SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoresis of Der p 8 gene products
2.3 Der p 8重组蛋白的纯化鉴定 用1 mmol/L的IPTG诱导重组蛋白Der p 8的表达,经亲和层析法纯化后,取部分进行SDS-PAGE电泳。结果显示分子量约38 kD处可见一清晰蛋白条带,而其余分子量处未见条带,纯化纯度较高。该蛋白条带的分子量与Der p 8重组蛋白预计分子量相符(图3)。
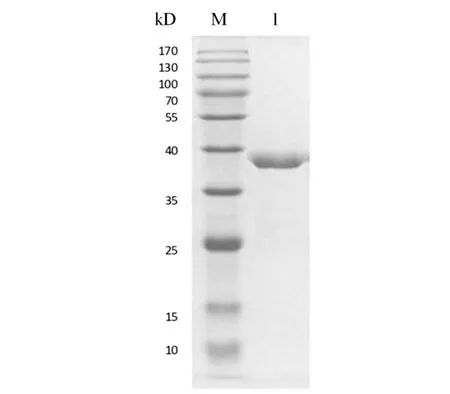
注:M为蛋白marker;1为纯化后的Der p 8蛋白。图3 纯化的Der p 8蛋白SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoresis of purified Der p 8 protein
2.4 Der p 8重组蛋白的免疫原性鉴定 以Der p IgE阳性患者血清为一抗,以Mouse anti human IgE-HRP为二抗进行Western blotting。结果显示在38 kD处可见一明显条带,提示Der p 8重组蛋白能与Der p IgE阳性患者血清中IgE特异性结合,证明其具有免疫原性(图4)。

注:M为蛋白marker;1为纯化后的 Der p 8蛋白。图4 Western blotting检测 Der p 8蛋白的表达Fig.4 Western blotting detection of the expression of Der p 8 protein
2.5Derp8基因的同源性分析 将酶切鉴定阳性的重组质粒测序,得到的基因序列如图5所示。将序列与NCBI基因库中的尘螨Derp8基因序列(GenBank:S75286.1)进行比对,两者相似性为76.97%(图6)。
2.6Derp8的系统进化树分析 将得到的Derp8基因序列与NCBI基因库中的序列进行比对分析,将相似序列以Fasta格式输出,用MEGA 7.0构建分子进化树;分析可知,其基因序列与屋尘螨的谷胱甘肽S-转移酶基因序列最相近(Dermatophagoidespteronyssinus,GenBank:S75286.1),推测其功能相似;此外,通过分子进化树可知,屋尘螨与粉尘螨(Dermatophagoidesfarinae,KC305499.1)、绵羊痒螨(Psoroptesovis,GenBank:AF078684.2)的亲缘关系较近(图7)。
3 讨 论
尘螨是引起多种过敏性疾病的重要过敏原之一,而屋尘螨在亚热带和热带国家具有重要临床意义,哮喘或其他过敏患者对屋尘螨过敏原的致敏率可高达80%~90%[4]。因而对其重要变应原成分的免疫学、分子生物学特性进行深入研究,有助于临床诊疗。目前临床采用ASIT疗法,通过反复给过敏患者注射特定的过敏原,形成对过敏原的免疫耐受,从而减少过敏原暴露后的症状[13]。随着重组技术的发展,重组过敏原替代粗提取物进行脱敏治疗成为可能,如治疗白杨花粉和草花粉过敏的重组低过敏原以及野生型重组过敏原[14-15]。此外,重组过敏原还广泛应用于基于分子的过敏诊断,如蛋白质微阵列或悬浮阵列[16]。
尘螨过敏原重组疫苗的研究也取得了新的进展。Chen等设计的Der p 1-Der p 2融合蛋白在动物体内能有效降低过敏原性,并诱导产生特异性IgG抗体,抑制1组和2组过敏原过敏患者的IgE活性[17]。Hesse等的研究显示在小鼠体内应用纯化的屋尘螨过敏原Der p 1和Der p 2进行皮下免疫治疗,在抑制Th2细胞和尘螨诱导的肺结构细胞激活相较粗尘螨提取物具有明显的优越性。这显示纯化后的尘螨过敏原有可能提高皮下免疫治疗的临床疗效[18]。

图5 Der p 8的cDNA序列Fig.5 cDNA sequence of Der p 8
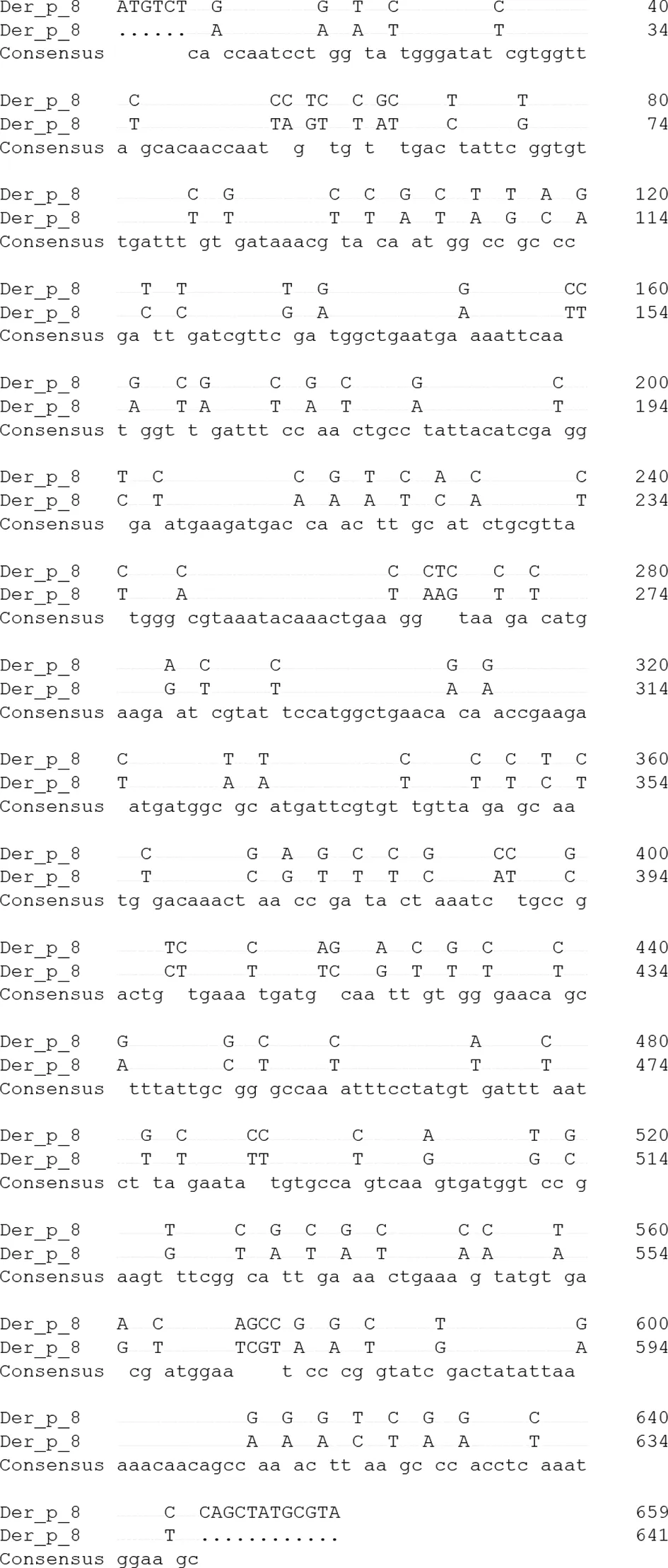
图6 Der p 8基因的同源性分析Fig.6 Homology analysis of the Der p 8 gene
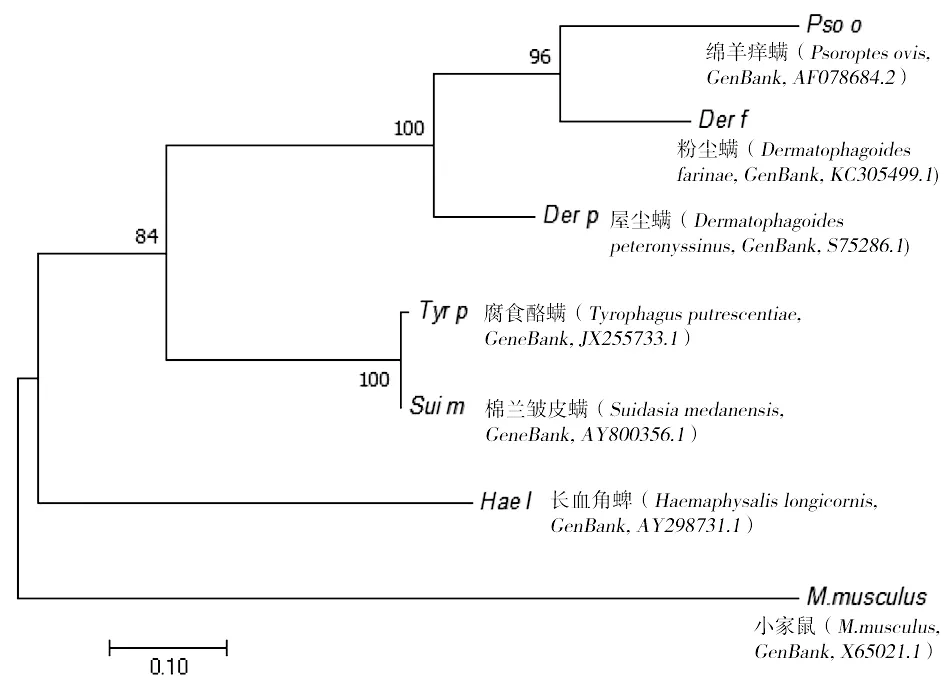
图7 Der p 8的系统进化树分析Fig.7 Phylogenetic tree analysis of Der p 8
O’Neill等的研究发现尘螨表达的与GSTs具有很大同源序列的过敏原Der p 8能与40%的尘螨过敏患者血清中特异性IgE结合,40%中有一半以上的反应是正常对照组的10倍[19]。本实验克隆的Derp8序列与GenBank上的基因序列进行比对,具有76.97%的同源性,表明国外所报道的屋尘螨过敏原Derp8基因序列与中国地区屋尘螨过敏原Derp8基因序列存在一定的地区差异性。基于不同地区变应原的基因多样性,建立高效表达重组过敏原Der p 8的表达载体,并对其进行大量表达和纯化,对研制纯度较高的重组变应原疫苗以及分子免疫诊断仍有一定意义。
本研究提取了屋尘螨总RNA,通过RT-PCR扩增后将其连接至表达载体PET-32a,经双酶切鉴定和测序后,显示所克隆序列为目的基因片段,导入到表达菌大肠杆菌BL21(DE3)。经过IPTG诱导剂的诱导表达及镍柱亲和层析法的纯化,结果显示诱导的重组蛋白Der p 8成功地大量表达,Western blotting分析显示重组蛋白Der p 8具有良好的免疫原性。随着过敏性疾病发病率的上升,人们对其诊断和治疗的需要程度也越来越高,因此过敏性疾病的特异性诊断和治疗需要作出更多改变和突破。本实验所克隆的Der p 8重组蛋白经检验具有较强的免疫原性,一方面可应用于尘螨过敏性疾病的特异性诊断,另一方面应用于尘螨过敏的特异性免疫治疗,为制作重组的过敏原疫苗奠定基础。
