SGK3在非小细胞肺癌组织中的表达及意义
2022-03-31郑亚洲杨泽宇刘梦梦李苗黄礼年
郑亚洲,杨泽宇,刘梦梦,李苗,黄礼年
(蚌埠医学院第一附属医院呼吸与危重症医学科,安徽 蚌埠 233004)
肺癌是临床最常见的肿瘤之一,也是恶性肿瘤患者死亡的主要原因之一。近年来,肺癌的发病率及死亡率逐年上升,肺癌包括小细胞肺癌及非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC 约占肺癌的80%以上[1-2],NSCLC 包括鳞癌、腺癌、大细胞癌等。血清和糖皮质激素调节蛋白激酶3(serum and glucocorticoid-regulated protein kinase 3,SGK3)属于SGK家族,是一种普遍表达的丝氨酸/苏氨酸激酶,研究表明SGK3在功能上与AKT 平行,通过调节细胞增殖、生长、存活、迁移参与肿瘤的恶性转化[3]。研究表明,SGK3 在前列腺癌、乳腺癌等肿瘤组织中表达[4-6],但是在肺癌组织中的表达的文献较少。本研究回顾性分析2014年1月至2018年12月于我院经病理组织学确诊的134 例NSCLC 患者的临床资料,分析SGK3在癌组织中的表达及与临床病理特征的关系。
1 资料与方法
1.1 临床资料 回顾性分析2014年1月至2018年12 月于我院经病理组织学确诊的134 例NSCLC 患者的临床资料,其中男90例,女44例;年龄36~85 岁,平均(61.68±9.55)岁;鳞癌51 例,腺癌83 例。记录134 例NSCLC 患者的性别、年龄等临床资料,病理类型、分化程度、肿瘤直径、TNM分期等病理资料。本研究经医院伦理委员会批准,并经患者知情同意。
1.2 纳入与排除标准 纳入标准:患者均经术后病理组织学确诊,术前未接受放疗或化疗或靶向药物治疗。排除标准:排除合并肺部其他感染性疾病、其他恶性肿瘤、严重肝肾疾病、自身免疫系统疾病及代谢性疾病者。
1.3 试剂来源 兔抗人SGK3 抗体(ab218251)购于美国Abcam公司,通用免疫组织化学SP试剂盒购于南京沐宝生物技术有限公司。
1.4 方法 采用免疫组织化学法检测癌组织及癌旁组织(距离癌组织>5 cm的组织)中SGK3的表达情况。常规石蜡包埋组织切片,玻片烘干,然后在二甲苯中脱蜡,再通过一系列浓度梯度乙醇脱水。免疫组织化学染色的操作步骤按产品说明书进行。SGK3(1∶100)阳性染色呈棕黄色颗粒状,主要表达于细胞浆。切片在双盲情况下由2名高年资病理科医师独立阅片。结果判定按照半定量积分法[7]:(1)每例标本随机观察5 个(×400)高倍视野,计数阳性细胞数占细胞总数的百分比:阳性细胞数为0 则计为0 分,≤25%计1 分,26%~50%计为2分,51%~75%计为3分,>75%计为4 分;(2)按染色强度评分:无染色计为0分,淡黄色计为1分,棕黄色计为2分,棕褐色计为3 分;根据(1)、(2)两项积分之和:0~2 分为阴性,3~7分为阳性。
1.5 统计学方法 采用SPSS 24.0 软件进行统计学分析,计数资料采用[n(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 SGK3 在NSCLC 癌组织及癌旁组织中的表达比较 SGK3 在NSCLC 癌旁组织中低表达,在癌组织中主要表达于细胞浆,阳性染色呈棕褐色颗粒状,见图1。SGK3在NSCLC癌组织的表达水平为67.9%(91/134),明显高于癌旁组织表达的3.7%(5/134),差异有统计学意义(χ2=120.042,P<0.01)。

图1 SGK3在NSCLC癌组织(A)中高表达和癌旁组织(B)中低表达(HE染色,×400)
2.2 SGK3的阳性表达与临床特征的相关性 SGK3的阳性表达与NSCLC患者的年龄、性别、病理类型、肿瘤直径、分化程度均无相关性(P>0.05),与TNM期及淋巴结转移相关(P<0.05),见表1。
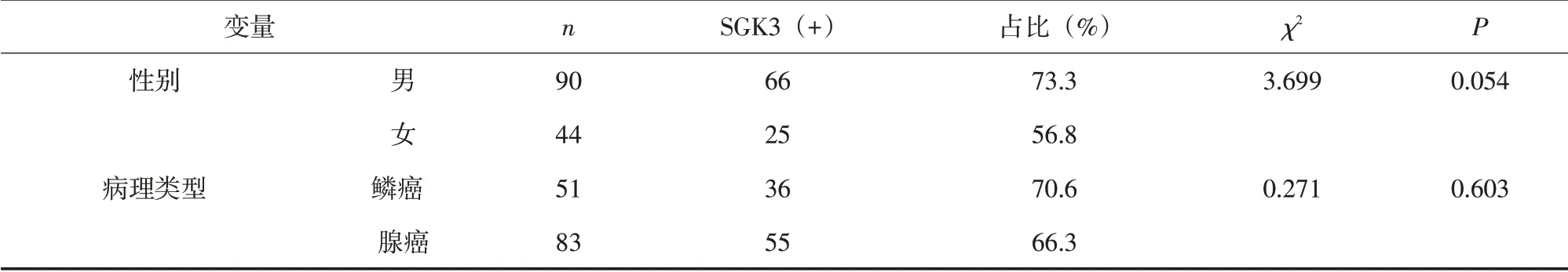
表1 SGK3阳性表达与NSCLC临床特征的相关性

续表1
3 讨论
NSCLC 作为常见的肿瘤,目前常见的治疗方法包括放疗、化疗、靶向药物治疗及手术等,早期NSCLC 主要以手术治疗,但30%~70%的患者在就诊时已处于Ⅲ~Ⅳ期[8],因此肺癌的早期发现尤为重要。
磷脂酰肌醇3-激酶(phosphoinositide-3-kinase,PI3K)途径是人类癌症中最常见的改变途径之一[9],PI3K 促进肿瘤的发生主要是通过激活AKT,AKT是一个高度同源的丝氨酸/苏氨酸激酶家族,具有多种参与细胞的靶点[10]。SGK家族是一种普遍表达的丝氨酸/苏氨酸激酶,由三种同种SGK1、SGK2、SGK3 组成,与AKT 家族高度同源,有研究称SGK3 为第二个AKT[3],具有与AKT相似的底物特异性[11],SGK3具有2个关键的调控位点:催化结构域的活化环中的苏氨酸残基(SGK3中的Thr 320)和C端疏水基序中的丝氨酸残基(SGK3 中的Ser 486),2 个位点都需要磷酸化才能完全激活[8,12],参与PI3K途径的转化,涉及细胞生长增殖,可以推测SGK3 在功能上与AKT 平行,通过调节细胞增殖、生长、存活、迁移参与肿瘤的恶性转化。本研究采用免疫组化法检测NSCLC 癌组织及癌旁组织中SGK3 的表达情况,发现SGK3 在NSCLC 癌组织的表达明显高于癌旁组织,并且SGK3 的表达与NSCLC 的表达与TNM 分期、淋巴结转移有关,提示SGK3 可能参与了NSCLC的细胞增殖、生长、迁移及肿瘤的恶性转化。据报道,在肝癌中发现SGK3扩增和过表达,并能促进肿瘤细胞增殖[13]。有研究表明,PDPK1(Phosphoinositide-dependent Kinase-1)通过SGK3 信号介导前列腺癌细胞的存活,内源性PDPK1在前列腺癌细胞中的敲除显著降低了SGK3的磷酸化水平[5]。有文献表明,在乳腺癌中SGK3过表达,增强凋亡和侵袭相关基因和蛋白,从而导致乳腺癌细胞的肿瘤发展和侵袭[14];用pEGFPN1-SGK3 质粒转染MDA-MD-231 细胞以高表达SGK3,促进了乳腺癌肿瘤生长和癌细胞的侵略性[4];在黑色素瘤中,miR-605通过在黑色素瘤中负调控INPP4B介导的SGK3 活化而起肿瘤抑制作用[15];SMAD2 和SGK3 在NSCLC 癌变组织中呈高表达,有淋巴结转移时,SMAD2 和SGK3 高表达率均上升[16],本研究结果与该研究结果相似。
综上所述,SGK3 可能参与了NSCLC 的发生及发展过程,因此,检测NSCLC 癌组织中SGK3的表达,为NSCLC 的靶向治疗提供了一定的依据,SGK3 能否成为治疗NSCLC 的潜在新靶点仍需进一步探讨,关于SGK3是通过何种机制发挥作用仍需做进一步的实验研究。
