TWS119对多发性骨髓瘤细胞增殖及凋亡影响机制研究*
2022-03-31李彦辰熊福龙戴世溧
李彦辰,邹 露,熊福龙,戴世溧,张 昊,周 亮
(苏州大学药学院药理系,江苏 苏州 215123)
统计数据表明,多发性骨髓瘤(MM)占肿瘤疾病的1%,是第二常见的恶性血液肿瘤,发病率为每年4.5例/10万人~6.0例/10万人。1990—2016年,由于人口增长、世界人口老龄化使得全球MM的发病率增长了1.26倍[1]。 MM难治愈、易复发,这使了解MM发病机制并研发相应药物成了目前的研究热点和难点。蛋白酶体抑制剂硼替佐米(Btz)是首个批准治疗MM的药物。作为一种缓慢可逆的抑制剂,Btz与26S蛋白酶体的催化位点结合,抑制β5亚基(糜蛋白酶样活性)、β2亚基(胰蛋白酶样活性)和β1 亚基(半胱氨酸蛋白酶样活性),导致蛋白的降解失衡从而诱导细胞凋亡[2-3]。但单一Btz用药容易出现耐药性,使得研发联合用药新策略成为目前研究的热点。已有研究表明,Btz联合免疫调节药物来那度胺和组蛋白去乙酰化酶阻断剂帕比司他(Panobinostat),可很好地抑制MM细胞增殖,从而改善MM的临床疗效和预后[4]。
已有激酶抑制剂被应用于临床上治疗肿瘤,例如PI3K激酶抑制剂LY-317615正被用于治疗复发性或难治性弥漫性大B细胞淋巴瘤[5]。但迄今为止,还没有激酶抑制剂被批准用于MM治疗。已有研究表明,TK抑制剂GSK1838705A、FAK/PYK2抑制剂VS-4718和VS-6062,以及p38抑制剂BIRB 796均可抑制MM细胞增殖[6-9]。另外,研究表明p38选择性抑制剂SCIO-469和一种口服BTK抑制剂CC292,可以增强MM细胞Btz敏感性[10-13],但是其内在作用机制还不是很清楚。caspase信号通路激活能够促进MM细胞凋亡,抑制其增殖[14]。另外,caspase非依赖的凋亡通路在MM细胞凋亡中也有相关报道。例如,GSK1838705A能够通过抑制胰岛素样生长因子-1受体和相关激酶而不是caspase,抑制MM细胞增殖,促进MM细胞凋亡[6]。本研究中,作者利用了糖原合成酶激酶-3β(GSK-3β)抑制剂TWS119,发现TWS119抑制MM细胞增殖,促进其凋亡的机制。
1 材料与方法
1.1实验材料 GSK-3β抑制剂TWS119和蛋白酶体抑制剂Btz购于Selleck公司;caspase抑制剂z-VAD-fmk购于碧云天生物技术公司;Calpain抑制剂Calpeptin购于Santa Cruz公司;MM细胞系MM1.S和LP1购于BNCC公司;细胞培养使用胎牛血清(FBS)和1640培养基购于Gibco公司;0.25% 胰蛋白酶和青霉素/链霉素(100×)购于新赛美生物科技有限公司;MM细胞培养瓶购于NEST公司;细胞培养板购于Thermo Scientific公司; anti-PARP1抗体购于Cell Signaling Technology公司; anti-GAPDH抗体购于Proteintech公司;辣根过氧化物偶联的二抗购于Jackson 免疫研究实验室。
1.2方法
1.2.1细胞培养和药物处理 LP1和MM1.S细胞使用1640培养基(10% FBS,1%青霉素/链霉素)进行培养。每2~3天进行细胞传代。用于免疫印迹(WB)实验的细胞接种在24孔板中,接着使用相应药物处理后,收集细胞,进行后续WB实验。用于细胞增殖实验的细胞接种在96孔板中,接着使用相应药物处理后,利用CCK-8增殖检测试剂盒测量细胞增殖情况。
1.2.2WB实验 细胞使用RIPA裂解缓冲液[150 mmol/L Nacl、1% 聚乙二辛基苯基醚(TritonX-100)、0.1% SDS、50 mmol/L Tris-base(pH 7.4)、 1mmol/L EDTA]裂解后,超声破碎,添加5倍聚丙烯酰胺凝脉电泳(SDS-PAGE)蛋白上样缓冲液[250 mmol/L Tris-HCL(pH 6.8)、10% SDS、0.25% 溴酚蓝(BPB)、50% 甘油、5% β-巯基乙醇],98 ℃处理5~10 min。利用10% 蛋白胶进行SDS-PAGE实验,分离蛋白。转膜后,利用10%脱脂牛奶(3 g脱脂奶粉、30 mL 1倍TBST缓冲液)封闭1 h,接着孵育相应一抗和二抗。最后采用凝胶成像系统Tanon 5200仪器采集图片。
1.2.3CCK-8细胞增殖实验 具体步骤参考CCK-8增殖检测试剂盒说明书。在96孔板上接种MM细胞,接种密度为每孔1 000个细胞/200 μL培养基。接着使用相关药物处理,培养指定时间后,加入20 μL的CCK-8溶液(5 mg/mL)。接着继续培养2 h,最后使用酶标仪测定吸光度值(450 nm)。每个实验进行3~4次生物学重复。
1.2.4具体操作 (1)首先使用TWS119处理LP1和MM1.S 24 h后,收集细胞,并且进行WB实验。作者使用经典的凋亡信号分子人聚(ADP核糖)聚合酶1(PARP1)来考察MM细胞凋亡。同时,为了研究MM细胞增殖情况,使用TWS119处理LP1和MM1.S细胞6 d,运用CCK-8试剂盒检测细胞增殖情况。(2)已有研究表明,10 μmol/L z-VAD-fmk处理细胞24 h就能够比较好地阻断细胞内caspase信号通路,进而抑制细胞凋亡[15-16],同时10 μmol/L TWS119处理24 h能够比较好地诱导细胞凋亡[17]。基于此,本研究采用10 μmol/L z-VAD-fmk预处理LP1细胞30 min,接着使用10 μmol/L TWS119处理LP1细胞24 h,利用WB实验及CCK-8试剂盒检测LP1细胞凋亡、增殖。(3)为进一步证明,利用蛋白酶体抑制剂Btz来诱导LP1细胞凋亡。采用10 μmol/L z-VAD-fmk预处理LP1细胞30 min,接着使用10 μmol/L Btz处理LP1细胞24 h,利用WB实验检测LP1细胞凋亡。另外,已有研究表明蛋白水解酶Calpain能够切割PARP1[18],本研究利用Calpain抑制剂Calpeptin(10 μmol/L)来预处理LP1细胞,进而使用10 μmol/L TWS119处理LP1细胞24 h,利用WB实验检测LP1细胞凋亡。(4)本研究进一步研究了TWS119和Btz在人源MM中联合用药的效果。通过联合10 μmol/L TWS119和10 μmol/L Btz处理LP1细胞24 h,利用WB实验及CCK-8试剂盒检测细胞凋亡和增殖。
1.3统计学处理 采用GraphPad Prism Version 6.02软件进行统计学分析,进行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1TWS119对MM细胞凋亡及增殖影响 TWS119分别处理LP1和MM1.S细胞24 h、6 d后,显著诱导LP1和MM1.S中PARP1切割(图1A、C),即诱导细胞凋亡;显著抑制LP1和MM1.S细胞增殖(图1B、D)。与对照组[二甲基亚砜(DMSO)]比较,TWS119促进LP1和MM1.S细胞凋亡及抑制LP1和MM1.S细胞增殖均差异有统计学意义(P<0.05)。见图1。
2.2TWS119通过caspase非依赖方式影响MM细胞凋亡及增殖 caspase抑制剂z-VAD-fmk不能抑制TWS119诱导的LP1细胞凋亡(图2A),即TWS119诱导MM细胞凋亡是通过caspase非依赖方式。 另外,caspase抑制剂z-VAD-fmk也不能缓解TWS119对LP1细胞增殖的抑制作用(图2B),即TWS119抑制MM细胞增殖是通过caspase非依赖方式。caspase抑制剂z-VAD-fmk能够显著抑制Btz诱导的LP1细胞凋亡(图2C)。与z-VAD-fmk、Btz比较,TWS119促进LP1细胞凋亡及抑制LP1细胞增殖均差异有统计学意义(P<0.05)。另外,Calpain抑制剂Calpeptin不能抑制TWS119诱导的LP1细胞凋亡(图2D),即TWS119诱导MM细胞凋亡是通过caspase和Calpeptin非依赖方式。与Calpeptin比较,TWS119促进LP1细胞凋亡及抑制LP1细胞增殖均差异无统计学意义(P>0.05)。见图2。
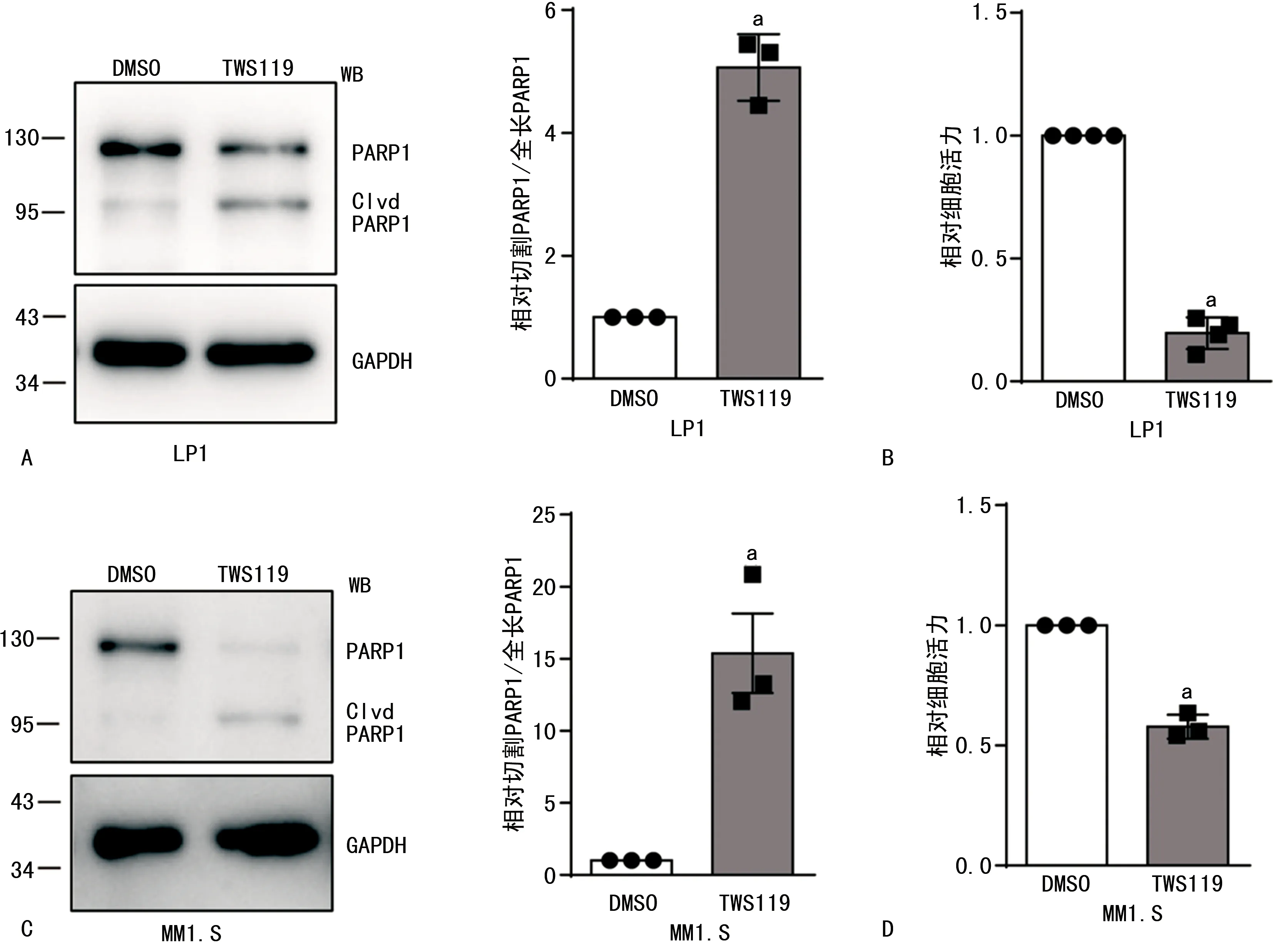
A、C.LP1、MM1.S细胞使用TWS119处理24 h后,进行WB实验检测凋亡;B、D.LP1和MM1.S细胞使用TWS119处理6 d后,进行CCK-8实验检测增殖;TWS119与DMSO比较,a P<0.05。
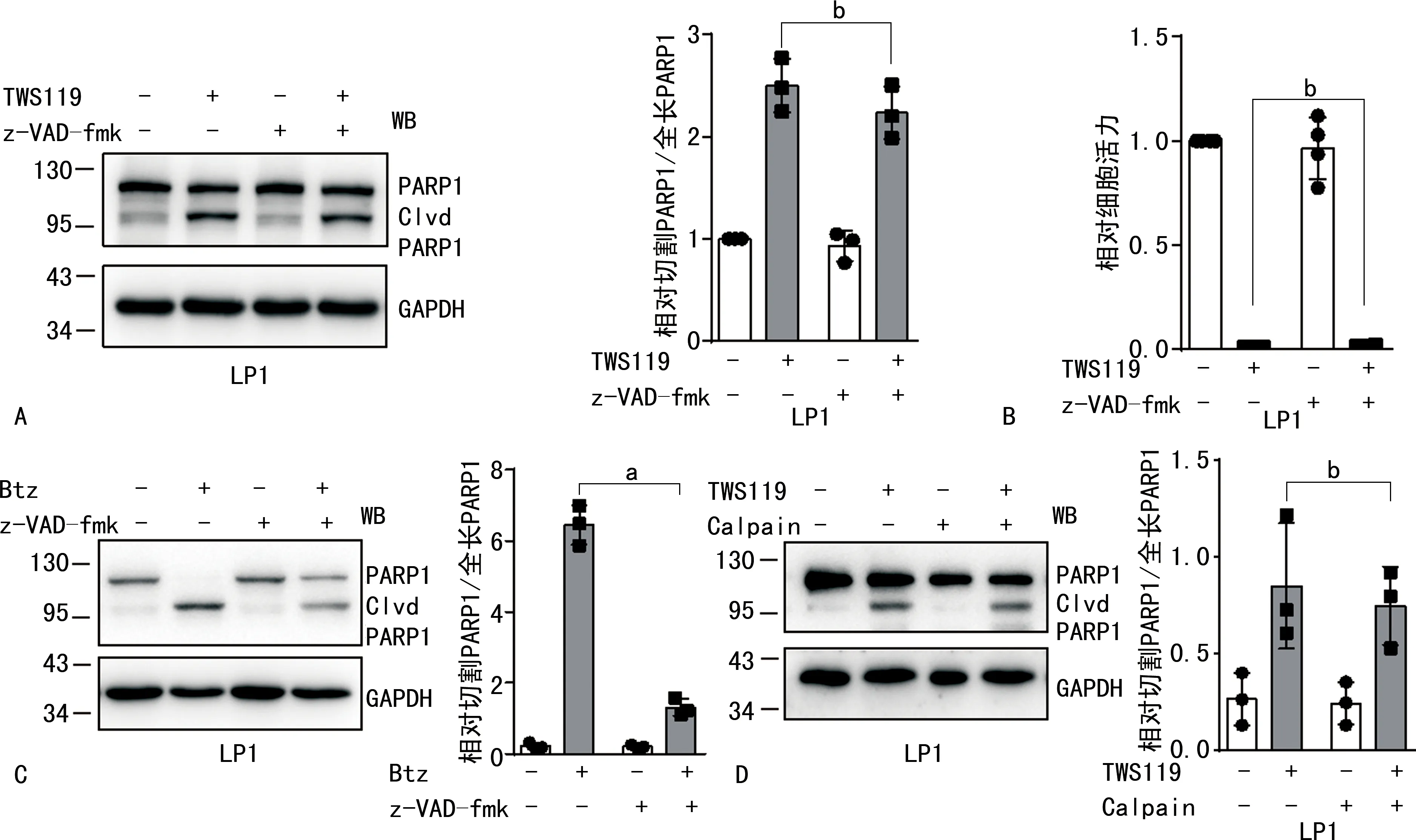
A、B.caspase抑制剂z-VAD-fmk预处理LP1细胞,接着使用TWS119进行处理,行WB、CCK-8实验检测凋亡和增殖;C.caspase抑制剂z-VAD-fmk预处理LP1细胞,接着使用Btz进行处理,行WB实验检测凋亡;D.Calpain预处理LP1细胞,接着使用TWS119进行处理,行WB实验检测凋亡;联合Btz和z-VAD-fmk与单独Btz比较,a P<0.05;联合TWS119和z-VAD-fmk或Calpeptin与单独TWS119比较,b P>0.05。
2.3TWS119增加MM细胞Btz敏感性 联合用药在促进LP1细胞凋亡方面具有最明显的效果(图3A),TWS119能够显著增加Btz诱导的细胞凋亡。联合10 μmol/L TWS119和2 μmol/L Btz能够显著抑制LP1细胞增殖(图3B),TWS119能够显著增强Btz对MM细胞增殖的抑制作用。与Btz比较,TWS119增加Btz诱导的细胞凋亡及增强Btz对MM细胞增殖差异均有统计学意义(P<0.05)。见图3。

A、B.LP1细胞使用TWS119和(或)Btz处理后,行WB、CCK-8实验检测凋亡和增殖;联合TWS119和Btz与单独TWS119和单独Btz比较,a P<0.05。
3 讨 论
本研究中,作者利用蛋白PARP1切割来证明MM细胞凋亡,在2种人源MM细胞中发现GSK-3β小分子抑制剂TWS119能够促进MM细胞的凋亡。同时利用CCK-8细胞增殖检测试剂盒发现TWS119能够显著抑制2种MM细胞的增殖。最后,联合TWS119和临床上用于治疗MM的药物Btz处理MM细胞,证明TWS119能够显著增加MM细胞Btz敏感性。
分子机制上已有研究表明,诱导caspase激活能够促进MM细胞凋亡并且抑制其增殖[14]。 因此,作者考虑了caspase通路在TWS119杀伤MM细胞中的作用。但本研究发现,caspase抑制剂z-VAD-fmk能够显著抑制Btz的毒性,但是并不能够抑制TWS119在MM细胞中的毒性。这说明TWS119不是通过激活caspase通路来抑制MM细胞增殖,促进MM细胞凋亡。已有研究表明,通过稳定p53和抑制STAT3信号通路也能够诱导骨髓瘤细胞周期停滞和凋亡[19]。
caspase的激活能够切割PARP1,同时已有研究表明,Calpain和Cathepsin等蛋白酶也能够切割PARP1,进而调控细胞凋亡[20]。这些caspase非依赖的PARP1切割和凋亡,是否参与了TWS119在MM细胞中的毒性作用,针对这一问题,作者利用Calpain抑制剂Calpeptin预处理LP1细胞,发现Calpeptin也不能抑制TWS119诱导的PARP1切割,这说明TWS119诱导的细胞凋亡不依赖于Calpain通路。可见,本研究证明了TWS119诱导的MM细胞凋亡不依赖于经典的caspase和Calpain通路,其内在的具体通路还需要进一步研究。
Btz能够明显促进MM细胞凋亡,抑制其增殖,从而被临床应用于治疗MM,但单一Btz用药容易产生耐药性。研究表明,长期Btz处理可能影响Btz与PSMB5的结合,从而产生耐药性[21]。另外,也有文献报道长期单一使用Btz所产生的耐药性也与丝氨酸的合成增加有关[22]。如何增加Btz敏感性,是目前基于Btz治疗中亟待解决的问题。本研究中,作者联合TWS119和Btz处理MM细胞,对比单一TWS119和Btz用药,联合TWS119和Btz用药在促进MM细胞凋亡和抑制其增殖方面效果最为明显。这说明TWS119能够增加MM细胞Btz敏感性。Btz诱导的MM细胞毒性依赖于caspase通路,而TWS119诱导的MM细胞毒性不依赖于caspase通路,这使得在MM细胞中联合Btz和TWS119用药,能够通过caspase依赖和非依赖的方式促进MM细胞凋亡,并且抑制其增殖。本研究为二者联合用药提供了一定的理论基础。
总之,本研究发现GSK-3β小分子抑制剂TWS119可促进MM细胞凋亡,抑制其增殖。同时也证明了TWS119能够显著增加MM细胞Btz敏感性。联合TWS119和Btz处理MM细胞的实验结果为MM疾病治疗提供了新思路和新策略。
