基于UPLC-Q-Exactive Orbitrap-MS谱-效相关的柴胡-黄芩药对解热质量标志物的筛选及含量测定方法的建立
2022-03-31于蓓蓓闫雪生周洪雷
于蓓蓓,闫雪生,周洪雷
基于UPLC-Q-Exactive Orbitrap-MS谱-效相关的柴胡-黄芩药对解热质量标志物的筛选及含量测定方法的建立
于蓓蓓1, 2,闫雪生2,周洪雷1*
1. 山东中医药大学,山东 济南 250355 2. 山东省中医药研究院,山东 济南 250014
筛选柴胡-黄芩(柴黄)药对解热作用质量标志物(quality marker,Q-Marker),并建立Q-Marker的UPLC含量测定方法。采用均匀设计法建立柴黄药对配伍差异样品,利用超高效液相色谱-四级杆-静电场轨道阱质谱(UPLC- Q-Exactive Orbitrap-MS)技术建立柴黄药对煎液指纹图谱,采用Thermo Scientific Hypersil Gold C18色谱柱(150 mm×2.1 mm,3 µm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱,体积流量0.3 mL/min,并采用电喷雾电离,正离子扫描模式下进行质谱数据采集。采用新西兰兔耳缘静脉脂多糖(lipopolysaccharides,LPS)注射的方法建立少阳证高热模型,以体温变化值作为解热药效指标,采用灰色关联度分析法建立指纹图谱中共有峰与解热作用的相关关系,筛选出关联性较大的成分作为柴黄药对解热作用的主要Q-Marker,采用UPLC建立Q-Marker含量测定方法。筛选出黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C作为柴黄药对解热Q-Marker,并建立了含量测定方法。基于UPLC-Q-Exactive Orbitrap-MS技术的谱-效相关研究策略可以快速分析及初步确定柴黄药对解热Q-Marker,在此基础上建立其UPLC含量测定方法,对优化柴黄类方制剂的质量控制方法具有重要的参考价值。
谱效相关;质量标志物;超高效液相色谱-四级杆-静电场轨道阱质谱;柴黄药对;指纹图谱;黄芩苷;汉黄芩苷;千层纸素A-7--葡萄糖醛酸苷;去甲汉黄芩素-7--葡萄糖醛酸苷;黄芩素;汉黄芩素;柴胡皂苷A;柴胡皂苷C
柴胡、黄芩(柴黄)药对源于《伤寒论》,是少阳病证治的方药核心。作为经典药对,柴黄配伍被广泛运用于呼吸系统、消化系统、心血管系统和神经系统疾病的复方治疗中,具有解热抗炎、抗病毒、保肝利胆和抗癫痫等作用。《中医方剂大辞典》中以柴黄作主药的有657首[1],许多沿用至今并被研发成为成方制剂,如药典收载的小柴胡片等[2]。在新型冠状病毒感染的肺炎诊疗方案中,柴黄药对亦出现在清肺排毒汤以及湿热蕴肺证推荐处方中[3]。要深层次开发该类方剂,更加精准地指导临床合理用药,进行其药效物质基础及质量标准研究有着极为重要的意义。
目前柴黄复方制剂的质量标准多以黄芩苷为指标,且现有的质控模式未能反映出成分与解热、抗病毒等药效活性之间的“量-效关联”。中药质量标志物(quality marker,Q-Marker)概念的提出,为中药质控手段的提升提供了新的思路和方法[4]。如何去筛选中药Q-Marker,成为迫切需要解决的问题。文献报道了基于植物亲缘学和生源途径、化学成分特有性、传统功效、传统药性、化学成分可测性、中药不同配伍环境、可入血化学成分以及不同贮藏时间的影响来筛选中药Q-Marker的方法[5-6],以及指纹图谱、网络药理学[7-8]、代谢组学[9]、谱-效相关[10]等技术手段。
谱-效相关是利用指纹图谱技术表征中药所含的化学成分,运用化学计量学方法,建立化学成分与中药药效活性的相关关系,确定与药效相关的成分群[11],从而筛选Q-Marker的技术方法。该方法能够明确地反映Q-Marker与药效活性的关联。而如何全面地表征中药化学成分以及药效指标的选择是该技术实施的关键问题。
本实验采用不同配伍用量的柴胡、黄芩饮片来制备药对煎液差异样品,采用UPLC-Q-Exactive Orbitrap-MS技术分别获取差异样品的化学成分指纹谱,结合其对脂多糖(lipopolysaccharides,LPS)诱导的高热新西兰兔的解热药效结果,通过灰色关联度分析法建立指纹图谱共有峰与解热作用的相关性,选择其中特征性的、有效的、可测的化学成分作为其主要的Q-Marker,并建立主要Q-Marker的UPLC含量测定方法,为柴黄类方制剂质量控制水平的提升提供参考。
1 仪器与材料
1.1 仪器
Ultimate 3000超高效液相色谱-四级杆-静电场轨道阱高分辨质谱联用仪,DAD-3000RS检测器,Thermo Scientific Hypersil Gold C18色谱柱(150 mm×2.1 mm,3 µm),美国赛默飞世尔科技公司;BP211D赛多利斯电子天平,德国赛多利斯股份有限公司;SB-5220 DTS超声波双频清洗机,宁波新芝生物科技股份有限公司;6联KDM型控温电热套,鄄城华鲁电热仪器有限公司;HRQ-A1系列电子体温计,小福猪畜牧科技有限公司。
1.2 试药
黄芩苷(批号P16S8F44143,质量分数≥98%)、汉黄芩苷(批号P09J8F28374,质量分数≥98%)、黄芩素(批号C20M8Y31962,质量分数≥98%)、汉黄芩素(批号C19A8Q34235,质量分数≥98%)、柴胡皂苷A(批号P03M9F50593,质量分数≥98%)对照品购于上海源叶生物科技有限公司;柴胡皂苷C(批号PS0566-0020,质量分数>98%)、千层纸素A-7--葡萄糖醛酸苷(批号PS2255-0025,质量分数>98%)、去甲汉黄芩素-7--葡萄糖醛酸苷(批号PS1717-0010,质量分数>95%)对照品购于成都普思生物科技股份有限公司。乙腈、甲酸、甲醇,上海星可高纯溶剂有限公司,色谱纯;液相用水为屈臣氏蒸馏水。LPS购于Sigma Aldrich公司,用生理盐水配制成80 µg/mL的溶液,分装于硅烷化的EP管,−20 ℃冷冻保存,临用前37 ℃水浴解冻。
1.3 饮片
柴胡(批号20190701)、黄芩(批号20190101),山东百味堂中药饮片有限公司,均经山东省中医药研究院中药资源室林慧彬研究员鉴定,分别为伞形科柴胡属植物北柴胡DC.和唇形科黄芩属植物黄芩Georgi的干燥根。
1.4 实验动物
健康雄性新西兰大白兔,普通级,体质量(2.5±0.5)kg,购自济南西岭角生物科技有限公司,许可证号:SCXK(鲁)20150001。动物实验经山东省食品药品检验研究院动物实验伦理/管理委员会批准,批准文号SYXK(鲁)2018-0013。
2 方法与结果
2.1 柴胡-黄芩差异配伍样品的制备
依照柴胡和黄芩在临床应用上的常用剂量和《中国药典》2020年版中的规定用量,确定了柴胡和黄芩使用的剂量范围[12-13]:柴胡12~80 g,黄芩10~50 g。选取柴胡、黄芩的用量为2个因素,分别设5个剂量水平,进行均匀设计,因素及水平见表1。按照均匀设计表U10(52×21),拟合成10个不同的柴胡-黄芩剂量配伍比例的处方,如表1所示。
表1 柴胡黄芩药对配伍均匀设计U10(52×21)
Table 1 Uniform design U10(52× 21) of BSDP compatibility
试验号柴胡/g黄芩/g试验号柴胡/g黄芩/g S112 (1)30 (3)S648 (3)40 (4) S212 (1)50 (5)S766 (4)10 (1) S330 (2)20 (2)S866 (4)40 (4) S430 (2)50 (5)S980 (5)10 (1) S548 (3)20 (2)S1080 (5)30 (3)
依表1中所示剂量取柴胡、黄芩饮片,加入饮片总量的10倍量水,加热回流提取2次,每次1 h。水提液滤过,滤液合并浓缩,定容至200 mL。由此得1~10号柴黄药对ig煎液。此为70 kg成人日临床用药量,兔等效剂量[14]为200 mL×0.07/1.5 kg≈9.3 mL/kg。由此得1~10号柴黄药对ig煎液。
2.2 供试品溶液的制备
取1~10号柴黄药对ig煎液,分别精密量取1 mL煎液于25 mL量瓶中,加70%甲醇20 mL,超声处理(250 W、40 kHz)30 min,定容,经0.45 μm微孔滤膜滤过,即得供试品溶液。
2.3 对照品储备液的制备
分别精密称取黄芩苷、汉黄芩苷、千层纸素A- 7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、C对照品适量,用甲醇定容,制得质量浓度分别为含黄芩苷1218 μg/mL、汉黄芩苷318 μg/mL、千层纸素A-7--葡萄糖醛酸苷159 μg/mL、去甲汉黄芩素-7--葡萄糖醛酸苷82 μg/mL、黄芩素192 μg/mL、汉黄芩素50.2 μg/mL、柴胡皂苷A 33 μg/mL、柴胡皂苷C 18.6 μg/mL的混合对照品储备液。
2.4 色谱和质谱条件
采用Thermo Scientific C18色谱柱(150 mm×2.1 mm,3 µm),以乙腈-0.1%甲酸水溶液为流动相,梯度洗脱:0~2.0 min,10%~13%乙腈;2.0~6.3 min,13%~20%乙腈;6.3~8.4 min,20%乙腈;8.4~12.6 min,20%~23%乙腈;12.6~18.9 min,23%~25%乙腈;18.9~23.1 min,25%~30%乙腈;23.1~27.3 min,30%~37%乙腈;27.3~33.6 min,37%乙腈;33.6~34.0 min,37%~40%乙腈;34.0~46.2 min,40%~65%乙腈;46.2~50.0 min,65%~85%乙腈;体积流量0.3 mL/min;检测波长210 nm;柱温35 ℃;进样量1 μL。
质谱离子源为加热电喷雾电离源(HESI),采用正离子模式扫描,离子质量扫描范围/90~1350,检测分辨率70 000。喷雾电压3.0 kV,碎裂电压30、40、60 kV,鞘气(N2)体积流量40 arb,辅助气(N2)体积流量15 arb,毛细管温度350 ℃;辅助加热器温度250 ℃;S-Lens RF电压水平50%。
2.5 柴黄药对煎液UPLC-Q-Exactive Orbitrap MS指纹图谱的建立
取1~10号柴黄药对供试品溶液,按“2.3”项下方法进行UPLC-Q-Exactive Orbitrap-MS分析。分别提取正离子模式下得到的10个不同配伍的柴黄药对煎液总离子流图(total ion chromatography,TIC),见图1。使用《中药色谱指纹图谱相似度评价系统》(2012版)对10批煎液图谱进行分析选择各图谱中共有的、稳定性好、重现性好、特征明显的峰为共有峰,进行谱峰匹配后,共标记40个共有峰,见图2。通过与对照品保留时间的比较以及各离子峰一、二级质谱裂解特征进行分析研究,初步推测其可能的化学成分。选择化合物种类较多,保留成分信息相对完整的10号样品进行精密度、重复性、24 h稳定性实验等方法学考察。实验结果显示,各项实验中共有峰保留时间和峰面积RSD值均小于3%,表明建立的柴黄药对煎液的UPLC-Q-Exactive Orbitrap-MS指纹图谱符合要求[15]。

图1 10批不同配伍柴黄药对煎液UPLC-MS指纹图谱(正离子模式)

图2 10批不同配伍柴黄药对煎液UPLC-MS指纹图谱共有峰
2.6 动物模型的建立与解热药效指标的确定
新西兰兔在室温(25±1)℃,相对空气湿度50%~60%,通风良好,自然光线环境下,随意摄食和饮水,适应性喂养1周,且每日早晚固定时间测肛温2次。选择体温稳定在38.7~39.5 ℃的新西兰兔,于试验前24 h内测肛温3次,以平均值为基础体温。
选择日常体温稳定在38.7~39.5 ℃的家兔6只,实验前12 h禁食不禁水。按0.25 mL/kg耳缘静脉注射LPS,此后每0.5 h测1次肛温,并计算体温变化值Δ(Δ=监测体温-基础体温),连续监测10 h,结果如图3所示。发现新西兰兔注射LPS后出现二相发热症状,且2~4.5 h逐渐出现畏寒、倦怠、结膜充血、呼吸急促、渴饮等症状,符合少阳证表现[16]。4.5 h可以达到Δ最大值,之后体温开始下降,到6.5 h体温最低,但仍比正常体温高,之后体温再次升高,但Δ均低于Δ4.5 h。因此选择Δ4.5 h作为柴黄药对解热药效指标。
2.7 柴黄药对对高热新西兰兔的解热作用
选择日常体温稳定在38.7~39.5 ℃的家兔,实验前12 h禁食不禁水。随机分为对照组、模型组、柴黄组,每组6只。模型组和柴黄组按0.25 mL/kg耳缘静脉注射LPS,对照组按0.25 mL/kg耳缘静脉注射生理盐水。造模1 h后,柴黄组按等效剂量ig柴黄煎液,模型组、对照组ig等剂量的水。

图3 LPS诱导的高热新西兰兔模型体温变化曲线(, n = 6)
造模后各组动物每0.5 h测1次肛温,并计算体温变化值Δ。模型组动物体温于造模后4.5 h达到最高值,对照组动物体温比较稳定,柴黄组给药10号煎液后0.5 h,体温下降明显,之后体温逐渐增高,但是明显低于模型组,且在给药3 h后,给药组动物的体温又有明显的回落,体温变化如图4所示。由此可见,柴黄药对对LPS所致的高热模型具有解热作用。
2.8 成分-药效的灰色关联分析
按“2.7”项下方法进行对照组、模型组、柴黄S1~S10号组动物的造模和给药处理,造模后4.5 h动物体温变化如表2所示。
将表2中10批柴黄给药组的Δ4.5 h作为参考序列,记为0(),=1,2,3,…,10。1~10号柴黄药对供试品溶液的UPLC-MS指纹图谱各特征峰面积作为比较序列,记作x(),=1,2,3,…,10;=1,2,3,…,40,共40个比较序列。采用均值变换法分别对参考序列和各比较序列数据进行无量纲化处理。按下式分别计算每个比较序列与参考序列对应元素的关联系数(分辨系数=0.5)。

图4 对照组、模型组及柴黄10号组ΔT变化曲线(, n = 6)
表2 12组实验动物造模后4.5 h体温变化(, n = 6)
Table 2 ΔT4.5 hof 12 groups of experimental animals (, n = 6)
组别T0/℃T4.5 h/℃ΔT4.5 h/℃ 对照39.42±0.1539.82±0.881.40±0.83 模型39.20±0.1941.95±0.40*2.75±1.02* S139.26±0.3041.34±0.51#2.08±0.45# S239.40±0.1341.06±0.52#1.66±0.45# S339.14±0.2641.36±0.44#2.22±0.43# S439.47±0.1941.56±0.36#2.09±0.34# S539.35±0.3340.92±0.45#1.57±0.39# S639.33±0.2341.21±0.54#1.98±0.70# S739.38±0.1040.93±0.60#1.55±0.64# S839.42±0.1940.88±0.72#1.46±0.68# S939.35±0.1540.87±0.88#1.52±0.73# S1039.42±0.1240.79±0.70#1.37±0.62#
与对照组比较:*<0.05;与模型组比较:#<0.05
*< 0.05normal group;#< 0.05model group

由此,即可计算每个特征峰与解热指标的关联度(0i)[17]。
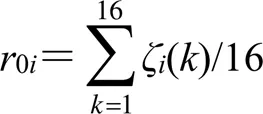
经过计算,与解热指标关联度0i≥0.865(40个共有峰所代表化学成分与药效关联度的中位数)的22个特征峰及其所代表化学成分辨识情况如表3所示。关联度数值越高,说明该特征峰与药效指标的关联性就越强。当关联度0i≥0.8时,表明色谱峰代表的化学成分与药理指标有较大的关联性;当0i≥0.9时,表明色谱峰代表的化学成分与药理指标关联性非常大[10]。由此可见,黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、7,2′-二羟基-8-甲氧基黄酮-5--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、柴胡皂苷A与柴黄药对解热药效密切相关。黄芩新素I、5,2′-二羟基-8-甲氧基黄酮-7--葡萄糖醛酸苷、黄芩新素I-5--葡萄糖醛酸苷、白杨素-6--β--葡萄糖-8--α--阿拉伯糖苷、汉黄芩素、黄芩新素II、柴胡皂苷C、黄芩素等成分亦与解热药效有较大的关联性。结合文献中对柴胡、黄芩解热抗炎活性成分的报道,从中选择特征性的、可测的8个成分:黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、柴胡皂苷A、汉黄芩素、柴胡皂苷C、黄芩素作为柴黄药对解热Q-Marker。
表3 柴黄药对煎液谱-效关联度分析及解热成分辨识
Table 3 Spectrum-effect analysis and identification of antipyretic components
峰号tR/minr0i成分母离子子离子文献 27.150.881白杨素-6-C-α-L-阿拉伯糖-8-C-β-D-葡萄糖苷549.159 43531.143 3618 37.600.883野黄芩苷463.086 65287.071 81, 169.017 5919 47.970.886白杨素-6-C-β-D-葡萄糖-8-C-α-L-阿拉伯糖苷549.160 50531.143 3618 58.330.879白杨素-6-C-β-L-阿拉伯糖-8-C-β-D-葡萄糖苷549.160 46531.143 3618 78.860.871白杨素-6-C-β-D-葡萄糖-8-C-β-L-阿拉伯糖苷549.160 57531.143 3618 1010.540.8844′-羟基汉黄芩苷477.101 82301.071 08, 286.059 75, 269.045 5020 1213.020.930黄芩苷*447.091 23271.060 10, 169.017 5921 1314.480.877二氢黄芩苷449.106 53273.088 1720 1415.350.897去甲汉黄芩素-7-O-葡萄糖醛酸苷*447.092 91271.060 10, 169.017 5921 1616.140.8895,6,7-三羟基-8-甲氧基黄酮-7-O-葡萄糖醛酸苷477.101 95301.071 08, 286.059 75, 269.045 5022 1717.030.902千层纸素A-7-O-葡萄糖醛酸苷*461.106 41285.075 85, 270.042 62, 186.014 2321 1817.710.9015,7,2′-三羟基-6-甲氧基黄酮-7-O-葡萄糖醛酸苷477.101 95301.071 08, 286.059 75, 269.045 5021 1919.170.907汉黄芩苷*461.106 41285.075 75, 270.042 6221 2019.910.8885,7-二羟基-6,8-二甲氧基黄酮-7-O-葡萄糖醛酸苷491.117 87315.102 88, 285.030 46, 198.061 4723 2121.160.878汉黄芩苷异构体461.106 39285.075 75, 270.042 6221 2324.050.865黄芩素*271.060 24253.050 46, 169.017 59, 103.051 4121 2629.220.865柴胡皂苷C*927.533 45909.522 31, 763.458 66, 745.428 83, 601.390 63, 24 421.333 22 2730.270.877汉黄芩素*285.075 43270.052 7821 2830.960.893黄芩新素I315.086 08300.063 49, 285.030 46, 198.070 0525 2931.620.870黄芩新素II375.108 43360.083 23, 345.051 31, 227.052 8221 3033.560.895柴胡皂苷A*781.472 26763.458 66, 601.390 63, 455.337 68, 437.327 9126 3940.290.874N″-O-乙酰基柴胡皂苷A823.483 47805.478 83, 455.337 68, 437.327 91, 419.317 7824
*与对照品比对确定
*Compare with reference substance to determine
2.9 解热Q-Marker的含量测定
在上述Q-Marker的初步筛选基础上,采用UPLC建立同时测定柴黄药对煎液中黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C共8种成分含量的方法。供试品溶液和对照品储备液的制备方法分别见“2.2”和“2.3”项下具体要求,色谱条件如“2.4”项下所述,进样量为15 μL,样品、混合对照品色谱分析结果见图5。
2.9.1 线性关系及定量限考察 分别精密量取混合对照品储备液适量,甲醇逐级稀释定容,形成一系列梯度质量浓度的对照品溶液,按上述色谱条件进样分析,记录峰面积。以待测成分的质量浓度为横坐标()、峰面积值为纵坐标()绘制标准曲线。结果,8个待测成分在检测质量浓度范围内线性关系良好,均大于0.999 0。分别测定各待测组分信噪比(信噪比为10时的质量浓度计为定量限),结果分别为黄芩苷=7.430 6-4.280 8,=0.999 4,线性范围121.8~1 218.0 μg/mL,定量限1.218 μg/mL;汉黄芩苷=4.481 2-0.183 2,=0.999 5,线性范围31.8~318.0 μg/mL,定量限1.059 μg/mL;千层纸素A-7--葡萄糖醛酸苷=2.163 4+3.954 7,=0.999 7,线性范围15.9~159.0 μg/mL,定量限0.795 μg/mL;去甲汉黄芩素-7--葡萄糖醛酸苷=1.469 8-0.856 9,=0.999 4,线性范围8.2~82.0 μg/mL,定量限1.025 μg/mL;黄芩素=1.387 2+0.972 8,=0.999 3,线性范围19.2~192.0 μg/mL,定量限1.920 μg/mL;汉黄芩素=0.976 2-0.812 3,=0.999 1,线性范围5.02~50.2 μg/mL,定量限1.004 μg/mL;柴胡皂苷A=0.152 7+0.002 1,=0.999 1,线性范围3.3~33.0 μg/mL,定量限0.413 μg/mL;柴胡皂苷C=0.105 2+0.013 6,=0.999 2,线性范围1.86~18.6 μg/mL,定量限0.186 μg/mL。

1-黄芩苷 2-去甲汉黄芩素-7-O-葡萄糖醛酸苷 3-千层纸素A-7-O-葡萄糖醛酸苷 4-汉黄芩苷 5-黄芩素 6-柴胡皂苷C 7-汉黄芩素 8-柴胡皂苷A
2.9.2 精密度考察 精密吸取“2.9.1”项下同一混合对照品溶液,连续测定6次,记录各待测成分的峰面积,计算RSD,结果黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C峰面积的RSD分别为0.64%、0.87%、0.92%、0.76%、0.56%、0.77%、0.97%、0.69%,结果表明仪器精密度符合试验要求。
2.9.3 重复性考察 取10号柴黄药对煎液6份,分别按“2.2”项下方法制备供试品溶液并进样测定,计算各成分的质量浓度及其RSD,结果黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C的质量浓度分别为20.505、3.465、2.895、1.080、2.055、0.675、0.521、0.243 mg/mL,RSD分别为1.06%、1.27%、1.13%、0.95%、1.23%、1.07%、1.18%、1.02%,表明该方法重复性良好。
2.9.4 稳定性考察 取上述重复性1号溶液,分别于0、2、4、8、12、24 h进样分析,不同时间点各待测成分黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C峰面积的RSD分别为0.86%、0.98%、1.09%、1.48%、1.22%、1.17%、1.33%、1.54%,说明供试品溶液在24 h内稳定性良好。
2.9.5 加样回收率试验 精密量取0.5 mL 10号柴黄药对煎液于25 mL量瓶中,精密加入适量各对照品混合溶液,按“2.2”项下方法制备供试品溶液,平行操作6份,计算各待测成分加样回收率及其RSD。结果黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、黄芩素、汉黄芩素、柴胡皂苷A、柴胡皂苷C的加样回收率分别为99.77%、99.01%、99.23%、100.87%、98.72%、102.21%、97.39%、96.68%,RSD分别为1.34%、1.57%、1.39%、1.07%、2.13%、1.89%、2.27%、1.98%,表明该方法对8种待测成分的测定回收率较好。
2.10 不同配伍柴黄药对煎液Q-Marker含量测定
取1~10号柴黄药对供试品溶液,采用“2.4”项下色谱条件,测定主要解热Q-Marker的质量浓度,按下式计算每种Q-Marker在来源药材饮片中的煎出率,结果见表4。可以发现随配伍中柴胡用量的增加,黄酮苷类化学成分煎出率逐渐升高,苷元类成分煎出率呈下降趋势,而柴胡皂苷A随黄芩配比的升高,煎出率亦有所提高,柴胡皂苷C的变化未见明显规律性,有待进一步研究。
煎出率=煎液中某种Q-Marker的质量/来源药材饮片的质量
3 讨论
Q-Marker概念的提出为中药质控水平的提高指明了研究方向。在化学成分与中药的安全性、有效性相关基础上,选择中药中可测的标识性成分作为质量控制指标,提高了中药质量一致性、可控性和溯源性,对中药质量控制有重要意义。本实验通过“谱-效”相关的研究策略探索筛选柴黄药对解热Q-Marker,将柴黄药对煎液的化学成分谱通过计量学手段与其解热药效进行有效性关联,初步筛选出22个有效成分(0i≥0.865)。其中,多个成分在文献中都被报道过其解热抗炎作用。如柴胡皂苷是解热抗炎药效物质,柴胡皂苷A和C显著抑制大鼠腹腔巨噬细胞中炎症介质前列腺素E2的合成和花生四烯酸的释放[27];柴胡皂苷A还可通过降低血清中cAMP和下丘脑PKA的含量,使体温降低[28]。黄芩苷、汉黄芩苷等苷类物质在体内代谢成相应的苷元类化合物,共同发挥解热抗炎作用[29-30]。如黄芩苷、黄芩素、汉黄芩素可以通过不同环节干扰花生四烯酸的代谢通路[31],千层纸素A则通过抑制核转录因子NF-κB的结合和转录激活,抑制iNOS和COX-2的表达[32],去甲汉黄芩素则有极强的抗内毒素活性[30]。同时,因为其特征性和可测性,将黄芩苷、汉黄芩苷、千层纸素A-7--葡萄糖醛酸苷、去甲汉黄芩素-7--葡萄糖醛酸苷、柴胡皂苷A、汉黄芩素、柴胡皂苷C、黄芩素这8种成分作为柴黄药对煎液的主要Q-Marker。实验还建立了8个主要Q-Marker的UPLC含量测定方法,该法准确可靠,稳定可行。在不同配伍用量下,Q-Marker的含量不同,其解热药效亦存在一定差异。以筛选出的8个Q-Marker为指标来进行柴黄类方制剂质量控制,相对于现有的质量标准,在一定程度上弥补了“唯成分论”存在的不足,为柴黄类制剂质量标准的提高奠定基础。
表4 不同配伍柴黄药对煎液Q-Marker煎出率测定(n = 2)
Table 4 Decocting rates of quality markers in different compatibility (n = 2)
样品柴胡/黄芩生药量/g煎出率/% 黄芩苷汉黄芩苷千层纸素A-7-O-葡萄糖醛酸苷去甲汉黄芩素-7-O-葡萄糖醛酸苷黄芩素汉黄芩素柴胡皂苷A柴胡皂苷C S112/3010.481.791.560.661.890.590.170.13 S212/5010.791.671.230.571.970.610.200.09 S330/2011.042.121.700.741.900.560.120.15 S430/5010.971.961.330.681.730.490.140.13 S548/2011.892.272.070.731.570.520.090.08 S648/4012.062.011.740.561.500.580.110.11 S766/1013.883.132.601.041.230.330.090.05 S866/4012.742.071.750.871.290.370.100.05 S980/1012.962.892.500.911.330.430.080.09 S1080/3013.672.311.930.721.370.450.130.06
全面地表征中药复杂体系的化学成分是“谱-效相关”技术实施的重要基础。UPLC-Q-Exactive Orbitrap-MS是一种能快速并准确地分析、识别中药成分的有效手段,具有超高分辨率和高灵敏度,尤其适合中药复杂体系化学成分的定性定量分析[33]。本研究利用UPLC-Q-Exactive Orbitrap-MS技术可以比较全面的反映柴黄药对煎液中的化学成分。对比正负离子模式下的图谱,峰数基本一致,负离子模式不存在特有峰,因此,仅以正离子模式建立柴黄药对煎液指纹图谱。以指纹图谱中离子峰面积作为成分量的指标,当多个离子保留时间接近,不同成分离子峰面积从该离子提取离子流图中获取,经过无量纲化处理进行谱效相关分析。关联度高于0.865的成分作为解热主要药效成分进行质谱识别。多数柴黄成分在正离子模式下易产生加和离子[M+H]+或[M+Na]+,以及脱掉1~3个糖残基及水分子的碎片离子。利用精确质量数加二级全谱,与对照品或文献图谱数据比对,可达到快速识别的目的。
选择合适的药效指标亦是“谱-效相关”技术实施的关键问题。为考察柴黄药对煎液的药效,根据少阳证的主要症状“寒热往来”建立少阳证新西兰兔高热模型。LPS作为外源性致热源,进入体内,激活机体免疫细胞,释放内源性致热源(如白介素、肿瘤坏死因子、干扰素等),作用于体温调节中枢下丘脑,使其合成和释放发热介质(前列腺素E)而引起发热,主要症状为高热和一系列炎症反应。采用LPS耳缘静脉注射的方法造模,出现二相发热症状,符合少阳证表现[34],而柴黄药对有显著的解热作用。从检测结果来看,Δ4.5 h可以有效的反应不同配伍柴黄药对煎液的解热药效差异。因此将其作为柴黄药对解热药效指标,进行谱效关系分析和主要Q-Marker的筛选。
实验采用所建立的UPLC含量测定方法测定不同配伍用量柴黄煎液中主要Q-Marker的含量,发现黄酮苷类化学成分随柴胡用量的增加,溶出量逐渐升高,可能是因为柴胡中有抑制其水解或氧化的成分,同时柴胡皂苷的表面活性作用也有利于黄芩苷类物质的溶出,而与黄芩共煎亦有助于柴胡皂苷A环氧醚键的稳定,这可能是柴胡、黄芩配伍应用的物质基础,具体的变化规律有待进一步的探索研究。
综上所述,本实验采用基于UPLC-Q-Exactive Orbitrap-MS的“谱-效”相关研究策略快速分析并确定了柴黄药对Q-Marker,在此基础上建立柴黄药对主要Q-Marker含量测定方法,对于优化柴黄类方制剂的质量控制方法具有较重要的参考价值,也为中药制剂的质量评价水平的提升提供新思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 冯石强. 基于数据挖掘对柴胡类方方证规律的研究 [D]. 北京: 北京中医药大学, 2012.
[2] 中国药典[S]. 一部. 2020: 602.
[3] 国家卫生健康委员会办公厅. 关于印发新型冠状病毒肺炎诊疗方案(试行第八版) 的通知[EB/OL]. http:// www.gov.cn/zhengce/zhengceku/2020-08/19/5535757/files/da89edf7cc9244fbb34ecf6c61df40bf.pdf.2020-08-18.
[4] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[5] 任伟光, 郭丽丽, 张翠英. 川芎的研究进展及质量标志物(Q-marker)的预测分析 [J]. 世界科学技术—中医药现代化, 2021, 23(9): 3307-3314.
[6] 范兰兰. 基于“生熟异治”质量标志物的生、炒酸枣仁质量控制研究 [D].合肥: 安徽中医药大学, 2021.
[7] 李泽, 杜鹤, 解玉军, 等. 基于多元统计分析和网络药理学的炒酸枣仁饮片质量标志物预测分析 [J]. 中草药, 2021, 52(16): 4811-4824.
[8] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[9] 刘绍博, 孙晖, 卢盛文, 等. 基于中医方证代谢组学策略研究知柏地黄丸质量标志物 [J]. 中医药学报, 2021, 49(10): 14-22.
[10] 侯小涛, 陈晓璐, 郝二伟, 等. 基于谱效关系的肉桂改善肾阳虚作用的质量标志物(Q-Marker)研究 [J]. 中草药, 2021, 52(9): 2597-2607.
[11] Xu G L, Xie M, Yang X Y,. Spectrum-effect relationships as a systematic approach to traditional Chinese medicine research: Current status and future perspectives [J]., 2014, 19(11): 17897-17925.
[12] 张思琪. 经方常用50味药物在《石室秘录》中的用量规律研究 [D].北京:北京中医药大学, 2021.
[13] 汪琼. 基于数据挖掘的国医大师应用解表类药物的剂量及相关研究 [D]. 武汉:湖北中医药大学, 2017.
[14] 褚晓峰. 实验动物应用研究学 [M]. 杭州: 浙江工商大学出版社, 2018: 41-45.
[15] 李学学, 曹亚楠, 苏宏娜, 等. 西南委陵菜质量标志物初步研究及指纹图谱结合多元统计综合评价其质量 [J]. 中草药, 2021, 52(12): 3696-3704.
[16] 安祥, 高静飞, 孙洁雨, 等. 柴芩清宁胶囊与感冒灵胶囊对LPS及干酵母大鼠发热模型的解热作用研究 [J]. 中药药理与临床, 2017, 33(5): 157-162.
[17] 王秀峰, 刘新军, 孙继佳, 等. 基于均匀设计与灰色关联分析的中药碧血胶囊成分配伍组方研究 [J]. 中华中医药杂志, 2012, 27(4): 1189-1193.
[18] 谢彤, 徐建亚, 沈存思, 等. 基于UPLC/LTQ-Orbitrap- MS的黄芩中黄酮碳苷的结构表征及同分异构体的区分 [J]. 中草药, 2015, 46(22): 3318-3325.
[19] Islam M N, Downey F, Ng C K Y. Comparative analysis of bioactive phytochemicals from,,,andby LC-DAD-MS [J]., 2011, 7(3): 446-453.
[20] 柴冲冲, 曹妍, 毛民, 等. 基于HPLC特征图谱、UPLC-Q-TOF/MS定性及多成分定量的黄芩酒炙前后化学成分变化研究 [J]. 中草药, 2020, 51(9): 2436-2447.
[21] 庞溢媛, 薛立英, 郑艳红, 等. 基于UHPLC-MS/MS代谢组学技术的不同采收期黄芩质量比较研究 [J]. 药学学报, 2017, 52(12): 1903-1909.
[22] 韩旭阳, 张璐, 彭冰, 等. UPLC-Q-TOF-MS辨析清热除湿汤药效物质基础 [J]. 中国实验方剂学杂志, 2019, 25(6): 150-155.
[23] 陈粲文. 安胎丸的质量控制及物质基础研究 [D].广州:广东药科大学, 2016.
[24] 吴呈祥. 正柴胡饮活性成分的液质联用分析及其抗炎活性评价[D]. 杭州: 浙江大学, 2020: 59.
[25] 邵怡, 杨玉佩, 李家宇, 等. HPLC-Q-TOF-MS/MS分析防风芍药汤水煎液的化学成分 [J]. 中国实验方剂学杂志, 2018, 24(8): 54-59.
[26] 陈文彬, 史毅, 马亚男, 等. 基于UPLC/Q-TOF-MS/ MS分析鳖血柴胡皂苷类化学成分[J]. 现代食品科技, 2019, 35(7): 247-253.
[27] Ohuchi K, Watanabe M, Ozeki T,. Pharmacological influence of saikosaponins on prostaglandin E2 production by peritoneal macrophages [J]., 1985, 51(3): 208-212.
[28] 孙晓卉, 杨志航, 孙大宇, 等. 柴胡皂苷A对发热大鼠的降温作用及与cAMP、PKA的相关性 [J]. 中华中医药学刊, 2016, 34(10): 2534-2536.
[29] 刘沛, 马乐, 王琼, 等. 三黄颗粒中黄芩素代替黄芩苷的药理比较 [J]. 中成药, 2015, 37(2): 265-268.
[30] 邢世华. 基于胃肠道代谢的黄芩、连翘药效物质基础研究[D]. 上海: 上海交通大学, 2015.
[31] Liao H F, Ye J, Gao L L,. The main bioactive compounds ofGeorgi. for alleviation of inflammatory cytokines: A comprehensive review [J]., 2021, 133: 110917.
[32] Chen Y, Yang L, Lee T J. Oroxylin A inhibition of lipopolysaccharide-induced iNOS and-2 gene expression via suppression of nuclear factor-kappaB activation [J]., 2000, 59(11): 1445-1457.
[33] 常冠华, 薄颖异, 崔洁, 等. 基于UPLC-Q-Exactive Orbitrap-MS分析甘草地上部分主要化学成分 [J]. 中国中药杂志, 2021, 46(6): 1449-1459.
[34] 郭曦, 赵雪敏. 小柴胡汤与柴芩煎液对脂多糖致热大鼠解热作用的比较 [J]. 广东畜牧兽医科技, 2015, 40(4): 31-34.
Quality markers screening of drug pair decoction ofandby UPLC-Q-Exactive Orbitrap-MS spectrum-effect correlation technology and establishment of content determination method
YU Bei-bei1, 2, YAN Xue-sheng2, ZHOU Hong-lei1
1. Shandong University of traditional Chinese Medicine, Jinan 250355, China 2. Shandong Academy of Chinese Medicine, Jinan 250014, China
To screen the quality markers of Chaihu () and Huangqin () drug pair (BSDP) decoction, and establish the UPLC content determination method of quality markers (Q-Marker).UPLC-Q-Exactive Orbitrap-MS was used to establish the fingerprint of BSDP decoctionThe analysis was performed on a Thermo Scientific Hypersil Gold C18column (150 mm × 2.1 mm, 3 μm) by gradient elution, and the mobile phase consisted of acetonitrile and 0.1% formic acid solution. Electron spray ionization was used, via positive ions scanning. The New Zealand rabbit model withfever syndrome was established by LPS injection via ear vein. Taking temperature change value as antipyretic effect index, gray correlation analysis was used to study the correlation between the common peaks in the fingerprints and the antipyretic effect to screen out the components with greater correlation as quality markers for the antipyretic effect of BSDP decoction, and the contents determination method for quality markers was established using UPLC.Eight quality markers related to the antipyretic effect of BSDP decoction were screened out: baicalin, wogonoside, oroxyloside, glychionide A, baicalein, wogonin, saikosaponin A and saikosaponin C, and the content determination method of them was established.The “spectrum-effect” correlation research strategy based on UPLC-Q-Exactive Orbitrap-MS technology is an effective method for rapid analysis and preliminary determination of antipyretic quality markers of BSDP. On the basis, the UPLC method established for content determination of the eight quality markers is reliable and accurate. This study has important reference value for the in-depth research on quality control of the compound preparation containing BSDP.
spectrum-effect correlation; quality markers; UPLC-Q-Exactive Orbitrap-MS; drug pair ofand; fingerprint; baicalin; wogonoside; oroxyloside; glychionide A; baicalein; wogonin; saikosaponin A; saikosaponin C
R283.6
A
0253 - 2670(2022)07 - 1983 - 10
10.7501/j.issn.0253-2670.2022.07.007
2021-10-28
山东省自然科学基金项目(ZR2017PH068);山东省重点研发计划项目(2018GSF119019);山东省中医药科技项目(2020Z08)
于蓓蓓,博士研究生,副研究员,研究方向为中药药效物质及质量控制研究。Tel: 13791049031 E-mail: ybb137 @163.com
周洪雷,博士,教授,从事中药及天然药物有效成分及质量控制研究。Tel: 13964017341 E-mail: zhouhongleitcm@163.com
[责任编辑 郑礼胜]
