表观遗传修饰剂线性肟酸对桦褐孔菌三萜合成的影响
2022-04-01赵艳霞孙梦妮袁雯雯郑维发
赵艳霞,周 蓉,孙梦妮,袁雯雯,郑维发
表观遗传修饰剂线性肟酸对桦褐孔菌三萜合成的影响
赵艳霞,周 蓉,孙梦妮,袁雯雯,郑维发*
江苏师范大学 生命科学学院,江苏 徐州 221116
三萜类化合物是药用真菌桦褐孔菌产生的主要次生代谢产物之一,但其在实验室培养条件下积累量较少。旨在研究组蛋白去乙酰化酶(histone deacetylase,HDAC)活性抑制剂线性肟酸(suberoylanilide hydroxamic acid,SAHA)对桦褐孔菌三萜合成的调控。液体摇瓶发酵法培养桦褐孔菌,并在培养液中添加SAHA。采用荧光定量PCR测定三萜合成相关基因转录水平,香草醛-高氯酸法测定细胞内和发酵液中三萜的含量。SAHA的添加提高了桦褐孔菌体内编码3-羟基-3-甲基戊二酸单酰辅酶A合成酶、3-羟基-3-甲基戊二单酰辅酶A还原酶、甲羟戊酸激酶、二磷酸酯脱羧酶、角鲨烯合成酶和羊毛甾醇合成酶等基因的表达水平。SAHA显著提高了桦褐孔菌菌丝体内和发酵液中三萜的积累量。SAHA诱导下桦褐孔菌菌丝体内三萜积累量达(66.4±5.24)mg/g,明显高于对照组[(22.7±3.3)mg/g],并且胞外三萜的含量由对照组的(30.5±2.7)mg/L提高至(49.3±3.8)mg/L。此外,经SAHA处理后桦褐孔菌胞内三萜清除自由基的能力显著提高。SAHA可以作为调节因子激发桦褐孔菌液体培养条件下三萜类化合物的积累。
桦褐孔菌;三萜;组蛋白去乙酰化酶;线性肟酸;自由基
桦褐孔菌属于药用担子真菌,可以合成黑色素[1]、多酚[2]和三萜[3]等次级代谢产物。三萜类化合物具有抑制肿瘤、抗菌、抗病毒和镇痛等作用[3-4],对癌肉瘤Walker-256细胞、人乳腺癌MCF-7细胞和疱疹病毒具有显著的抑制作用[5]。桦褐孔菌合成的三萜类化合物主要有3-羊毛甾-8,24-二烯-21-醛、羊毛甾醇、3β-羟基-羊毛甾-8,24-二烯-21-醛、白桦脂醇、桦褐孔菌醇、栓菌酸、3β,21-二羟基-羊毛甾-8,24-二烯、齐墩果酸、乌苏酸、白桦脂酸、桦褐孔菌素A、桦褐孔菌萜D、3β-乙酰氧基-11α,12α-环氧-齐墩果烷- 28,13β-内酯等[6],该类化合物对肺癌人类肺泡基底上皮A549细胞、结直肠腺癌HT29细胞、人宫颈癌Hela细胞和小鼠白血病L1210细胞等肿瘤细胞具有毒性[7],对小鼠乳腺癌4T1细胞株和MCF-7细胞的具有毒性[8]。然而,桦褐孔菌在自然界中生长缓慢,不能作为三萜类化合物的主要来源。其在实验室培养条件下生长繁殖速度比较快,但是次级代谢产物合成基因处于沉默或者低表达状态[9],导致实验室培养条件下三萜类化合物积累量较低。
生物体三萜类化合物主要通过甲戊二羟酸途径合成[10]。其中3-羟基-3-甲基戊二单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)是催化异戊二烯生物合成,角鲨烯合成酶(squalene synthase,SS)催化从异戊二烯途径到甾醇和三萜生物合成[10]。羊毛甾醇合成酶(lanosterol synthase,LS)催化2,3-氧杂质量烯环化形成羊毛甾烷[9]。目前本实验室对ATCC 22881的全基因组进行了测序,结合Narimene等[9]发表的文章,发现L.中编码3-羟基-3-甲基戊二单酰辅酶A合成酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)、HMGR、甲羟戊酸激酶(mevalonate kinase,MK)、二磷酸酯脱羧酶(diphosphomevalonate decarboxylase,DPMD)、和等基因参与三萜类化合物的合成。生物体内基因表达水平受表观遗传调控。组蛋白去乙酰化酶(histone deacetylase,HDAC)对染色体的结构修饰、基因表达调控和次级代谢产物积累发挥着重要的作用[11-12]。组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离,核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA结合位点特异性结合,激活基因的转录。在细胞核内,组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡,并由组蛋白乙酰化转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调控。HAT将乙酰辅酶A的乙酰基转移到组蛋白氨基末端特定的赖氨酸残基上,HDAC使组蛋白去乙酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因的转录受到抑制[13]。研究表明,HDAC可以调节黄曲霉中黄曲霉毒素B1(AFB1)的积累[12],稻瘟病菌和亚洲镰刀菌中hda1型组蛋白去乙酰酶的缺失能增加代谢物的产生[14]。线性肟酸(suberoylanilide hydroxamic acid,SAHA)是HDAC的抑制剂,SAHA通过结合到酶的活性位点抑制HDAC的活性。据报道,SAHA可以改变次级代谢产物的组成[15],SAHA的处理可以增加中抗炎环肽的合成[16]。然而,组蛋白乙酰化修饰是否影响桦褐孔菌三萜类化合物合成相关基因的转录尚不确定。本实验中研究了SAHA对桦褐孔菌三萜类化合物积累量和相关合成基因的影响。研究结果将为提高药用真菌次级代谢产物合成基因的表达水平从而提高次级代谢产物的产量奠定基础。
1 材料
1.1 供试菌株
桦褐孔菌(ATCC22881)购自美国典型培养物保藏中心,现保存于江苏省药用植物生物技术重点实验室。桦褐孔菌液体培养基配方:葡萄糖(2%)、蛋白胨(0.35%)、酵母提取物(2%)、KH2PO4(0.01%)、MgSO4·7H2O(0.05%)。培养温度为26 ℃,摇床转速为140 r/min。SAHA(批号149647-78-9)购买于Sigma公司。
1.2 仪器
酶标仪(SYNERGY2,美国BioTek公司),实时荧光定量PCR(StepOnePlus,美国Applied Biosystems公司),离心机(Eppendorf 5418,德国Eppendorf有限公司),闪式提取器(ZHBE-50T,河南金鼎科技发展有限公司)。
2 方法
2.1 桦褐孔菌的培养
将桦褐孔菌接种在PDA培养基中,于26 ℃培养7 d,然后转接到含有80 mL培养液的250 mL的三角瓶中进行培养。在无菌条件下收集菌丝体,匀浆后接种到含有150 mL培养液的500 mL的三角瓶中培养2 d后,向培养液中添加SAHA,使培养液中SAHA的浓度为200 μmol/L。以未添加SAHA的桦褐孔菌培养物为对照组。每天取样备用。
2.2 基因表达水平的测定
采用荧光定量聚合酶链反应(qRT-PCR)检测桦褐孔菌合成三萜类化合物相关基因的表达水平。菌丝体经液氮研磨后利用Trizol(Takara公司,日本)法提取RNA,采用DnaseI去除基因组DNA的污染(New England BioLabs Inc.,Ipswich,MA,美国)。然后利用反转录试剂盒将mRNA反转录为cDNA (Takara公司,日本)。使用SYBR®Green Supermix(Roche)进行qRT-PCR,相关引物见表1。以β-肌动蛋白基因作为内参基因,以未添加SAHA的培养物中靶基因的表达值为对照,用2−ΔΔCt法计算目的基因的相对表达水平[17]。实验过程中每组样品均做3个生物重复。
表1 引物序列
Table 1 Primer sequences
引物名称引物序列(5’-3’)目的 qhmgs FAGACCTTCGTAGCAGTTGCChmgs转录水平 qhmgs RTGTAGAACGAGGAAGCGCAG qhmgr FGAGCCAACGAATGATGACGChmgr转录水平 qhmgr RAGCGCGGAAAGCAAAGAAAG qmk FCTTCCAGTCTGAGGGTGCAGmk转录水平 qmk RACGAGGAGATCCGAGGTTCA qdpmd FTCCGTTCGACGACTACCTCTdpmd转录水平 qdpmd RTGTACGAGGCGATATGCACG qss1FCGAATTCGACTGCGTCGTTCss1转录水平 qss1 RAAGCCAGGGCACTTCCTTAC qss2 FCGAATTCGACTGCGTCGTTCss2转录水平 qss2 RAAGCCAGGGCACTTCCTTAC qls1 FTGTGCGATACCACCTCTTCGls1转录水平 qls1 RTACCATTGGGGCCAATCCAC qls2 FCATACCGCTCTCCTGGACACqls2转录水平 qls2 RTGAAATCTCGGCGCTTCAGT qactin FATGGATCACTTTTCAGAGqactin转录水平 qactin RTCAACTAACCCGTCTGGG
2.3 三萜类化合物的提取和测定
利用双水相超声法提取桦褐孔菌菌丝体内三萜,提取条件为:异丙醇体积浓度40%,硫酸铵质量浓度0.125 g/mL,料液比0.9∶1,超声时间为35 min[18]。胞外三萜的提取:收集不同培养条件下桦褐孔菌的培养液,将入醋酸乙酯进行萃取,重复萃取3次。收集醋酸乙酯相,浓缩后定容。以在野生型桦褐孔菌中分离纯化到的肌醇为对照品,利用香草醛-高氯酸法[19]测定桦褐孔菌在不同培养条件下三萜类化合物的积累量。
2.4 三萜抗氧化活性的测定
利用分光光度计法测定桦褐孔菌胞内三萜清除超氧阴离子、羟自由基和DPPH的能力。3 mmol/L的邻苯三酚用于测定桦褐孔菌三萜类化合物清除超氧阴离子的能力[20],5 mmol/L的1,10-二氮杂菲用于检测清除羟自由基的能力[21],0.1 mmol/L的1, 1-二苯基-2-苦基肼用于清除DPPH自由基的活性研究[22]。
2.5 统计分析
3 结果与分析
3.1 三萜类化合物合成基因的表达水平
桦褐孔菌中编码HMGS、HMGR、MK、DPMD、SS和LS等基因参与羊毛甾烷型三萜的合成[9],其含有1个编码3-羟基-3-甲基戊二单酰辅酶A合成酶的基因(,GenBank:MK825554),1个编码3-羟基-3-甲基戊二单酰辅酶A还原酶的基因(,GenBank:MK825555)、1个编码甲羟戊酸激酶的基因(,GenBank:MK825557)、1个编码二磷酸酯脱羧酶的基因(,GenBank:MK825558)、2个编码角鲨烯合成酶的基因(1,GenBank:MK825564;2。GenBank:MK825565)和两个编码羊毛甾醇合成酶的基因(1,GenBank:MK825567;2,GenBank:MK825568)。本实验研究了SAHA对编码HMGS、HMGR、MK、DPMD,SS和LS基因的表达水平的影响。分别以对照组不同时间点的基因表达水平为1,计算SAHA处理组基因的表达水平。由图1可以发现,SAHA的添加激发了、、、、和的表达水平,其中、、1和1在培养的144 h时达最高表达水平,分别为16.34、6.36、11.08和2.65,、2和2在培养的168 h时达最高表达水平,分别为10.13、7.73和4.08,在培养的192 h达最高表达水平为6.51。
3.2 三萜类化合物的积累
SAHA显著提高了桦褐孔菌细胞内和发酵液中三萜类化合物的积累。桦褐孔菌在添加SAHA后的24 h至96 h中菌丝体内三萜的含量没有显著性差异,在培养的120 h开始,添加SAHA组桦褐孔菌菌丝体中三萜的积累量随着培养时间的延长逐渐升高,培养至192 h时,对照组菌丝体内三萜的积累量为(22.7±3.3)mg/g,极显著的低于SAHA添加组中三萜的积累水平(66.4±5.24)mg/g(<0.001,图2-A)。在添加SAHA 24 h后,桦褐孔菌细胞外
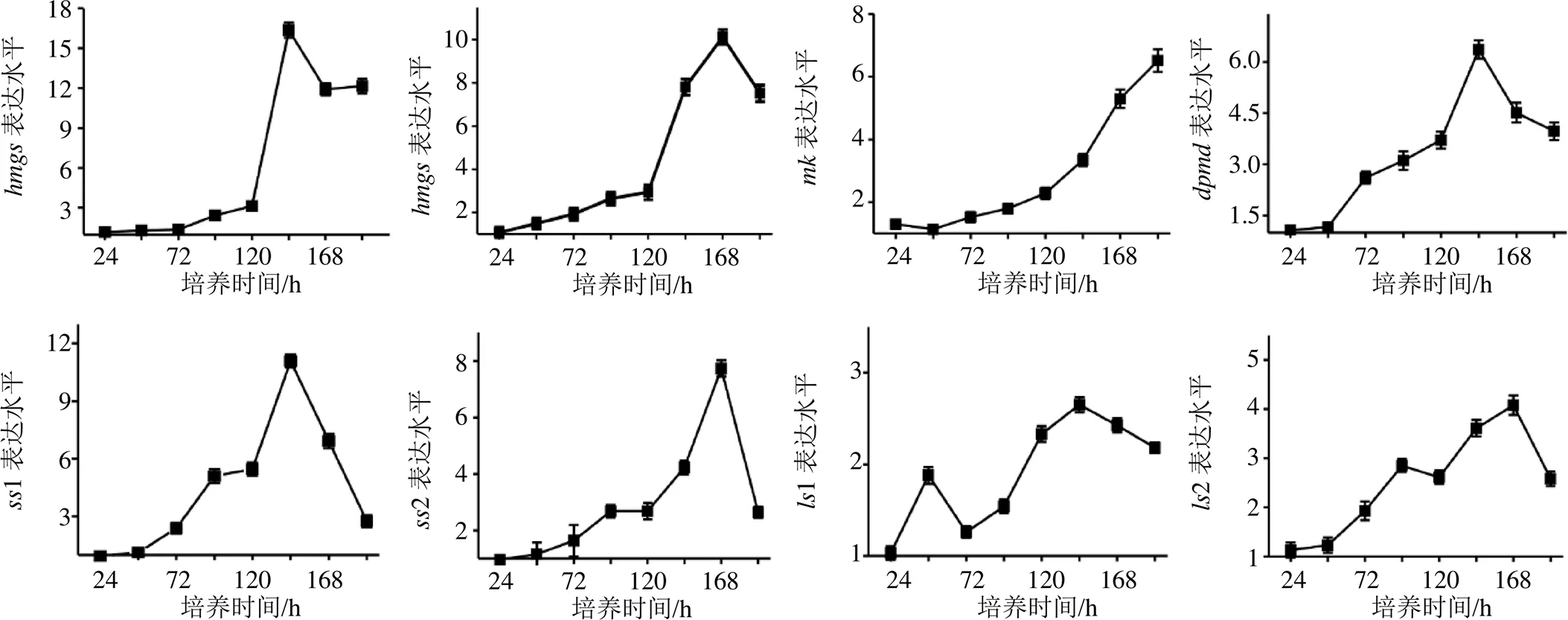
图1 桦褐孔菌培养过程中SAHA的添加对hmgs、hmgr、mk、dpmd、ss和ls表达水平的影响
三萜的含量明显提高至(11.3±0.8)mg/L,并随着培养时间的延长,发酵液中三萜的积累水平逐渐升高,培养至192 h时,三萜的积累量高达(49.3±3.8)mg/L,极其明显的高于正常培养条件下发酵液中三萜的积累量(30.5±2.7)mg/L(<0.001,图2-B)。并且经5-AC处理后的桦褐孔菌胞内多酚清除DPPH自由基、超氧阴离子和羟自由基的能力均显著性的高于正常培养条件下多酚的清除能力(图3),推测是由于桦褐孔菌胞内三萜类化合物的组成成分的含量和种类的变化引起其清除自由基能力的变化。可见,SAHA的添加不仅促进了三萜类化合物的合成,而且提高了该类化合物的抗氧化活性。

CTR-对照 SAHA-线性肟酸,下图同
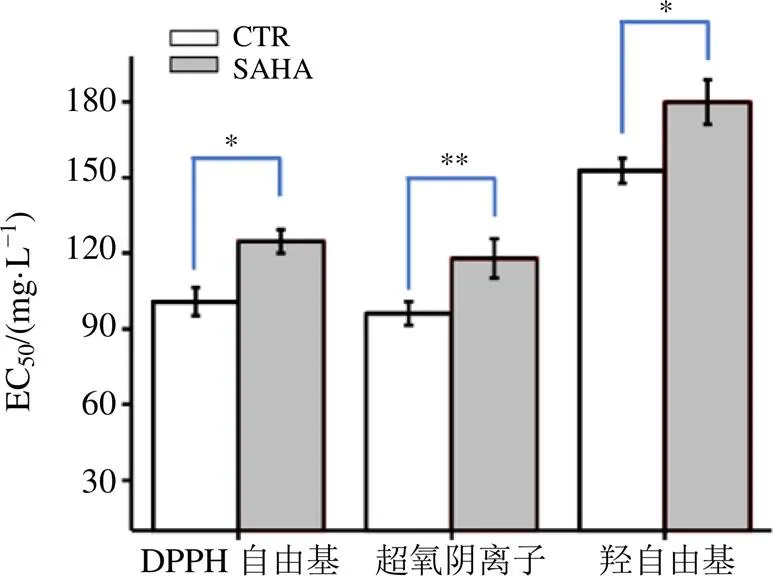
*P<0.05 **P<0.01
4 讨论
真菌是天然产物的主要来源,然而,实验室培养条件下参与次级代谢产物合成相关的基因均处于沉默或低表达状态[9]。表观遗传修饰作为激发剂可以激活基因表达水平从而提高次级代谢产物的产量,诱导新化合物的形成[23]。本研究发现,在液体发酵培养桦褐孔菌的过程中,SAHA的添加提高了参与三萜合成的基因、、、、和等的表达水平,促进桦褐孔菌菌丝体内和发酵液中三萜类化合物的合成,并且菌丝体内三萜类化合物抗氧化能力显著性的提高。
生物体内组蛋白乙酰化状态是动态的,同时受组蛋白乙酰转移酶和组蛋白去乙酰化酶控制。组蛋白的低乙酰化与异染色质形成和基因沉默相关,组蛋白高乙酰化与常染色质形成和基因激活有关[24-25]。利用HDAC的抑制剂调节真菌次级代谢产物的合成被认为是开发新的真菌天然产物的有效途径。如SAHA可以调控乳突葡萄球菌代谢产物的生成并能诱导新化合物的合成[15],诱导白僵菌产生具有抗炎活性的环缩肽[16]以及诱导曼陀罗内生真菌镰刀菌酸的合成[26]、芋枝孢霉中新型乙酰甾醇的合成[27]。桦褐孔菌胞内三萜类化合物抗氧化活性的增强,说明桦褐孔菌胞内三萜类化合物组成成分的含量和种类发生了变化,为此将深入研究表观遗传修饰剂对桦褐孔菌三萜类化合物组成成分的影响,确定桦褐孔菌体内抗氧化活性较强的物质组成,为进一步研究表观遗传修饰剂提高桦褐孔菌次级代谢产物的分子机制奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Langfelder K, Streibel M, Jahn B,. Biosynthesis of fungal melanins and their importance for human pathogenic fungi [J]., 2003, 38(2): 143-158.
[2] Lee I K, Kim Y S, Jang Y W,. New antioxidant polyphenols from the medicinal mushroom[J]., 2007, 17(24): 6678-6681.
[3] Taji S, Yamada T, Tanaka R. Three new lanostane triterpenoids, inonotsutriols A, B, and C, from[J]., 2008, 91(8): 1513-1524.
[4] Zheng W F, Zhang M M, Zhao Y X,. Analysis of antioxidant metabolites by solvent extraction from sclerotia of(Chaga) [J]., 2011, 22(2): 95-102.
[5] Taji S, Yamada T, Wada S,. Lanostane-type triterpenoids from the sclerotia ofpossessing anti-tumor promoting activity [J]., 2008, 43(11): 2373-2379.
[6] 张仕瑾, 谢运飞, 谭玉柱, 等. 桦褐孔菌三萜类化学成分研究 [J]. 中草药, 2015, 46(16): 2355-2360.
[7] Zhao F Q, Mai Q Q, Ma J H,. Triterpenoids fromand their antitumor activities [J]., 2015, 101: 34-40.
[8] Zhao F Q, Xia G Y, Chen L X,. Chemical constituents fromand their antitumor activities [J]., 2016, 70(4): 721-730.
[9] Fradj, Santos G D, Montigny D,. RNA-seq de novo assembly and differential transcriptome analysis of chaga () cultured with different betulin sources and the regulation of genes involved in terpenoid biosynthesis [J]., 2019, 20(18): 4334.
[10] Zhao M W, Liang W Q, Zhang D B,. Cloning and characterization of squalene synthase () gene from[J]., 2007, 17(7): 1106-1112.
[11] Guzman-Chavez F, Salo O, Samol M,. Deregulation of secondary metabolism in a histone deacetylase mutant of[J]., 2018, 7(5): e00598.
[12] Lan H H, Wu L H, Sun R L,. The HosA histone deacetylase regulates aflatoxin biosynthesis through direct regulation of aflatoxin cluster genes [J]., 2019, 32(9): 1210-1228.
[13] Hyndman K A, Knepper M A. Dynamic regulation of lysine acetylation: The balance between acetyltransferase and deacetylase activities [J]., 2017, 313(4): F842-F846.
[14] Maeda K, Izawa M, Nakajima Y,. Increased metabolite production by deletion of an HDA1-type histone deacetylase in the phytopathogenic fungi,(oryzae) and[J]., 2017, 65(5): 446-452.
[15] Triastuti A, Vansteelandt M, Barakat F,. How histone deacetylase inhibitors alter the secondary metabolites of, an endophytic fungus isolated from[J]., 2019, 16(4): e1800485.
[16] Chung Y M, El-Shazly M, Chuang D W,. Suberoylanilide hydroxamic acid, a histone deacetylase inhibitor, induces the production of anti-inflammatory cyclodepsipeptides from[J]., 2013, 76(7): 1260-1266.
[17] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitativeand the 2−ΔΔCTmethod [J]., 2001, 25(4): 402-408.
[18] 赵艳霞, 刘峰, 魏娟娟, 等. 双水相超声法提取桦褐孔菌三萜 [J]. 菌物学报, 2014, 33(1): 129-137.
[19] Zhang Y, Wu X Q, Ren Y P,. Safety evaluation of a triterpenoid-rich extract from bamboo shavings [J]., 2004, 42(11): 1867-1875.
[20] Wang S Y, Wu J H, Cheng S S,. Antioxidant activity of extracts fromleaf, bark, and heartwood [J]., 2004, 50(5): 422-426.
[21] 金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基 [J]. 生物化学与生物物理进展, 1996, 23(6): 553-555.
[22] Wang S Y, Wu J H, Cheng S S,. Antioxidant activity of extracts fromleaf, bark, and heartwood [J]., 2004, 50(5): 422-426.
[23] de Groote M L, Verschure P J, Rots M G. Epigenetic Editing: Targeted rewriting of epigenetic marks to modulate expression of selected target genes [J]., 2012, 40(21): 10596-10613.
[24] Shwab E K, Bok J W, Tribus M,. Histone deacetylase activity regulates chemical diversity in[J]., 2007, 6(9): 1656-1664.
[25] Elías-Villalobos A, Helmlinger D, Ibeas J I. Histone deacetylases: Revealing the molecular base of dimorphism in pathogenic fungi [J]., 2015, 2(12): 491-493.
[26] Chen H J, Awakawa T, Sun J Y,. Epigenetic modifier-induced biosynthesis of novel fusaric acid derivatives in endophytic fungi fromL. [J]., 2013, 3(1): 20-23.
[27] Liu D Z, Liang B W, Li X F,. Epigenetic modifier-induced biosynthesis of novel acetylenic sterols fromsteroids [J]., 2014, 87: 35-38.
Effect of epigenetic modifier SAHA on production of triterpenoids in
ZHAO Yan-xia, ZHOU Rong, SUN Meng-ni, YUAN Wen-wen, ZHENG Wei-fa
School of Life Sciences, Jiangsu Normal University, Xuzhou 221116, China
Triterpenoids are one of the major classes of bioactive secondary metabolites produced by medicinal basidiomycete.However, the accumulation of triterpenoids is less under lab culture conditions. The purpose of this study was to investigate the regulation of the histone deacetylase (HDAC) inhibitor suberoylanilide hydroxamic acid (SAHA) on the biosynthesis of triterpenoids in.was cultured by liquid shake flask in the presence of SAHA. For determining the effects of SAHA on biosynthesis of triterpenoids by, the mRNA expression level of genes encoding 3-hydroxy-3-methyl glutaryl-CoA synthase (HMGS), 3-hydroxy-3-methyl glutary-CoA reductase (HMGR), mevalonate kinase (MK), diphosphomevalonate decarboxylase (DPMD), squalene synthase (SS) and lanosterol synthase (LS) by real-time PCR. For assaying the triterpenoids contents inunder submerged culture conditions, Vanillin- Perchloric Acid Method was used to determine the production of total triterpenoids either in mycelia or in the culture broth.The results showed that the addition of SAHA enhanced the expression levels of,,,,andin. Consistent with the increase of gene expression, the accumulation of total triterpenoids was increased to (66.4 ± 5.24) mg/g for mycelial triterpenoids and (49.3 ± 3.8) mg/L for extracellular triterpenoids, which was obviously higher than (22.7 ± 3.3) mg/g mycelial triterpenoids and (30.5 ± 2.7) mg/L extracellular triterpenoids found in the control cultures. Furthermore, SAHA treatment enhanced the capacity of mycelial triterpenoids to scavenge free radicals.In summary, SAHA can be used as a regulator to stimulate the accumulation of triterpenoids ofunder submerged culture conditions.
; triterpenoids; histone deacetylase; suberoylanilide hydroxamic acid; free radical
R286.2
A
0253 - 2670(2022)07 - 2137 - 06
10.7501/j.issn.0253-2670.2022.07.024
2021-08-09
国家自然科学基金项目(31470173);国家自然科学基金项目(31400431);江苏师范大学研究生创新计划项目(2021XKT0752)
赵艳霞(1980—),女,河北衡水,副教授,博士,主要从事药用真菌次级代谢产物研究。Tel: (0516)83403179 E-mail: zhaoyx0318@126.com
郑维发(1962—),男,安徽南陵,教授,博士,主要从事药用真菌次级代谢产物的代谢调控研究。Tel: (0516)83403179 E-mail: yyzw@jsnu.edu.cn
[责任编辑 时圣明]
