冬枣果实发育过程中非标记定量蛋白质组学分析
2022-03-30侯召华
田 晏,侯召华
(齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
冬枣(Ziziphus jujubaMill.cv. Dongzao)为鼠李科枣属冬枣植物的果实,果皮较薄,果肉脆嫩多汁,口感鲜甜,主要种植于山东沾化一带,是我国特有的品种[1],因其采摘时气温较低,故称之为冬枣[2]。冬枣含有多种人体必需氨基酸[3]及微量元素,维生素含量较高[4],深受广大消费者喜爱。蛋白质组学是后基因组时代出现的一个新的研究领域,是研究细胞、组织或生物体蛋白质组成及其变化规律的新技术,可用于研究植物生长发育、生物和非生物胁迫的响应及发病机理等[5]。蛋白质作为功能执行体,是基因表达的直接产物[6]。与转录组相比,蛋白质组能更直接地反映植物基因的表达状态。目前已有将蛋白质组学技术应用于枇杷[7]、葡萄[8]、荔枝[9]、石榴[10]等果品的相关报道。在冬枣果实生长发育过程中,果皮由绿色向黄白、红色转变,随着果皮中可溶性固形物、香气物质、色素相关物质的持续积累,相关基因表达及蛋白质合成也出现相应变化[11]。目前以冬枣果实发育过程蛋白质组为研究对象的报道较少,且数据库不够完整,因此有必要对冬枣果实成熟过程的蛋白质表达特性开展深入研究。
本研究以‘沾冬2号’冬枣为研究对象,利用非标记定量蛋白质组学技术,通过液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)和最新数据库检索,比较冬枣果实4 个阶段差异蛋白质表达特征,结合生物学代谢通路分析,筛选出冬枣果实的关键代谢通路及重要差异蛋白,以期从蛋白质水平阐明果实的发育机制,为研究冬枣的成熟发育机制提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
冬枣果实品种为‘沾冬2号’(Ziziphus jujubaMill.‘Zhandong 2’),2020年7—10月采于山东省滨州市沾化区。在4 个生长发育阶段,即幼果(DE01)、膨大期果实(DE02)、白熟期果实(DE03)、脆熟期果实(DE04)分别采集果实(图1),样品用液氮速冻粉碎后,置-80 ℃冰箱贮藏备用。
胰蛋白酶 普洛麦格北京生物技术有限公司;二硫苏糖醇、碘乙酰胺、尿素、碳酸氢铵(均为分析纯) 美国Sigma公司;三氟乙酸(分析纯),乙腈、甲醇、甲酸、乙酸(均为质谱级) 美国Thermo Fisher公司。

图1 不同生长阶段的冬枣果实Fig. 1 Winter jujube fruits at different developmental stages
1.2 仪器与设备
Ultimate 3000 RSLC Nano液相色谱仪、Q Exactive HF纳升液相色谱-四极杆串联静电场轨道阱超高分辨质谱仪(Orbitrap 240000FWHM) 赛默飞世尔科技有限公司;Allgera X-30R冷冻高速离心机 美国Beckman公司;BTP8ZL真空冷冻干燥器 美国SP Scientific公司;BILON-650Y超声波细胞粉碎机 上海比朗仪器制造有限公司。
1.3 方法
1.3.1 样品处理
选择大小均匀、无病虫害、无机械伤的幼果期果实(DE01A、DE01B、DE01C),膨大期果实(DE02A、DE02B、DE02C),白熟期果实(DE03A、DE03B、DE03C),脆熟期果实(DE04A、DE04B、DE04C),去除枣核后液氮速冻,粉碎,-80 ℃冰箱贮藏备用。每一阶段样品分别进行3 个生物学重复。
1.3.2 蛋白质提取及肽段酶解
参考文献[12]的方法,并略作改进。称取3 g样品粉末于50 mL离心管,加入5 倍体积-20 ℃预冷丙酮;匀浆混匀后于-20 ℃静置4 h以上;4 ℃、10 000×g离心30 min,弃上清液;沉淀用100%预冷丙酮5 mL,清洗3 次;4 ℃、10 000×g离心15 min;沉淀用氮气吹干后,得蛋白质粗提物。取0.25 g蛋白质样品,溶于2.5 mL尿素裂解液(5 mol/L尿素、2 mol/L硫脲、2% CHAPS、2% SB-3-10、1% PMSF、20 mmol/L二硫苏糖醇),超声波破碎处理(50%功率,工作2 s,间歇3 s,循环5~10 min);处理后,20 ℃、14 000×g离心40 min,得上清液;0.45 μm滤膜过滤,得蛋白质溶液,考马斯亮蓝法定量分析,-80 ℃冰箱保存备用。
各组样品按超滤辅助样品制备法进行胰蛋白酶酶解[13],通过C18Cartridge固相萃取柱对酶解肽段脱盐,供液相色谱检测。
1.3.3 LC-MS/MS检测
样品酶解后,采用Q Exactive HF纳升液相色谱对酶解肽段混合物进行质谱分析。
NanoViperC18色谱柱(75 μm×15 cm,2 μm);流动相:A为0.1%甲酸溶液,B为0.1%甲酸-80%乙腈溶液;流速300 nL/min;梯度洗脱:120 min;0~3 min,96% A、4% B;3~100 min,96%~66% A、4%~34% B;100~115 min,66%~55% A、34%~45% B;115~120 min,1% A、99% B。
质谱采用离子源为阳离子模式、DDA模式数据采集,得到LC-MS/MS原始数据,用软件Proteome Discoverer 2.2(PD2.2)搜库鉴定,并进行定量分析。
1.4 统计学分析
用Perseus软件(版本号1.6.5.0)和悟空快速查看与分析数据云平台(https://wkomics.Omicsolution.com)对PD搜库数据结果进行显著分析、主成分分析(principle component analysis,PCA)。对蛋白质含量丰度进行数值质控,变异系数不大于0.2,数值转化log2-transformed,Z-scores中心化,并且缺失值正态分布填充(width 0.3, downshift 1.8);Benjamini-Hochberg FDR<0.01。差异倍数(fold change,FC)≥2,P<0.05或FC≤0.5,P<0.05,差异显著。
1.5 生物信息学分析
用Uniprot蛋白数据库(http://www.ebi.uniprot.org)对所鉴定到的蛋白质进行基因本体论(Gene Ontology,GO)注释,依据蛋白质参与的生物学过程、细胞学组分和分子功能属性,与各自的前一阶段比较,利用在线分析软件Omicsbean(http://www.omicsbean.cn)对冬枣果实不同发育阶段出现的差异蛋白分别进行GO、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)注释富集分析以及蛋白质互作(protein-protein interaction,PPI)分析,挖掘冬枣果实在发育过程中由差异蛋白表达变化导致发生改变的重要代谢信号通路。
2 结果与分析
2.1 蛋白质鉴定及相对定量
采用Proteome Discoverer 2.2软件对冬枣蛋白质质谱进行检索,筛选出可信度水平在95%以上的蛋白质共2 107 个;根据3 次重复实验中至少2 次鉴定到同一蛋白的原则,从4 个发育阶段分别鉴定到2 095、2 039、2 065、2 042 个蛋白质,其中定量1 986 个,占总数的94.26%。冬枣果实发育过程中差异表达蛋白质的数量分布和差异如图2A所示,其中DE01组和DE02组共有差异表达蛋白质2 033 个,DE02组和DE03组共有差异表达蛋白质2 021 个,DE03组和DE04组共有差异表达蛋白质2 029 个。

图2 发育过程中冬枣样品的蛋白质差异Fig. 2 Venn diagram and PCA plot for differentially expressed proteins in winter jujube samples between different developmental stages
为进一步揭示不同发育阶段冬枣果实的蛋白质差异性,对4 个不同发育阶段果实的蛋白质数据进行PCA(图2B),变量PC1、PC2累计贡献率达86.7%。12 个样本被显著的分为4 类,依次为:DE01A、DE01B、DE01C,DE02A、DE02B、DE02C,DE03A、DE03B、DE03C,DE04A、DE04B、DE04C,表明不同发育阶段的冬枣果实蛋白质存在显著差异,且生物学重复之间具有密切的相关性。
2.2 生物信息学分析
2.2.1 不同发育阶段蛋白鉴定结果
对4 组蛋白质进行方差分析,使用t检验对表达强度进行比较。结果显示,与各自的前一阶段相比,在膨大期、白熟期、脆熟期果实中差异表达蛋白数分别为96、185、138 个(表1)。对差异表达蛋白质进行生物信息学分析,Level 3水平上进行GO、KEGG分析及PPI分析,参考拟南芥进行映射。

表1 不同阶段差异表达蛋白的数量Table 1 Number of differentially expressed proteins between different developmental and ripening stages
2.2.2 差异表达蛋白的GO注释及富集分析
使用GO功能分类系统对3 组对比的差异蛋白进行生物过程、细胞组分和分子功能分析,以明确差异表达蛋白参与行使的功能。GO表明,DE02 vs DE01差异表达蛋白主要参与的生物过程有单一生物细胞过程、单一生物代谢过程、化学响应、压力响应、细胞成分组织;经细胞组分分析发现,差异表达蛋白主要富集在细胞内、细胞外部分、膜结合细胞器、细胞周围;差异表达蛋白的分析功能主要包括氧化还原酶活性、蛋白质结合、水解酶活性等(图3A)。

图3 GO功能注释及富集分析Fig. 3 Functional annotation and enrichment analysis using GO
DE03vs DE02差异表达蛋白主要参与的生物过程有单一生物代谢过程、单一生物细胞过程、压力响应、细胞成分组织、化学响应;经细胞组分分析发现,差异表达蛋白主要富集在细胞内、细胞外部分、膜结合细胞器、细胞周围;差异表达蛋白的分析功能主要包括蛋白质结合、氧化还原酶活性、核糖体结构组成、辅助因子结合等(图3B)。
DE04 vs DE03差异表达蛋白主要参与的生物过程有单一生物细胞过程、单一生物代谢过程、生物合成的过程、细胞成分组织、压力响应;经细胞组分分析发现,差异表达蛋白主要富集在细胞内、细胞外部分、膜结合细胞器;差异表达蛋白的分析功能主要包括蛋白质结合、氧化还原酶活性、核糖体结构组成等(图3C)。
2.2.3 KEGG注释富集分析
KEGG通路分析为探讨蛋白参与的生物学代谢通路及其潜在的作用提供了重要信息,表2~4中分别列出了DE02 vs DE01组、DE03 vs DE02组、DE04 vs DE03组富集途径重要差异表达蛋白的定量信息。冬枣果实各发育阶段中差异表达蛋白质的显著富集代谢通路(P<0.05)如图4所示。图4A表明,DE02 vs DE01的差异表达蛋白质,类黄酮生物合成、柠檬烯和蒎烯降解、芪类、二芳基庚酸和姜酚的生物合成、光合作用和苯丙烷类生物合成等重要代谢通路存在显著差异。图4B表明,DE03 vs DE02的差异表达蛋白质,光合作用、核糖体、乙醛酸和二羧酸代谢等重要代谢通路存在显著差异。图4C表明,DE04 vs DE03的差异表达蛋白质,光合作用、类黄酮生物合成、核糖体、脂肪酸生物合成、脂肪酸代谢和脂肪酸降解等重要代谢通路存在显著差异。

表2 DE02 vs DE01组的差异蛋白质富集的代谢通路Table 2 KEGG pathway of differentially expressed proteins in DE02 vs DE01

表3 DE03 vs DE02组的差异蛋白质富集的代谢通路Table 3 KEGG pathway of differentially expressed proteins in DE03 vs DE02
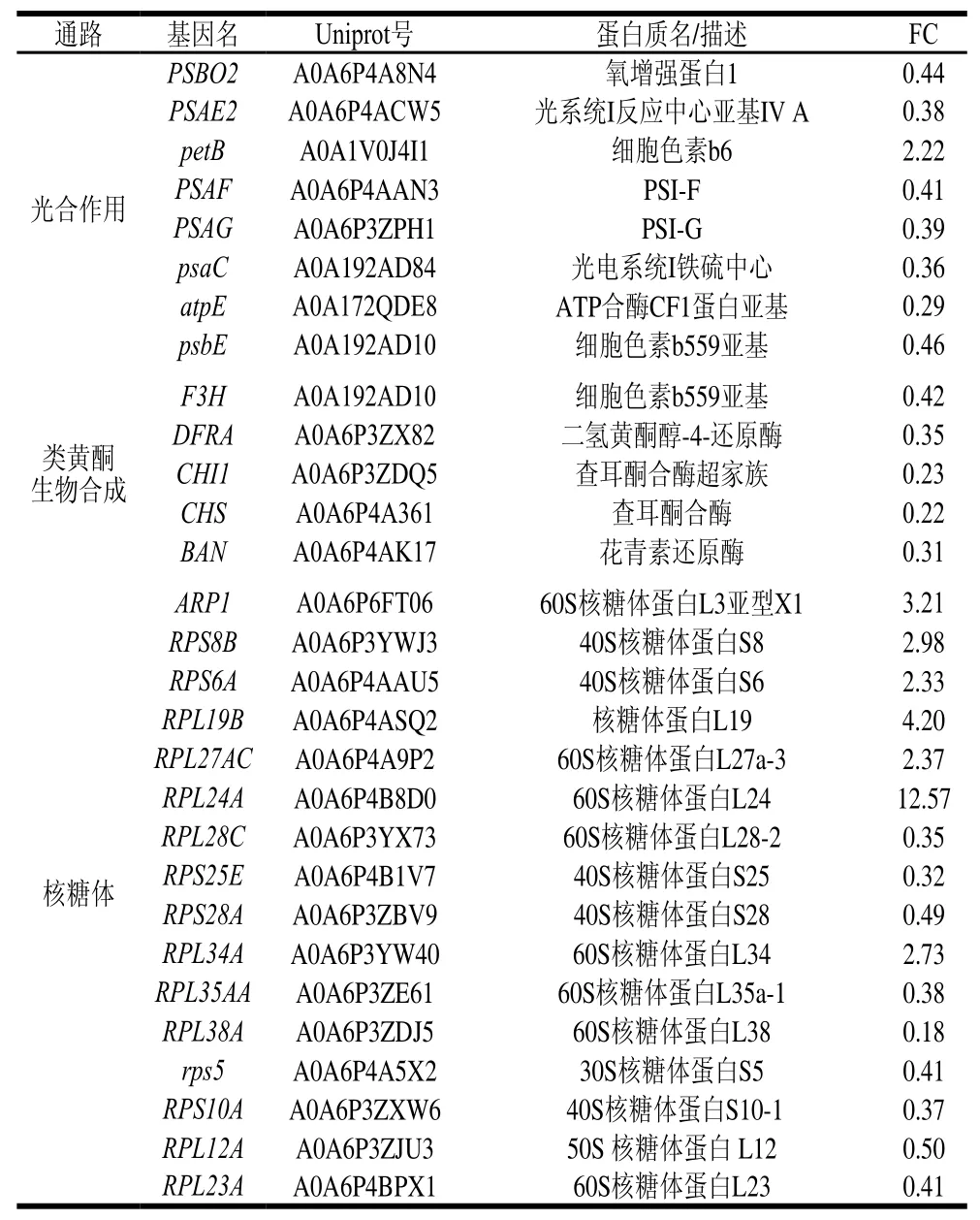
表4 DE04 vs DE03组的差异蛋白质富集的代谢通路Table 4 KEGG pathway of differentially expressed proteins in DE04 vs DE03

图4 KEGG富集分析Fig. 4 KEGG enrichment pathway
2.2.4 PPI网络

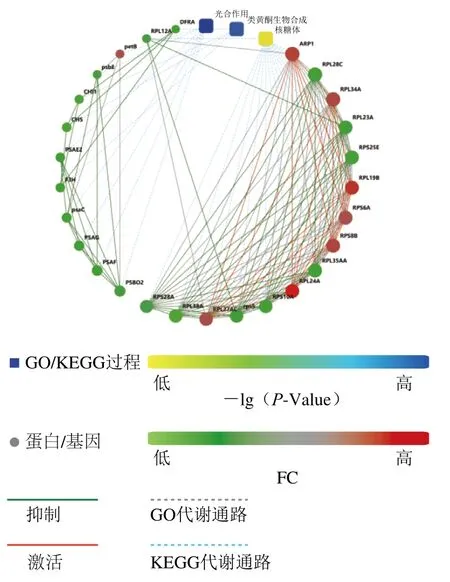
图5 不同发育时期差异蛋白网络互作Fig. 5 Interaction networks of differentially expressed proteins between different developmental periods
在生物体中,蛋白质功能的行使必须借助于其他蛋白质的调节和介导。这种调节或介导作用的实现首先要求蛋白质之间有相互作用。研究蛋白质之间的相互作用及其形成的网络对于揭示蛋白质的功能具有重要意义[14]。图5中圆点红色表示差异显著性高,绿色表示差异显著性低;方框蓝色表示富集显著性高,黄色表示富集显著性低。实线表示2 个蛋白质有直接的互作关系,虚线表示有间接的互作关系。与蛋白关联的线条数量越多,表明该蛋白在网络中越关键。冬枣果实不同发育时间的差异蛋白彼此间与互作网络数据库收录的其他蛋白间联系紧密,主要相关通路为光合作用、类黄酮生物合成、柠檬烯和蒎烯降解、芪类、二芳基庚酸和姜酚的生物合成、乙醛酸和二羧酸代谢、苯丙烷类生物合成以及核糖体等途径。
3 讨 论
冬枣4 个不同发育成熟过程(DE01、DE02、DE03、DE04)中,参与光合作用、苯丙烷类生物合成、柠檬烯和蒎烯降解、芪类、二芳基庚酸和姜酚的生物合成、类黄酮生物合成、乙醛酸和二羧酸代谢以及核糖体合成等生物学过程的蛋白质差异显著,这些代谢过程在果实品质形成过程中起重要调节作用。
3.1 冬枣果实发育中与光合作用相关蛋白质
4 个时期差异蛋白共同显著富集在光合作用途径,说明光合作用途径贯穿并调控冬枣果实的生长发育过程。光合作用可为植物生长提供能量、作为环境信号调节植物自身生长发育的形态,以增强植物对环境的适应能力。光系统I是一种色素-蛋白质复合体,可介导类囊体膜上的光驱动电子从可溶性电子供体(质体蓝素)到可溶性电子受体(铁氧还蛋白)的传递[15]。冬枣果实发育过程中,光合作用中光系统II的PsbA、PsbB、PsbC、PsbH不同程度的下调,涉及光系统I的PSAD2、PSAE2、PasA、PsaC表达也受抑制。冬枣果实发育初期富含叶绿素,光合作用相关蛋白质出现极显著表达,而在果实膨大、转色成熟过程中,相关蛋白质稳定下降。质体蓝素是高等植物中为细胞色素b6/f复合体与光系统I之间传递电子的一种含铜原子的蛋白质,位于类囊体膜内表面,是光合链中的重要成员[16]。冬枣DE03阶段质体蓝素的表达量高于DE02阶段,质体蓝素作为光系统I的电子供体,使电子经铁氧还蛋白催化NADP+生成NADPH,从而完成光反应电子链的最后一步。细胞色素b6是细胞色素b6-f复合物的组成部分,介导光系统II和光系统I之间的电子转移,光系统I周围的循环电子流动以及状态转换,它参与光诱导的光合电子传递,起电子载体的作用[17]。果实发育中后期细胞色素b6表达升高,在光合作用逐渐降低的情况下,有助于冬枣果实发育后期的能量转化和利用。
3.2 冬枣果实发育中与苯丙烷类生物合成相关蛋白质
苯丙烷类化合物是碳和能量流的重要途径,用于维持黄酮类生物合成能量和碳骨架[18]。本研究中类β-葡萄糖苷酶11亚型X1在苯丙烷类生物合成途径中被上调,类β-葡萄糖苷酶11亚型X1正向调控顺-2-羟基肉桂酸酯,从而合成在冬枣果实发育中起保护素作用的香豆素化合物。同时,过氧化物酶在此途径的最后一步反应木质素单体催化聚合为木质素,提高植物对病原菌侵害和逆境胁迫的抵御力[19]。苯丙氨酸解氨酶(phenylalaninammonialyase,PAL1)是苯丙素生物合成途径的关键酶[20],PAL1在合成途径的前端催化苯丙氨酸直接脱氨基转化为反式肉桂酸,反式肉桂酸是植物苯丙烷类次生代谢物生物合成的起始物,能反馈抑制PAL1的活性,苯丙烷类代谢途径酶系可能受其影响[21]。PAL1调控木质素和类黄酮合成,PAL1活性降低,类黄酮含量随之减少,从而提高冬枣果实的木质素活性。幼果期冬枣过氧化物酶和类β-葡萄糖苷酶11亚型X1表达量上调能正向调节冬枣果实生长活动,调控木质素合成与积累,提高冬枣在发育初期的抗病抗逆境胁迫力。DE02 vs DE01阶段中,柠檬烯和蒎烯降解,芪类、二芳基庚酸和姜酚的生物合成显著富集,说明这些途径对冬枣果实发育以及抗击逆境意义重大。
3.3 冬枣果实发育中与类黄酮生物合成相关蛋白质
类黄酮化合物是植物重要的次生代谢物,具有化学信使和抗氧化剂等多种生物学功能。黄烷醇类物质是类黄酮物质的亚类,在果实呈现绿色时大量合成,随着冬枣果皮着色,类黄酮、叶绿素含量逐渐降低[22]。查耳酮合酶(chalcone synthase,CHS)是参与类黄酮生物合成的第一个关键酶,可催化对香豆酰辅酶A和丙二酰辅酶A生成查耳酮,进一步衍生出类黄酮化合物[23],直接影响类黄酮色素的积累。查耳酮合酶超家族(chalcone synthase superfamily,CHI1)在植物中合成各种次生代谢物,提高植物早期进化过程中对环境胁迫的抵御力。黄烷酮3-羟化酶(flavanone 3-hydroxylase,F3H)是黄酮类化合物合成途径的关键酶,可催化柚皮素合成,为黄酮醇、花青素的前体的合成提供原料[24]。二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)在花青素合成下游途径中将二氢黄酮醇转变为花青素苷反应的第一个酶,直接调控花青素合成[25]。花青素还原酶(anthocyanidin reductase,BAN)对花青素的生物合成有重要的调控作用,且其在冬枣生长发育过程中的表达模式与花青素的合成呈现负相关,是花青素积累中关键的负调控因子[26]。本研究中,冬枣果实发育过程中CHS、CHI1、F3H、BAN、DFR不同程度的下调,这些蛋白是来自不同蛋白翻译后修饰的异构体,连续作用于类黄酮生物合成。它们都有一个相似的模式,在第1个生长期结束后急剧下降,呈现与前人研究葡萄类黄酮合成途径较一致的规律[27]。
3.4 冬枣果实发育中与乙醛酸和二羧酸代谢相关蛋白质
谷氨酰胺合成酶(glutamine synthetase,GLN1-1)是高等植物氮代谢中重要的酶,表达受不同外界因素的影响,其中最主要的是氮源、光照调节和叶绿体发育[28]。本研究中GLN1-1在乙醛酸和二羧酸代谢途径中下调,这与冬枣果实发育过程中光合作用逐渐下调有关。丝氨酸羟甲基转移酶(serine hydroxymethyl transferase,SHMT2)作为L-丝氨酸合成中的关键酶,能催化甘氨酸和L-丝氨酸的相互转化。丝氨酸是光呼吸关键酶的代谢调控因子,甘油酸脱氢酶(glycerol dehydrogenase,HPR)正向调控光呼吸氧化底物乙醇酸的合成。在长期进化过程中,光呼吸是为植物提高抗逆性而形成的一条代谢途径,具有重要的生理意义[29-30]。本研究中SHMT2和HPR表达上调,有助于调控光呼吸的进行,为冬枣果实发育中后期适应环境变化而提高其抗逆性,以维持冬枣果实的正常生理作用。过氧化氢酶几乎能在所有需氧呼吸的生物体中发生,可保护冬枣细胞免受过氧化氢的毒性作用。苹果酸脱氢酶能够将苹果酸脱氢转化为草酰乙酸并还原成苹果酸,苹果酸用于调节细胞pH值和维持渗透压平衡,并作为三羧酸循环的中间代谢物为植物生长发育提供能量,对细胞代谢调控起重要作用[31]。
3.5 冬枣果实发育中与核糖体合成相关蛋白质
核糖体由核糖体蛋白复合物组成,是蛋白质合成的重要场所,细胞内核糖体在内质网信号序列的作用下,附着到内质网上并合成可溶性蛋白[32]。可溶性蛋白是许多植物体内酶的重要组成部分,为植物生长发育提供营养和能量,参与调控植物的多种代谢过程,与植物生长发育、成熟衰老以及抗逆性等密切相关。本研究中,核糖体蛋白家族40S、60S核糖体以及60S酸性核糖体在DE03 vs DE02中显著下调,说明冬枣在膨大期迅速积累糖分,蛋白质合成速率逐渐降低。而在冬枣果实成熟后期以60S核糖体为主的蛋白不同程度的上调,与下调蛋白数目相比,比率接近1。与前人枣类发育过程中果实的可溶性蛋白质含量呈三峰曲线变化趋势研究结果一致[33],可溶性蛋白质含量在冬枣发育期内变化不明显,至成熟时游离氨基酸含量降低。
4 结 论
通过沾化冬枣不同成熟阶段(DE01、DE02、DE03、DE04)的蛋白质组分析,共定性2 107 个蛋白质,定量1 986 个蛋白质,其中DE02 vs DE01、DE03 vs DE01、DE04 vs DE03差异表达蛋白质分别为96、185、138 个。差异蛋白质GO显示,主要富集单一生物细胞过程、单一生物代谢过程、化学响应、压力响应等生物学过程。KEGG代谢通路分析表明,差异表达蛋白显著富集在光合作用、苯丙烷类生物合成、柠檬烯和蒎烯降解、类黄酮生物合成、乙醛酸和二羧酸代谢以及核糖体合成等。冬枣果实不同成熟阶段蛋白质组差异显著,差异蛋白质主要参与能量代谢、遗传信息处理和其他次生代谢物的生物合成等途径,这些代谢途径在二代冬枣果实品质形成过程中起重要调节作用。
