发酵酸化技术对乳饼蛋白质降解及蛋白肽生物活性的影响
2022-03-30魏光强王道滇杨彩艳万长江黄艾祥
魏光强,王道滇,杨彩艳,万长江,黄艾祥,*
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.大理农林职业技术学院工程学院,云南 大理 671003)
乳饼是滇中彝族、路南撒尼族地区的一种历史悠久、民族特色浓郁的传统酸凝新鲜奶酪,距今已有600多年的历史。目前,酸凝奶酪加工过程中的酸化技术主要有添加酸凝剂的直接酸化和微生物发酵慢酸化,研究表明,不同的酸化技术影响奶酪的理化特性、功能特性、微生物组成以及风味特征[1-2]。乳饼沿袭了传统的直接酸化技术,通过向原料乳中添加自然发酵的酸乳清,在高温条件下(85~90 ℃)酸促凝乳,排乳清得到乳凝胶,然后在模具里压制成型制得[3],因直接酸化工艺具有快速、简便、成本低等特点而得以传承。但传统的直接酸化技术在高温条件下通过添加自然发酵的酸乳清,快速酸化凝乳,导致乳饼的结构不稳定性、维生素受损,产品伴有不愉悦的酸腐味,产品保质期段,质量难以控制,从而阻碍了乳饼行业的发展。
乳酸菌在发酵乳制品中起重要作用,乳酸菌发酵代谢能产生有机酸、游离氨基酸、肽以及挥发性风味成分,在改善乳制品风味的同时,提升其营养价值。在过去20年中[4-5],从乳制品中分离和鉴定了各种血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制肽[6-7];此外,从酪蛋白和乳清的水解物中分离鉴定了具有螯合过渡金属和清除自由基能力的抗氧化肽[8-9]。张军蒙[10]筛选具有益生的乳酸菌制备了具有降糖活性的发酵乳,Ayyash等[11]发现添加植物乳杆菌骆驼奶发酵乳具有抗癌活性、α-淀粉酶和α-葡萄糖苷酶抑制活性、ACE抑制活性和抗氧化活性。前期研究通过添加乳酸菌发酵酸化,再辅助加热凝乳,研发了一种发酵酸化乳饼(fermented rubing cheese,FRB),改善了乳饼的营养品质和风味特征。
目前,关于发酵酸化技术对乳饼蛋白质降解以及蛋白肽生物活性的影响鲜有报道,本研究通过接种课题组前期自主筛选的罗伊氏乳杆菌和嗜酸乳杆菌,复配中国工业微生物菌株保藏管理中心(China Center of Industrial Culture Collection,CICC)菌株嗜热链球菌和保加利亚乳杆菌发酵原料乳产酸酸化,再辅助加热促使乳凝胶加工FRB,以传统直接酸化乳饼(traditional rubing cheese,TRB)作为对照组,探究酸化技术对乳饼蛋白质的降解及蛋白肽的ACE抑制活性、降糖活性和体外抗氧化活性的影响,以期改善乳饼的营养品质,为乳饼工艺的改进提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
荷斯坦牛奶:由云南德摩菲尔生物科技有限公司提供,其主要成分为蛋白质3.1%,脂肪3.4%,总固体11.84%,乳糖4.88%,酸度13.38oT。
自然发酵酸乳清:加工乳扇、乳饼剩余的乳清装于密闭的玻璃罐中,在自然条件下发酵15~20 d而成,pH值在3.0~3.2之间。
嗜热链球菌(Streptococcus thermophilus)(菌株编号6063)和保加利亚乳杆菌(Lactobacillus delbrueckiisubsp.bulgaricus)(菌株编号6047)为CICC菌株;罗伊氏乳杆菌(L. reuteri)和嗜酸乳杆菌(L. acidophilus)从用于生产乳扇、乳饼的酸乳清中分离鉴定,4 株菌活化至活菌数大于108CFU/mL时按体积比为1∶1∶2∶2复配,菌液经离心后除去上清液,并用磷酸盐缓冲液冲洗,加入冻干保护剂后进行冷冻干燥制得直投式发酵剂(活力为2.6×107CFU/g)。
1.1.2 试剂
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、考马斯亮蓝G250(均为分析纯) 美国Sigma公司;丙烯酰胺、四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)(均为分析纯) 美国Amresco公司;标准蛋白 Marker(10~180 kDa) 美国Solarbio公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 上海晶纯生化科技股份有限公司;α-葡萄糖苷酶(分析纯)、马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu,HHL)上海源叶生物科技有限公司;对硝基苯基-β-D-吡喃葡萄糖苷酶(p-nitrophenyl-β-D-galactopyranoside,PNPG);ACE 上海源叶生物科技有限公司;甲酸、甲醇、乙腈(均为色谱纯) 德国默克股份两和公司。
1.2 仪器与设备
DYY-6C电泳仪 北京六一仪器厂;1658001垂直电泳槽 美国Bio-Rad公司;URA14M0018紫外分光光度计 上海翱艺仪器有限公司;SCIENTZ-18N真空冷冻干燥机 上海比朗仪器制造有限公司;Merck Millipore(膜片直径76 mm)超滤杯 上海轩仪仪器设备有限公司;Q Exactive四极杆质谱仪、Easy-nLC 1000液相色谱仪 赛默飞世尔科技公司;ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 μm) 美国Waters公司。
1.3 方法
1.3.1 乳饼样品的制备
TRB加工工艺:鲜牛奶→杀菌(85 ℃,15 min)→添加自然发酵酸乳清(按牛奶-酸乳清6∶1比例添加酸乳清)→调整pH 4.8→凝乳(85~90 ℃,5 min)→形成凝乳颗粒→过滤→压制成型→TRB。
FRB加工工艺:鲜牛奶→杀菌(85 ℃,15 min)→冷却(38~42 ℃)→接种发酵剂(质量分数0.2%~0.3%)→发酵(42 ℃,酸化终点pH 4.9)→升温凝乳(65 ℃,30 min)→形成凝乳块→过滤→压制成型→FRB。
1.3.2 乳饼水溶性蛋白肽的提取及超滤分离
乳饼样品切碎→按料液(水)比为1∶15进行混合→均质(8 000 r/min,5 min)→超声提取(超声功率360 W、超声时间30 min)→高速冷冻离心(9 000 r/min、4 ℃、20 min)→取上清液→超滤(0.3 MPa,过10、3 kDa的超滤膜)→冷冻干燥(5~10 MPa,-50 ℃)→乳饼蛋白肽冻干粉,保存于-80 ℃冰箱中,备用。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
利用4%的浓缩胶、12%的分离胶进行SDS-PAGE,上样质量浓度3 mg/mL,上样量20 μL。电泳结束后,电泳胶片用考马斯亮蓝G-250染液染色1 h,用20%的甲醇与冰醋酸混合液进行脱色至电泳条带清晰可见,电泳胶片使用Quantity One(Biorad, Hercules, CA, USA)软件拍摄图像并进行分析。
1.3.4 乳饼蛋白肽超滤组分中的游离氨基酸含量的测定
1.3.4.1 样品处理
精确称取50 mg样本于2 mL EP管中,准确加入600 μL 10%甲酸-甲醇-ddH2O(甲酸∶甲醇=1∶1,V/V)溶液,加入50 mg玻璃珠。放入高通量组织研磨仪中60 Hz振荡1 min,重复2 次;12 000 r/min、4 ℃离心5 min,取原始上清液100 μL,加入900 μL 10%甲酸-甲醇-ddH2O溶液,涡旋振荡30 s,取稀释后的样本100 μL,加入质量浓度为100 μg/L的双同位素内标100 μL涡旋振荡30 s,上清液过0.22 μm滤膜,过滤液加入到检测瓶中,待测。
1.3.4.2 液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)法测定游离氨基酸含量
色谱条件:ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);进样量5 μL;柱温40 ℃;流动相:A为10%甲醇溶液(含0.1%甲酸),B为50%甲醇溶液(含0.1%甲酸);梯度洗脱条件:0~6.5 min,90%~70% A、10%~30% B;6.5~7 min,70%~0% A、30%~100% B;7~8 min,0% A、100% B;8~8.5 min,0%~90% A、100%~10% B;8.5~12.5 min,90% A、10% B;流速:0~8.5 min,0.3 mL/min;8.5~12.5 min,0.3~0.4 mL/min。
1.3.5 乳饼蛋白肽的液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)鉴定
样品用0.1%三氟乙酸溶解,ZipTip脱盐,真空离心旋干,0.1%的甲酸溶解,上质谱。反相柱:C18柱(150 μm×15 cm,1.8 μm);色谱仪器:Thermo Fisher Easy-nLC 1000;质谱仪器:Thermo Fisher LTQ Obitrap ETD;流动相A:0.1%甲酸溶液,流动相B:乙腈;LC-MS/MS梯度分离条件为:0~2 min,96%~93% A、4%~7% B,300 nL/min;2~98 min,93%~75% A、7%~25% B,300 nL/min;98~108 min,75%~65% A、25%~35% B,300 nL/min;108~110 min,65%~10% A、35%~90% B,600 nL/min;110~117 min,10%A、90% B,600 nL/min;117~118 min,10%~96% A、90%~4% B,300 nL/min;118~122 min,96% A、4% B,300 nL/min。
1.3.6 乳饼蛋白肽数据库检索
Xcalibur采集的*.RAW文件用Thermo Proteome Discoverer Daemon(v1.4)转换成*.MGF格式,之后用Mascot 2.2软件在牛(bovine,蛋白质数目为17 890)蛋白数据库中进行检索。搜库参数如下:不设置酶切、最大漏切数和固定修饰,可变修饰设置为甲硫氨酸的氧化(+15.994 9 Da)。母离子的质量容忍偏差为20×10-6,碎片离子为0.1 Da。导出肽段时设置Score≥30,显著性差异P<0.01,同时控制假阳性率(false discovery rate,FDR)<1%。通过数据库BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)、EROP(http://erop.inbi.ras.ru/)和Milk Bioactive Peptide Database(http://mbpdb.nws.oregonstate.edu/)检索,评估乳饼水溶性蛋白肽的潜在生物活性。
1.3.7 乳饼蛋白肽生物活性测定
1.3.7.1 体外抗氧化活性测定
参考Liu Jingbo等[12]的方法测定ABTS阳离子自由基清除能力;参考Gecibesler等[13]的方法测定DPPH自由基清除能力;根据Lin Songyi等[14]的方法测定还原能力。
1.3.7.2α-葡萄糖苷酶抑制活性的测定
参照Lim等[15]的方法略作修改。吸取5 μL的25 U/mLα-葡萄糖苷酶溶液、10 μL的样品溶液和620 μL pH 6.8的0.1 mol/L磷酸盐缓冲液于试管中,混匀后于37.5 ℃反应20 min,然后加入10 μL 10 mmol/L PNPG溶液,混合并在37.5 ℃反应30 min,最后,通过添加650 μL 0.2 mol/L的碳酸钠溶液终止反应。使用分光光度计测定每个样品在405 nm波长处的最大吸光度(A)。α-葡萄糖苷酶抑制率按式(1)计算:
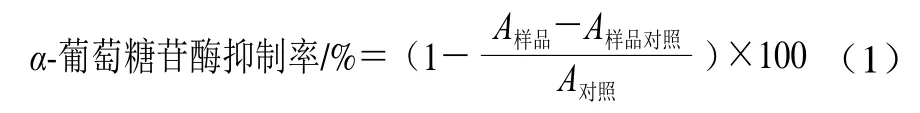
1.3.7.3 ACE抑制活性的测定
参照Cushman等[16]的方法略作改动。取5 mL离心管,加入5 mmol/L HHL 底物为0.05 mol/L的硼酸钠缓冲液200 μL,再加入100 μL待测乳清,混合,在37 ℃水浴中预热3 min,加入20 μL ACE酶液,在37 ℃水浴中等待30 min,再加入250 μL 1 mol/L盐酸终止反应。加入1.7 mL乙酸乙酯,振荡15 s,4 000 r/min离心10 min,取上层的1 mL乙酸乙酯,45 ℃加热挥发去除有机溶剂,再加入3 mL去离子水,并振荡摇匀30 s,用紫外分光光度计在228 nm波长处测定样品吸光度。按式(2)计算ACE抑制率:
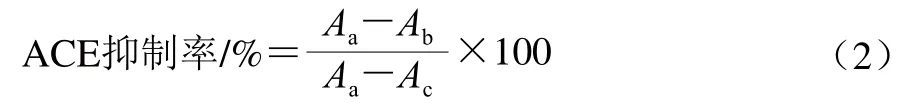
式中:Aa为未加乳饼蛋白肽对照组吸光度;Ab为反应组吸光度;Ac为空白组吸光度。
1.3.7.4 蛋白肽生物活性IC50值测定
将乳饼蛋白肽各超滤组分稀释成不同的浓度(≥5 个浓度梯度),分别测定其体外抗氧化活性、α-葡萄糖苷酶抑制率和ACE抑制率,以浓度为横坐标,抑制率为纵坐标,进行非线性拟合,得出回归方程,并计算各生物活性的IC50值。
1.4 数据处理与分析
所有数据均做平行实验,使用SPSS 19.0统计软件进行分析处理,处理结果以表示,P<0.05,差异显著。采用Microsoft Excel 2007和Origin 2019b进行图表绘制;采用Origin 2019b进行相关性分析及绘制相关性热图;采用Image J进行电泳条带强度的测定。
2 结果与分析
2.1 发酵酸化技术对乳饼蛋白质降解的影响

图1 FRB和TRB酪蛋白SDS-PAGE图谱(A)和各酪蛋白组分电泳条带强度谱图(B)Fig. 1 SDS-PAGE pattern of casein from rubing cheese (A) and intensity of electrophoretic band of each casein component in FRB and TRB (B)
利用SDS-PAGE测定了FRB和TRB蛋白质的降解程度,通过Image J软件分析2 种蛋白质各组分电泳条带强度,结果如图1所示。可知FRB和TRB中的酪蛋白在加工过程中都产生了一定程度的降解,FRB的αs-酪蛋白谱带灰度低于TRB,而TRB的β-酪蛋白谱带灰度低于FRB,此外,FRB中的乳清蛋白(β-乳球蛋白和α-乳白蛋白)条带灰度比TRB浅,说明发酵酸化技术对αs-酪蛋白和乳清蛋白产生了更高程度的水解。蛋白降解主要依靠内源蛋白酶和微生物蛋白酶的共同作用,发酵酸化技术除发酵剂发酵产生的酸水解作用外,非发酵剂和次生菌群的微生物在发酵过程中能够分泌出肽内切酶、二肽酶和氨基酸酶等胞外蛋白酶和肽酶,它们会对乳蛋白进行特异性的水解,释放生物活性肽[17]。而传统的直接酸化工艺是直接加入酸凝剂使牛奶中的蛋白质快速沉淀,直接酸化技术不仅作用于蛋白质表面,还作用于胶束内部[18],从而酸水解乳中的蛋白质产生蛋白肽。综上,直接酸化和发酵酸化技术都能促进乳蛋白的降解,发酵酸化技术对αs-酪蛋白和乳清蛋白的水解程度更高。
2.2 发酵酸化技术对乳饼蛋白肽中游离氨基酸含量的影响

表1 乳饼水溶性蛋白肽中游离氨基酸含量Table 1 Free amino acid contents of water-soluble peptides in rubing cheese μg/g
由表1可知,乳饼蛋白肽各超滤组分中都含有游离氨基酸,原因是大分子肽具有一定的空间结构,能吸附小分子的游离氨基酸,从而使部分游离氨基酸难以通过超滤达到与肽完全分离的目的。FRB水溶性蛋白肽超滤组分中的游离氨基酸含量是TRB的3 倍,原因是FRB加工过程中添加了乳酸菌发酵剂,在发酵过程中能够分泌出肽酶和蛋白酶,它们会对乳蛋白进行不同程度的水解,释放出生物活性肽和游离氨基酸[17,19]。乳饼蛋白肽各分离组分中游离氨基酸含量由大到小顺序为FRB 3~10 kDa(673.69 μg/g)、FRB<3 kDa(597.18 μg/g)、TRB 3~10 kDa(196.37 μg/g)、TRB<3 kDa(181.87 μg/g),马鹿茸酶解液中3~10 kDa分子质量段中的游离氨基酸含量高于<3 kDa肽段,与本研究结果一致[20]。FRB超滤组分中具有抗氧化活性的氨基酸(Met、Tyr、His、Lys)[21]含量高于TRB,它们具有将质子捐赠给自由基的能力以及具有螯合金属阳离子的能力,对超滤组分的抗氧化活性具有一定的促进作用。较高的疏水性氨基酸(Ala、Val、Pro、Trp、Leu、Met)含量(FRB 3~10 kDa:181.63 μg/g;FRB 3 kDa:144.35 μg/g)对α-葡萄糖苷酶显示出较好的抑制活性,Leu本身就具有与Ile和Val一起合作修复肌肉,控制血糖等作用,脯氨酸可能强化目标肽段的降糖活性[22]。
2.3 乳饼源生物活性肽分析
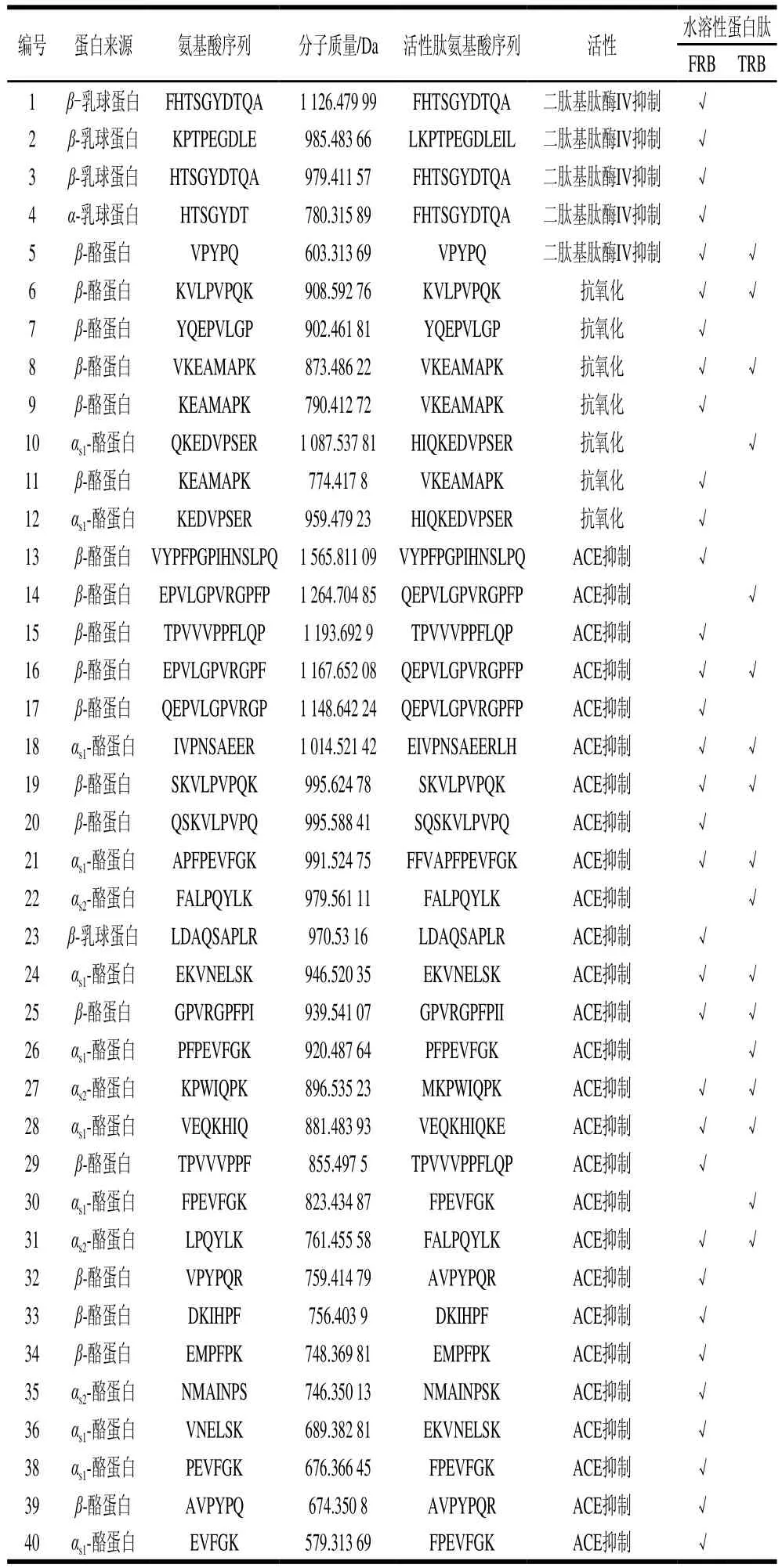
表2 乳饼潜在的抗氧化肽、降糖肽和ACE抑制肽Table 2 Potential antioxidant peptides, glycopeptides and ACE inhibitory peptides in rubing cheese
通过LC-MS/MS从FRB和TRB中分别鉴定出467 条和465 条源于酪蛋白和乳清蛋白的蛋白肽,通过数据库检索注释到乳饼潜在的ACE抑制肽28 条、潜在的抗氧化肽7 条以及潜在的降糖肽5 条,如表2所示,其中FRB中鉴定出潜在的ACE抑制肽23 条、抗氧化肽6 条和降糖肽5 条,而TRB中分别为13、4 条和1 条。潜在的ACE抑制肽主要来源于β-酪蛋白和α-酪蛋白,潜在的抗氧化肽主要来源于β-酪蛋白和α-酪蛋白,而潜在的降糖肽主要来源于乳清蛋白。原因是酪蛋白中αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白含量较高,其灵活又开放的结构导致它们很容易被酶解。由表2可知,传统的直接酸化工艺和发酵慢酸化工艺均能促进乳蛋白的降解产生抗氧化肽、降糖肽以及ACE抑制肽,但FRB中潜在的活性肽数量明显多于TRB,特别是ACE抑制肽[17-18]。研究表明,酪蛋白、乳白蛋白、乳球蛋白是ACE抑制肽的主要来源[23-25],瑞士乳杆菌[26]、干酪乳杆菌[27]、鼠李糖乳杆菌489[28]等乳酸菌能促进干酪中ACE抑制肽的释放。发酵酸化和直接酸化过程均能作用于酪蛋白胶束,破坏其结构,产生多肽,但发酵酸化中乳酸菌自身分泌出肽内切酶、二肽酶和氨基酸酶等胞外蛋白酶和肽酶能特异性水解蛋白质生产具有生物活性的蛋白肽。
2.4 发酵酸化技术对乳饼蛋白肽生物活性的影响
2.4.1 发酵酸化技术对乳饼蛋白肽体外抗氧化活性的影响
2.4.1.1 发酵酸化技术对乳饼蛋白肽总抗氧化能力的影响

图2 乳饼蛋白肽超滤组分的ABTS阳离子自由基清除率(A)和IC50值(B)Fig. 2 ABTS radical cation scavenging capacity (A) and IC50 values (B)of the fractions obtained from rubing cheese by ultrafiltration
由图2A可以看出,随着乳饼蛋白肽各超滤分离组分质量浓度的提高,ABTS阳离子自由基清除活性逐渐增强,分子质量为3~10 kDa的FRB和TRB蛋白肽ABTS阳离子自由基清除活性高于其余分离组分清除活性,在质量浓度为20 mg/mL时,清除率分别为(85.08±0.26)%和(70.62±1.00)%,具有较好的抗氧化活性。如图2B所示,分子质量为3~10 kDa的FRB和TRB蛋白肽组分ABTS阳离子自由基清除率的IC50值较低,分别为7.32 mg/mL和9.94 mg/mL。酸化技术对乳饼蛋白肽的ABTS阳离子自由基清除活性影响不显著(P>0.05)。
2.4.1.2 发酵酸化技术对乳饼蛋白肽DPPH自由基清除活性的影响

图3 乳饼蛋白肽超滤组分的DPPH自由基清除率(A)和IC50值(B)Fig. 3 DPPH radical scavenging capacity (A) and IC50 values (B) of the fractions obtained from rubing cheese by ultrafiltration
由图3可以看出,乳饼蛋白肽各超滤组分均具有清除DPPH自由基的能力,且DPPH自由基清除活性表现出显著浓度依赖关系。与一些报道的乳清抗氧化肽[29](IC50=5.52 mg/mL)相比,3~10 kDa乳饼蛋白肽较低的IC50值(FRB:1.66 mg/mL;TRB:1.76 mg/mL)表明该组分具有较好的DPPH自由基清除活性,在质量浓度为15 mg/mL时,清除率分别高达(84.18±0.36)%和(83.80±0.21)%,可能是上述2 个分离组分中含有大量的氨基酸基团,能传递氢离子或电子给DPPH自由基,从而增强DPPH自由基清除活性。研究表明,瑞氏乳杆菌加工的切达奶酪水溶性肽(分子质量为3~10 kDa,质量浓度为5 mg/mL)的DPPH自由基清除率为48.40%[30],低于发酵型乳饼的64.22%,说明FRB水溶性肽具有较好的自由基清除活性,可能和加工过程中释放一些具有螯合自由基的活性多肽和氨基酸有关。
2.4.1.3 发酵酸化技术对乳饼蛋白肽还原能力的影响
抗氧化剂通过将电子提供给自由基而获得一个质子从而使自由基变为稳定分子,还原力越强抗氧化性越强[31]。由图4可以看出,乳饼蛋白肽各组分的还原能力与其质量浓度成量效关系,分子质量<3 kDa、3~10 kDa的FRB和TRB蛋白肽在其质量浓度为10 mg/mL时还原能力分别为0.454±0.007、0.619±0.004和0.548±0.007、0.545±0.005,3~10 kDa的FRB蛋白肽还原能力的IC50值最低,为7.750 mg/mL。酸化技术对乳饼蛋白肽的还原能力影响不显著(P>0.05)。

图4 乳饼蛋白肽超滤组分的还原能力(A)和IC50值(B)Fig. 4 Reducing power (A) and IC50 values (B) of the fractions obtained from rubing cheese by ultrafiltration
研究表明,鲍鱼外套膜酶解物分子质量为3~5 kDa的组分对羟自由基和DPPH自由基的清除能力强于分子质量<1 kDa的组分[32],分子质量在3~10 kDa的鲜马奶乳清蛋白酶解液体外抗氧化活性高于分子质量<3 kDa的酶解液[33];酶解驼血制备的抗氧化肽分离各组分的抗氧化活性大小顺序为>10 kDa、3~10 kDa、<3 kDa[34]。LCMS/MS鉴定发现乳饼中潜在的抗氧化肽分子质量小于3 kDa,但活性测定表明分子质量为3~10 kDa的组分具有较好的抗氧化活性,说明超滤组分的抗氧化活性与潜在的抗氧化肽有关,但同时也和超滤组分的游离氨基酸含量相关。
2.4.2 发酵酸化技术对乳饼蛋白肽α-葡萄糖苷酶抑制活性的影响
由图5可以看出,当乳饼蛋白肽的质量浓度在5~25 mg/mL之间时,TRB蛋白肽各超滤组分除3~10 kDa组分外均无α-葡萄糖苷酶抑制活性。分子质量<3 kDa和3~10 kDa的FRB蛋白肽表现出较好的α-葡萄糖苷酶抑制活性,其α-葡萄糖苷酶抑制率IC50值分别为1.25 mg/mL和7.43 mg/mL,显著低于其余组分(P<0.05)。添加解淀粉芽孢杆菌GSBa-1凝乳酶加工的切达干酪水溶性提取物表现出α-葡萄糖苷酶抑制活性[35],分离自驼乳中的乳酸菌能提升发酵驼乳的抗糖尿病作用[36-37];鼠李糖乳杆菌GG[38]、干酪乳杆菌LC2W[39]等益生菌发酵牛乳和驼乳,均能提升发酵乳的α-葡萄糖苷酶抑制活性,因此,特异性的酶解或乳酸菌发酵能提升发酵乳制品的降糖活性。FRB加工过程中添加保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌和罗伊斯乳杆菌进行发酵,乳酸菌自身的代谢和酶系统能分解乳蛋白产生一些具有降糖活性的肽,从而提升乳饼的降糖活性,与活性肽鉴定结果一致。

图5 乳饼蛋白肽超滤组分的α-葡萄糖苷酶抑制率(A)和IC50值(B)Fig. 5 Percentage of α-glucosidase inhibition by the fractions obtained from rubing cheese by ultrafiltration (A) and their IC50 values (B)
2.4.3 发酵酸化技术对乳饼蛋白肽ACE抑制率的影响
乳制品中的ACE抑制肽不仅含量高、无毒害作用,且活性好,约有30%的ACE抑制肽来自于乳制品。由图6A可以看出,乳饼蛋白肽各组分都有一定的ACE抑制活性。由图6B可知,FRB未超滤、3~10 kDa和<3 kDa 3 个组分蛋白肽的ACE抑制率IC50值分别为0.927、0.648 mg/mL和0.416 mg/mL,均显著低于TRB各组分(1.369、1.496、1.253 mg/mL)。原因是嗜热链球菌和德氏保加利亚乳杆菌亚种的X-脯氨酸二肽氨基肽酶和脯氨酸特异性氨基肽酶能水解乳蛋白产生一些与抑制ACE有关的生物活性肽[40-41],与活性肽鉴定结果一致。成熟24 周的切达奶酪水溶性肽的ACE抑制率IC50值为0.37 mg/mL[42],ACE抑制活性强于FRB水溶性,主要原因与其较长成熟期和酶凝工艺有关。
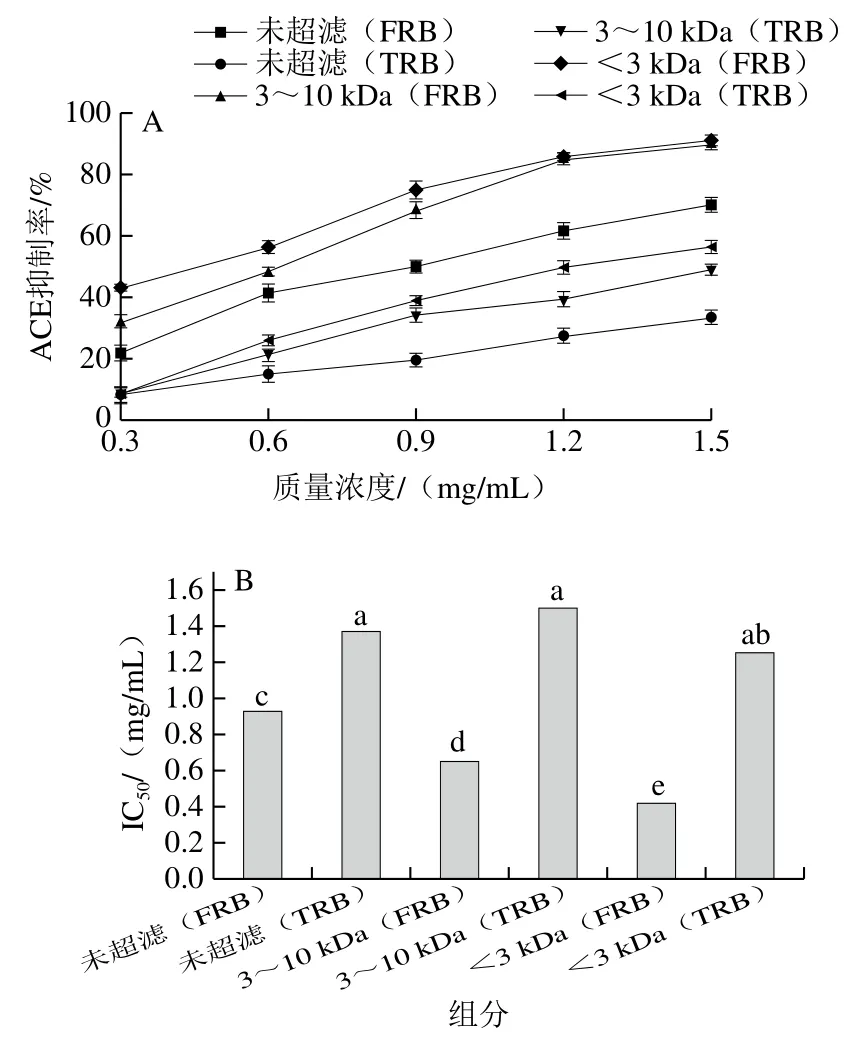
图6 乳饼蛋白肽超滤组分的ACE抑制率(A)和IC50值(B)Fig. 6 Percentage of ACE inhibition by the fractions obtained from rubing cheese by ultrafiltration (A) and their IC50 values (B)
2.5 体外生物活性与游离氨基酸相关性分析
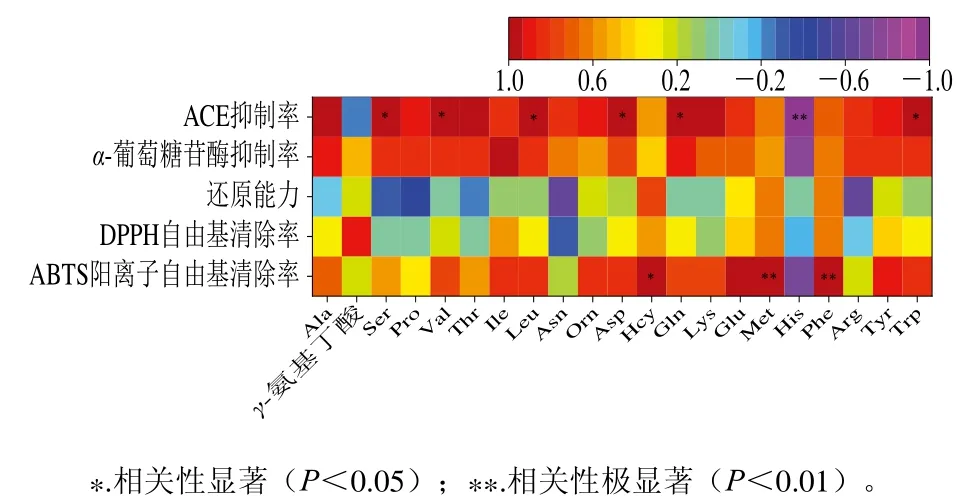
图7 乳饼蛋白肽超滤组分的体外生物活性与游离氨基酸的相关性分析Fig. 7 Correlation analysis between free amino acid contents and biological activity of rubing cheese peptides
由图7可以看出,ACE抑制活性、ABTS阳离子自由基清除率、α-葡萄糖苷酶抑制活性与大多数游离氨基酸呈正相关。ACE抑制活性与Ser、Val、Leu、Asp、Trp呈显著正相关(P<0.05)[43]。α-葡萄糖苷酶抑制活性与Pro、Val、Ile、Leu、Asp、Tyr、Trp等呈正相关,较高的疏水性氨基酸Pro、Leu、Trp、Met含量对α-葡萄糖苷酶显示出较好的抑制活性,Leu本身就具有与Ile和Val一起合作修复肌肉、控制血糖等作用,Pro可能强化目标肽段的降糖活性[26]。ABTS阳离子自由基清除率与Hcy、Met、Phe、Trp,Tyr等具有抗氧化活性的氨基酸呈正相关,它们具有将质子捐赠给自由基的能力以及具有螯合金属阳离子的能力[21]。
3 结 论
传统直接酸化和发酵酸化技术均能促进乳蛋白的降解,发酵酸化技术对乳清蛋白的降解程度更高。发酵酸化过程中,乳酸菌自身的代谢和酶系统能特异性水解乳蛋白产生具有ACE抑制活性、抗氧化活性和降糖活性的生物活性肽,同时促进游离氨基酸的释放,显著提升乳饼蛋白肽的ACE抑制活性和α-葡萄糖苷酶抑制活性(P<0.05)。发酵酸化技术能提升乳饼的生物学价值,研究可为国内酸凝奶酪制品工艺的改进提供一定的理论依据。而发酵酸化技术对乳饼的品质和风味形成机制尚不明确,有待开展相应的研究。
