唾液乳杆菌膜外蛋白对金黄色葡萄球菌黏附的影响
2022-03-30刘金秋任大勇
杨 乐,杨 柳,李 月,刘金秋,任大勇
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
金黄色葡萄球菌为革兰氏阳性菌,是人体微生物群的一部分,也是引起食物中毒、菌血症、心内膜炎、骨髓炎、皮肤和软组织感染的主要原因[1],由于其可以定植在人体内,当宿主机体免疫紊乱时,作为内源性致病菌可能会引起更严重的感染[2]。致病菌侵入肠道的第1步是黏附,继而定植到肠道,在局部产生毒素或者直接侵入组织,引起宿主细胞出现形态结构和生理功能的变化,从而引发疾病[3]。
目前在临床上尚未有基于黏附的靶向治疗手段,抗生素是目前治疗致病菌最常见的方法,抗生素的普遍使用有力地抑制了致病菌,却促进了耐药性细菌的增长。经常使用抗生素类药品会使人体的抵抗力和免疫力下降,还会消灭人体有益菌群,导致体内菌群失衡,耐药细菌乘虚而入[4]。2018年,世界卫生组织报道,如果不立即采取行动,到2050年,亚洲每年约有500万 人死于对抗生素产生耐药性的细菌感染,比预计每年死于癌症的人数还要多[5]。因此,找到其他治疗致病菌的方法至关重要。
大量研究表明,乳酸菌可以在体内外很好地抑制致病菌黏附和定植于人体肠道上皮细胞,从而达到治疗致病菌感染的作用[6-7]。部分研究表明某些乳酸菌能够促进致病菌的黏附,Collado等[8-9]研究17 株益生菌对4 种致病菌(中间葡萄球菌、鼠伤寒沙门氏菌、产荚膜梭菌、空肠弯曲菌)黏附的抑制效果,发现2 株益生性球菌提高了空肠弯曲菌黏附力,1 株双歧杆菌提高了鼠伤寒沙门氏菌的黏附力;白洁等[10]研究6 株益生菌对2 株致病菌(大肠杆菌和鼠伤寒沙门氏菌)黏附人肠道上皮细胞的影响发现,这6 株益生菌通过竞争和排斥作用反而促进了致病菌黏附。当乳酸菌促进致病菌黏附时,人体肠道内致病菌数量增加,一旦肠黏膜屏障受损,肠道系统功能紊乱,会大大增加致病几率,但乳酸菌促进黏附的具体机制尚不清楚。因此,本研究以一株前期筛选得到的促进金黄色葡萄球菌黏附的唾液乳杆菌CICC 23174为研究对象,试图从膜外蛋白角度研究其促进金黄色葡萄球菌黏附的机制,为乳酸菌安全性评价以及乳酸菌的科学使用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与动物
唾液乳杆菌(Lactobacillus salivarius)CICC 23174、金黄色葡萄球菌金黄亚种(Staphylococcus aureussubsp.aureus)ATCC 8739、大肠杆菌(Escherichia coli)DH5α和E. coliBL21(DE3)均由吉林农业大学食品科学与工程学院食品与安全毒理学实验室保存;pET-28a质粒购于淼灵质粒平台;pNZ5319质粒购于上海海吉浩格生物科技有限公司。
4 只健康SD大鼠(体质量(200±20) g)、108 只SPF级健康小鼠(体质量(20±2) g、6 周龄、雌雄各半)购于辽宁长生生物技术股份有限公司,生产许可证号:SCXK(辽)2020-0001,该研究经吉林农业大学动物保护局和使用委员会批准。
1.1.2 试剂
MRS培养基 青岛海博生物技术有限公司;2×SoSoo Mix Plus 北京擎科生物科技有限公司;质粒小量抽提试剂盒、小量胶回收试剂盒 美国Axygen公司;细菌全基因提取试剂盒 天根生化科技(北京)有限公司;XhoI、SmaI和BamH I 北京NEB公司;番红染液 北京Solarbio公司。本研究所用引物(表1)和测序结果均来自于吉林省库美生物科技有限公司。

表1 实验设计引物信息Table 1 Primer sequences used in this study
1.2 仪器与设备
Red-96G聚合酶链式反应(polymerase chain reaction,PCR)仪、Biotop SC810凝胶成像系统 上海山富科学仪器有限公司;infinite M200酶标仪 瑞士Tecan集团;DYY-11电泳仪、垂直电泳槽、水平电泳槽北京六一仪器厂;5804R离心机、5424R离心机、22331 Hamburg电转仪 德国Eppendorf公司;IX 73荧光倒置显微镜 日本奥林巴斯株式会社;XL30 ESEM-FEG场发射环境扫描电子显微镜 美国FEI公司;紫外-可见分光光度计 岛津国际贸易(上海)有限公司;FDU-1200冷冻干燥机 日本EYELA东京理化器械株式会社。
1.3 方法
1.3.1ef-g基因的克隆及重组菌E.coliBL21(DE3)的制备
唾液乳杆菌基因组为模板,利用ef-gF和ef-gR特异性引物进行PCR扩增,小量胶回收试剂盒回收ef-g基因,将ef-g基因与BamH I酶切的pET-28a质粒用2×SoSoo Mix Plus试剂盒在50 ℃水浴连接15 min。将pET-ef-g重组质粒用化学方法转化到E. coliBL21(DE3)中,含卡那霉素的LB平板筛选,隔天挑取阳性菌落,PCR验证重组E. coliBL21(DE3)菌株是否构建成功。
1.3.2 EF-G蛋白纯化及SDS-PAGE分析
重组E. coliBL21(DE3)菌株在200 r/min、37 ℃摇床培养2~3 h,OD600nm达到0.6~0.8时加入终浓度1 mmol/L异丙基-β-D-硫代半乳糖苷(isopropyβ-D-thiogalactoside,IPTG),调节温度30 ℃、转速200 r/min培养3 h诱导蛋白延伸因子G(elongation factor G,EF-G)表达,回收菌体,超声破碎,收集上清液,0.22 μm过滤器过滤,通过镍柱纯化,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证EF-G是否正确表达[11]。
1.3.3 EF-G对金黄色葡萄球菌黏附性的影响
提取大鼠肠道黏液,冻干,用碳酸钠-碳酸氢钠缓冲液(pH 9.6)以1 g/L的比例溶解,4 ℃、5 000×g离心15 min,上清液分装,-20 ℃保存备用。
用蛋白包被法验证EF-G体外促进金黄色葡萄球菌黏附。取200 µL上述肠道黏液溶液于96 孔板中,4 ℃静置过夜,实验分为2 组:第1组先加入200 µL 0.15 mg/mL EF-G溶液,4 ℃静置过夜,加入200 µL含0.05% Tween-20的PBS(PBST)封闭1 h,PBST溶液洗2 次,倒置风干,然后加入200 μL 1×109CFU/mL金黄色葡萄球菌菌液;第2组加入0.15 mg/mL EF-G溶液与1×109CFU/mL金黄色葡萄球菌的混合溶液共200 μL;两组均以PBS替代EF-G溶液作为对照组。继续4 ℃孵育过夜,吸去孔板液体,PBST洗涤2 次,无水乙醇固定10 min,加入50 µL番红染液染色,PBST洗涤1 次,倒置风干。用倒置显微镜观察番红染液染色情况,然后测定492 nm波长处测定OD值[12],评价黏附性EF-G对金黄色葡萄球菌黏附性的影响。
1.3.4ef-g基因敲除表达载体(pNZ-ef-gsx)的构建

图1 pNZ-ef-gsx敲除载体构建流程图Fig. 1 Flow chart of pNZ-ef-gsx knockout vector construction
唾液乳杆菌基因组为模板,利用ef-gsF和ef-gsR引物克隆上游基因ef-gs,ef-gxF和ef-gxR引物克隆下游基因ef-gx。将ef-gs基因与XhoI酶切的pNZ5319质粒用2×SoSoo Mix Plus试剂盒在50 ℃水浴连接15 min,得到pNZ-ef-gs重组质粒。用上述同样方法将ef-gx基因与SmaI酶切后的pNZ-ef-gs质粒连接,得到pNZ-ef-gsx基因敲除质粒,PCR验证并测序[13-14],流程见图1。
1.3.5 唾液乳杆菌Δef-g菌株的制备
提取pNZ-ef-gsx重组质粒,在电阻200 Ω、电容25 μF、电场强度2.5 kV/cm条件下[15]用电击法导入唾液乳杆菌中,通过氯霉素和红霉素抗性,多次传代筛选阳性菌株,PCR、SDS-PAGE以及测序验证唾液乳杆菌Δef-g菌株是否构建成功。
1.3.6 唾液乳杆菌Δef-g对金黄色葡萄球菌体外黏附的影响
在600 nm波长下调整唾液乳杆菌、唾液乳杆菌Δef-g和金黄色葡萄球菌浓度均为1×109CFU/mL。通过黏液蛋白黏附模型方法在体外验证唾液乳杆菌Δef-g促进金黄色葡萄球菌黏附的效果[16]。
实验组1:取200 µL肠道黏液溶液于96 孔板中,4 ℃静置过夜,次日分别加入200 µL唾液乳杆菌Δef-g菌液,4 ℃静置过夜,加入200 µL PBST封闭1 h,PBST洗2 次,倒置风干,加入浓度1×109CFU/mL的金黄色葡萄球菌菌液,4 ℃孵育过夜。取200 µL肠道黏液溶液于96 孔板中,4 ℃静置过夜,次日加200 µL PBST封闭1 h,PBST溶液洗2 次,倒置风干。实验组2:同时加入浓度均为1×109CFU/mL的金黄色葡萄球菌和唾液乳杆菌Δef-g各100 µL,4 ℃孵育过夜。两组均以等体积唾液乳杆菌菌液替代唾液乳杆菌Δef-g菌液为对照组。吸去孔板液体,PBST洗涤2 次,无水乙醇固定10 min,加入50 µL番红染液染色,PBST洗涤1 次,倒置风干。用倒置显微镜观察番红染液染色情况,然后测定492 nm波长处测定OD值。
1.3.7 唾液乳杆菌Δef-g对金黄色葡萄球菌体内黏附的影响
调整菌液浓度为1×109CFU/mL,用终浓度20 µmol/L cFDA-SE进行荧光标记[17]。
唾液乳杆菌Δef-g在小鼠肠道内的黏附情况:取36 只小鼠,雌雄各半,随机分成2 组,每组18 只,灌胃体积(以体质量计算)0.1 mL/10 g;T1组灌胃荧光标记的唾液乳杆菌,T2组灌胃荧光标记的唾液乳杆菌Δef-g。
唾液乳杆菌Δef-g在体内促进金黄色葡萄球菌黏附的效果:小鼠数量同上,灌胃体积0.1 mL/10 g。J1组灌胃未荧光标记的唾液乳杆菌和荧光标记的金黄色葡萄球菌,J2组灌胃未荧光标记的唾液乳杆菌Δef-g和荧光标记的金黄色葡萄球菌。
扫描电子显微镜直接观察唾液乳杆菌Δef-g在体内促进金黄色葡萄球菌黏附的效果:小鼠数量同上,灌胃体积0.1 mL/10 g,D1组灌胃均未荧光标记的唾液乳杆菌和金黄色葡萄球菌,D2组灌胃均未荧光标记的唾液乳杆菌Δef-g和金黄色葡萄球菌。
以上实验小鼠均灌胃1 次,分别于灌胃后24、72、120 h,每组避光处死6 只小鼠,取小鼠结肠2 cm,用1 mL无菌PBS冲洗肠道内壁,收集清洗后的PBS,过程中注意避光[18]。荧光倒置显微镜观察荧光标记菌株数量,结果以每视野下菌株数量除以小鼠数量计。用紫外分光光度计测定荧光强度,发射波长518 nm、激发波长488 nm。扫描电子显微镜观察时,将结肠组织用2.5%戊二醛固定(4 ℃、24 h),PBS无菌溶液清洗3 次。不同体积分数乙醇溶液梯度脱水,每次10 min,无水乙醇脱水2 次,醋酸异戊酯置换10 min,叔丁醇-无水乙醇(1∶1,V/V)置换10 min,再用叔丁醇I、II各置换20 min,-4 ℃冰箱过夜,喷金后用于观察。
1.4 数据统计分析
2 结果与分析
2.1 重组菌E. coli BL21(DE3)的制备及EF-G纯化验证结果
PCR扩增后1%琼脂糖凝胶电泳验证,ef-g基因正确克隆。pET-ef-g重组质粒导入E. coliBL21(DE3)中,卡那霉素筛选,PCR扩增1%琼脂糖凝胶电泳验证。经IPTG诱导重组E. coliBL21(DE3)菌株大量表达EF-G,EF-G蛋白分子质量约为77 kDa,EF-G条带位于66.4~97.2 kDa之间,表明EF-G正确表达。
2.2 EF-G对金黄色葡萄球菌黏附性的影响
番红染液可以将细胞核染成红色,菌黏附数量越多颜色越深,菌黏附数量越少颜色越浅。由图2可知,加入0.15 mg/mL EF-G后金黄色葡萄球菌黏附数量明显增多,表明EF-G促进了金黄色葡萄球菌的黏附。通过番红染液对黏附性作初步评价,再通过测定OD492nm对黏附性变化进行定量分析。由图3可知,先加入EF-G将金黄色葡萄球菌黏附率提高了43%(n=6,P<0.05),同时加入EF-G使金黄色葡萄球菌黏附率提高了40%(n=6,P<0.05),对比两组结果,先加入EF-G时,金黄色葡萄球菌黏附数量更多,可能是因为EF-G是金黄色葡萄球菌黏附的特异性识别位点,EF-G与金黄色葡萄球菌混合加入时蛋白占据了金黄色葡萄球菌表面的黏附位点,使金黄色葡萄球菌黏附率降低。

图2 EF-G对金黄色葡萄球菌黏附性的影响(番红染液)Fig. 2 Effect of EF-G on the adhesion of S. aureus as examined by safranin staining
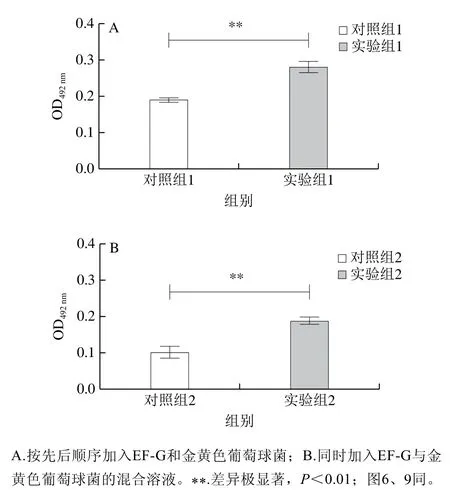
图3 EF-G对金黄色葡萄球菌黏附性的影响结果(OD492 nm)Fig. 3 Effect of EF-G on the adhesion of S. aureus as reflected by optical density at 492 nm
2.3 pNZ-ef-gsx基因敲除载体的构建及唾液乳杆菌Δef-g菌株的制备
pNZ-ef-gsx重组质粒验证结果显示pNZ-ef-gsx敲除载体构建成功。通过同源重组的方法将ef-g用氯霉素基因替换,先通过红霉素抗性筛选,再通过氯霉素抗性筛选,多次传代培养消除敲除载体,提取基因组,进行测序、PCR和SDS-PAGE验证,图4表明唾液乳杆菌Δef-g菌株构建成功。
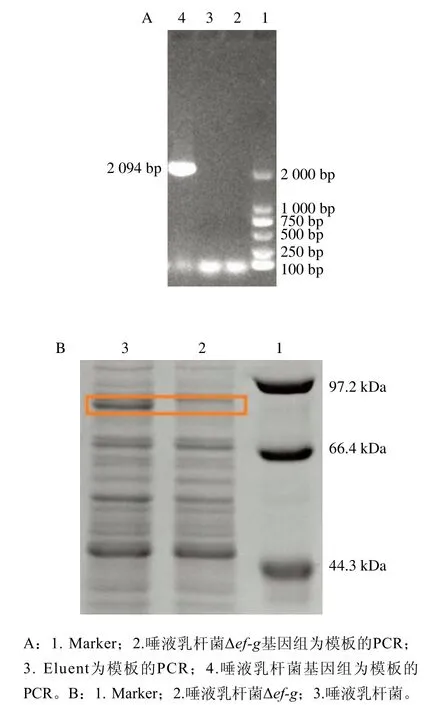
图4 唾液乳杆菌Δef-g菌株构建验证结果Fig. 4 Construction and verification of L. salivarius Δef-g strain
2.4 唾液乳杆菌Δef-g对金黄色葡萄球菌体外黏附的影响
由图5可知,唾液乳杆菌Δef-g组颜色较唾液乳杆菌组颜色浅,结果表明唾液乳杆菌Δef-g组黏附菌少。与番红染色观察结果一致,如图6所示,与唾液乳杆菌相比,实验组1的金黄色葡萄球菌黏附率降低了40%,实验组2的金黄色葡萄球菌黏附率降低了34%,结果表明EF-G能够促进金黄色葡萄球菌黏附。


图5 唾液乳杆菌Δef-g对金黄色葡萄球菌体外黏附的影响(番红染色)Fig. 5 Effect of L. salivarius Δef-g on the adhesion of S. aureus in vitro as observed by safranin staining

图6 唾液乳杆菌Δef-g对金黄色葡萄球菌体外黏附的影响Fig. 6 Effect of L. salivarius Δef-g on the in vitro adhesion of S. aureus as reflected by optical density at 492 nm
2.5 唾液乳杆菌Δef-g对金黄色葡萄球菌体内黏附的影响
2.5.1 唾液乳杆菌Δef-g体内黏附实验结果
对比图7A、B可知,唾液乳杆菌Δef-g和唾液乳杆菌数量大致相同,表明EF-G对唾液乳杆菌黏附定植肠道没有影响。


图7 唾液乳杆菌Δef-g体内黏附实验显微镜观察结果Fig. 7 Microscopic observation of L. salivarius Δef-g in vivo adhesion
2.5.2 唾液乳杆菌Δef-g促进致病菌黏附实验结果
对比图8A、B可知,唾液乳杆菌Δef-g组黏附金黄色葡萄球菌数量较唾液乳杆菌组少,表明唾液乳杆菌EF-G促进金黄色葡萄球菌黏附。
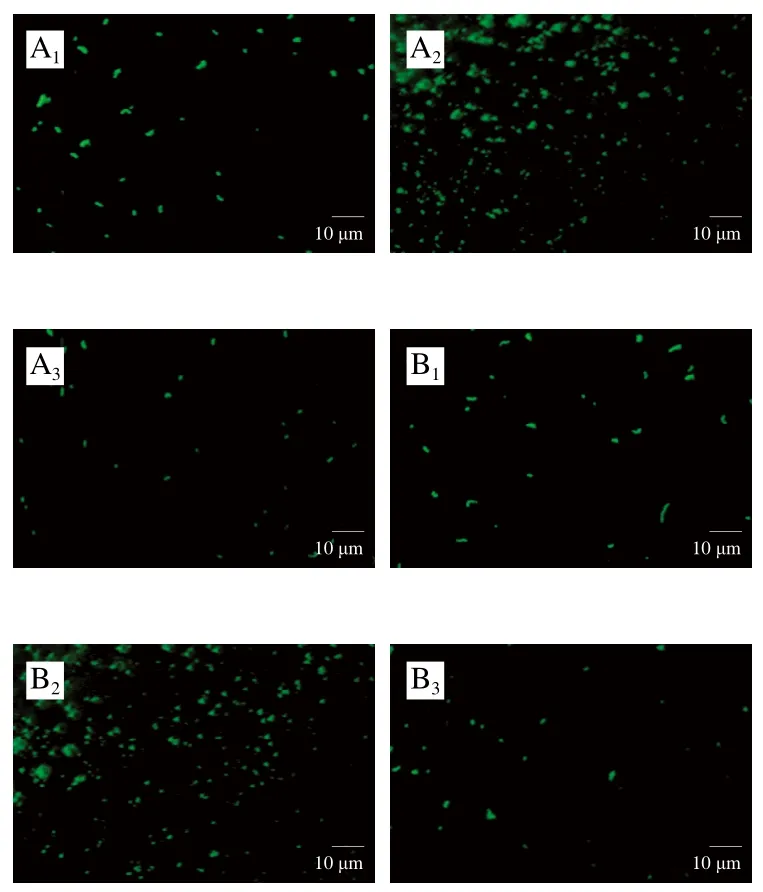
图8 唾液乳杆菌Δef-g促进金黄色葡萄球菌黏附实验显微镜观察结果Fig. 8 Microscopic observation of L. salivarius Δef-g promotion of S. aureus adhesion
2.5.3 金黄色葡萄球菌黏附的定量分析结果
如图9A、C所示,唾液乳杆菌和唾液乳杆菌Δef-g在小鼠肠道内数量大致相同,结果表明ef-g基因对唾液乳杆菌黏附定植肠道无影响;如图9B、D所示,唾液乳杆菌组黏附金黄色葡萄球菌数量较唾液乳杆菌Δef-g组多,与唾液乳杆菌组相比,唾液乳杆菌Δef-g组金黄色葡萄球菌黏附率降低了20%,表明EF-G促进唾液乳杆菌黏附金黄色葡萄球菌。


图9 唾液乳杆菌Δef-g对金黄色葡萄球菌体内黏附影响的定量分析结果Fig. 9 Effect of L. salivarius Δef-g on the in vivo adhesion of S. aureus
2.5.4 扫描电子显微镜观察唾液乳杆菌Δef-g体内促金黄色葡萄球菌黏附效果

图10 唾液乳杆菌Δef-g体内促金黄色葡萄球菌黏附效果扫描电子显微镜图Fig. 10 L. salivarius Δef-g promoted in vivo adhesion of S. aureus as observed by SEM
如图10A~C所示,一个唾液乳杆菌可促进6~10 个金黄色葡萄球菌黏附于肠道表皮,如图10D~F所示,一个唾液乳杆菌Δef-g可促进3~5 个金黄色葡萄球菌黏附于肠道表皮,更直观地表明EF-G促进唾液乳杆菌黏附金黄色葡萄球菌。
3 讨 论
定植是致病菌入侵人体肠道的第1步,乳酸菌通过与致病菌竞争细胞黏附位点,从而发挥其抗感染的作用,然而有研究表明这种通过竞争黏附位点抑制致病菌的黏附,反而会促进致病菌的黏附[19],Tuomola等[20]也报道了两株鼠李糖乳杆菌将沙门氏菌的黏附率提高至190%和332%,但具体机制尚不清楚。有研究发现乳酸菌膜外蛋白中,具有黏附性的蛋白不一定是已发现的Slp,还可能是MAPP、EF-Tu、EF-G等[21-22]。EF是乳酸菌膜外蛋白,主要有2 个功能:黏附作用以及作为血纤维蛋白溶酶发挥结合蛋白的功能[23-24]。Munro[25]和Palmer[26]等发现EF-G对于Caco-2细胞也有很好的黏附作用。
本课题组前期研究[27]对唾液乳杆菌表面蛋白进行质谱分析发现,EF-G评分最高,且匹配的肽段最多,其中发挥黏附功能可能是EF-G,因此本实验选取EF-G进行研究。本实验结果表明,EF-G在体外能够促进金黄色葡萄球菌的黏附,黏附率较对照组提高了43%;在小鼠肠道内唾液乳杆菌Δef-g组金黄色葡萄球菌黏附率较唾液乳杆菌组降低了20%,结果表明EF-G对金黄色葡萄球菌的黏附具有促进作用,体内外实验结果相差较大,可能是由于小鼠体内环境复杂,也可能是EF-G缺少影响了唾液乳杆菌生物活性,从而减少了金黄色葡萄球菌黏附,扫描电子显微镜结果也进一步证实了这一结论。
本实验结果证明唾液乳杆菌膜外蛋白中确实存在可以促进金黄色葡萄球菌黏附的蛋白,这与王迪[16]的研究结果一致,但是膜外蛋白促进金黄色葡萄球菌黏附的具体机制还不明确,可能是膜外蛋白中存在金黄色葡萄球菌的黏附位点[28],也可能是膜外蛋白通过其他作用力促进了金黄色葡萄球菌黏附[29],促进黏附的具体机制还需进一步探究。
