聚甘油脂肪酸酯结构对姜黄素纳米乳液稳定性及其功能特性的影响
2022-03-30张尚微杨继国徐晓飞
张尚微,杨继国,*,徐晓飞,任 杰
(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.华南协同创新研究院生物活性分子开发与应用创新中心,广东 东莞 221116)
姜黄素是一种从姜黄根茎中提取的多酚化合物,具有多种生物活性,包括抗氧化、抗菌、抗炎和抗癌[1]。大量研究表明姜黄素能够预防和治疗多种疾病,包括癌症、糖尿病、神经退行性疾病、心血管疾病以及自身免疫疾病[2]。然而,姜黄素存在水溶性差、化学不稳定及低口服生物利用度等问题[3],因而限制其在健康食品领域中的应用。为克服这些难题,许多学者把姜黄素包封于纳米乳液,从而提高其水溶性、稳定性和生物可及性[4-6]。
乳化剂是纳米乳液的重要组成,不仅用于形成和稳定纳米乳液,还影响纳米乳液的理化和功能特性[7],因此选择合适的乳化剂对制备具有特定用途的纳米乳液至关重要。聚甘油脂肪酸酯(polyglycerol fatty acid esters,PGFEs)是一种安全高效的非离子表面活性剂,在许多国家和地区被批准为食品添加剂[8],兼具优异的乳化和抗菌特性[9-10],在功能性食品行业具有广阔的应用前景。已有研究报道改变PGFEs的脂肪链长可以影响其抗菌活性和乳化能力。例如,Conley等[11]对比不同脂肪链长的PGFEs对多种致病微生物的抑制作用,发现仅C8~C12链长的PGFEs具有广谱抗菌作用。另一方面,Peng Bin等[10]使用短链、中链和长链PGFEs制备纳米乳液,结果表明只有中链和长链PGFEs能形成稳定的纳米乳液,且长链PGFEs乳液具有最佳的稳定性。此外,Tan等[12]使用聚甘油月桂酸酯(polyglycerol lauric acid esters,PGL)和聚甘油油酸酯包封β-胡萝卜素,放置在12 周后月桂酸酯纳米颗粒中β-胡萝卜素含量高于油酸酯纳米颗粒中β-胡萝卜素含量,说明PGFEs的脂肪酸种类也会对包封的生物活性物质的稳定性产生影响。然而,PGFEs的脂肪链长对包封生物活性物质的纳米乳液的功能特性(比如抗氧化和抗菌活性)产生的影响鲜见报道。
因此,本研究首先采用酶法合成5 种不同脂肪链长(C10~C18)的PGFEs,以PGFEs为乳化剂,进一步构建姜黄素纳米乳液载运体系,并研究PGFEs的脂肪链长如何影响姜黄素纳米乳液的形成、物理化学稳定性、清除自由基活性及抗菌活性,为PGFEs用于包封疏水性生物活性物质提供理论依据。
1 材料与方法
1.1 材料与试剂
甘油、癸酸、月桂酸、豆蔻酸、软脂酸和硬脂酸 上海阿拉丁生化科技有限公司;Novozym 435酶 诺维信(中国)生物技术有限公司;中链甘油三酯(medium chain triglycerides,MCT)、姜黄素(>98%) 西安维特生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH,>96%)、2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS,>98%)、3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT,>98%) 麦克林生物试剂有限公司;金黄色葡萄球菌ATCC25923和大肠杆菌O157:H7 ATCC35150 广东省微生物菌种保存中心;营养肉汤广东环凯微生物科技有限公司;其他常规试剂均为国产分析纯。
1.2 仪器与设备
HH-2型数显恒温水浴锅 金坛市富华仪器有限公司;P680高效液相色谱-蒸发光散射检测器(high performance liquid chromatography-evaporative light scattering detector,HPLC-ELSD) 美国Dionex公司;Ultra Turrax T18高速均质机 德国IKA集团;JNBIO JN-02C高压均质机 广州聚能纳米生物科技有限公司;3K15型高速冷冻离心机 德国Sigma公司;Nano ZS90纳米粒度仪、Zeta电位分析仪 英国Malvern公司;SpectraMax ix3多功能酶标仪 美国Molecular Devices公司;721-100型紫外-可见分光光度计 上海菁华科技仪器有限公司;SQ510C灭菌锅 日本Yamato有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;ZXDP-B2270恒温培养箱 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 PGFEs的酶法合成
参照Peng Bin等[10]的方法,合成并纯化得到平均聚合度为2.82的聚甘油。然后,将纯化的聚甘油和相应的脂肪酸以物质的量比1∶1混合,在质量分数2.0% Novozym 435酶催化下于75 ℃反应10 h,得到PGFEs,并用HPLCELSD对PGFEs的组分进行分析。本研究共合成了5 种 PGFEs,包括聚甘油癸酸酯(polyglycerol capric acid esters,PGC)、PGL、聚甘油豆蔻酸酯(polyglycerol myristic acid esters ,PGM)、聚甘油软脂酸酯(polyglycerol palmitic acid esters,PGP)及聚甘油硬脂酸酯(polyglycerol stearic acid esters,PGS)。
1.3.2 纳米乳液的制备
将不同质量分数的PGFEs分散于磷酸盐缓冲溶液(10 mmol/L,pH 6.5),60 ℃搅拌至PGFEs完全水合。把过量姜黄素粉末分散于MCT,60 ℃避光搅拌2 h后,8 000 r/min离心10 min,吸取上清液,得到姜黄素油。将姜黄素油和PGFEs溶液以质量比5∶95混合,10 000 r/min高速剪切2 min后,进一步转移至高压均质机中,于110 MPa压力下循环5 次,得到姜黄素纳米乳液。
1.3.3 乳液的表征
利用纳米粒度仪和Zeta电位分析仪测定乳液的液滴尺寸和表面电荷。乳液分散相和连续相的折射率分别设定为1.45和1.33。在测试之前,用与乳液相同pH值的磷酸缓冲液将乳液稀释500 倍,以减少光散射的影响。
1.3.4 姜黄素含量的测定
参照Wei Zihao等[13]的方法,并稍作修改。准确吸取100 μL样品,用无水乙醇稀释至合适的浓度,10 000 r/min离心10 min,取200 μL上清液于96 孔板,放置在酶标仪中,于425 nm波长处测定吸光度。以无水乙醇作为空白对照,并建立标准曲线(Y=0.076 1X-0.008 4;R2=0.999 2)对姜黄素含量进行定量分析。纳米乳液中姜黄素的包封效率按式(1)计算:

式中:CNE为乳液中姜黄素的质量浓度/(μg/mL);CT为油中姜黄素的质量浓度/(μg/mL)。
1.3.5 贮存稳定性的测定
取5 mL新鲜的姜黄素纳米乳液于玻璃瓶中,分别于4、30 ℃和50 ℃避光放置28 d。每周测定乳液的粒径和姜黄素的含量,姜黄素保留率按式(2)计算:

式中:Ct为第t天乳液中姜黄素的质量浓度/(μg/mL);C0为第0天乳液中姜黄素的质量浓度/(μg/mL)。
1.3.6 抗氧化活性的测定
1.3.6.1 DPPH自由基清除活性的测定
参考Jin Hua等[4]的方法,并稍加修改。准确称取10 mg DPPH,用无水乙醇定容到500 mL,4 ℃避光保存。将姜黄素纳米乳液进行2 倍梯度稀释,得到稀释度为20、2-1、2-2、2-3和2-4的样品。吸取0.5 mL待测样品与2.5 mL DPPH溶液混合,室温避光反应30 min,于517 nm波长处测定吸光度,并按式(3)计算样品的DPPH自由基清除率。将悬浮在磷酸盐缓冲溶液(10 mmol/L,pH 6.5)中姜黄素作为对照。使用GraphPad Prism 6.00软件计算乳液的自由基清除率的半数抑制浓度(median inhibition concentration,IC50)。IC50值越小,表示样品的自由基清除能力越强。
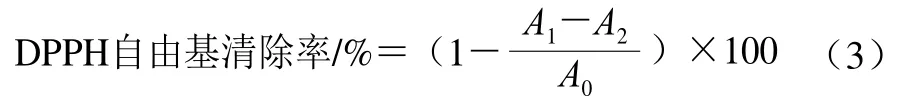
式中:A1为样品与DPPH溶液反应的吸光度;A2为无水乙醇代替DPPH溶液与样品反应的吸光度;A0为无水乙醇代替样品与DPPH溶液反应的吸光度。
1.3.6.2 ABTS阳离子自由基清除活性的测定
参考Jin Hua等[4]的方法,并稍加修改。准确称取0.038 4 g ABTS于10 mL磷酸盐缓冲溶液(10 mmol/L,pH 7.4),再加入0.006 6 g过硫酸钾,避光保存16 h,待用。用无水乙醇将ABTS溶液稀释到一定浓度,使其在734 nm波长处的吸光度为0.7±0.050。将姜黄素纳米乳液进行2 倍梯度稀释,得到稀释度为20、2-1、2-2、2-3和2-4的样品。吸取0.5 mL待测样品与2.5 mL ABTS稀释溶液混合,室温避光反应5 min,于734 nm波长处测定吸光度,并按式(4)计算样品的ABTS阳离子自由基清除率。将悬浮在磷酸盐缓冲溶液(10 mmol/L,pH 6.5)中姜黄素作为对照。使用GraphPad Prism 6.0软件计算乳液的自由基清除率的IC50。

式中:A0为无水乙醇代替样品与ABTS稀释溶液反应的吸光度;A为样品与ABTS稀释溶液反应的吸光度。
1.3.7 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
参照Ye Haiqing等[14]的方法,并稍加修改。使用肉汤微量稀释法测定PGFEs溶液和姜黄素纳米乳液对金黄色葡萄球菌和大肠杆菌的MIC。金黄色葡萄球菌和大肠杆菌分别代表革兰氏阳性菌和革兰氏阴性菌。将甘油管中的细菌悬浊液接种到营养肉汤中,37 ℃活化24 h。通过与McFarland 1号浊度标准进行比较,将细菌接种量调整至1×106CFU/mL。将PGFEs溶液和姜黄素纳米乳液用营养肉汤进行2 倍梯度稀释(从10-1稀释至10-10)。吸取100 μL不同稀释度样品于96 孔板,与100 μL接种量为1×106CFU/mL的细菌培养液混合均匀,于37 ℃孵育24 h。营养肉汤(不接种细菌)和营养肉汤(接种细菌但不加样品)分别作为空白对照和阳性对照。姜黄素纳米乳液身是黄色浑浊的,无法通过肉眼观察液体浑浊程度判断其MIC。因此,在24 h后,加入10 μL质量浓度为5 mg/mL MTT溶液(溶于pH 7.4的磷酸盐缓冲液),37 ℃孵育30 min。活细胞可以将MTT转化为蓝紫色的甲臜产物,而死细胞没有此功能。因此,通过肉眼判断没有蓝紫色产物生成的最低浓度即为MIC。
1.4 数据统计分析
2 结果与分析
2.1 PGFEs的组成成分
如图1所示,C18柱是非极性柱,极性越大的物质,出峰时间越早。因此,PGFEs的出峰时间顺序为单酯、双酯和三酯[15]。PGFEs主要由单酯组成,还含有少量双酯和三酯。随着脂肪链长的减短,PGFEs单酯的比例下降,相应双酯和三酯的比例升高,这可能是因为较短链长脂肪酸的位阻更小,黏度更低,能与聚甘油进行充分混合,进而促进其与聚甘油上的羟基在酶的催化下脱水生成酯键。与本实验结果相似,Peng Bin等[10]使用乙酸、樟树籽油和米糠油制备短链、中链和长链PGFEs,结果表明PGFEs主要由单酯组成,含有少量双酯和三酯。万分龙[16]以Novozym 435为催化剂合成PGFEs,HPLC-ELSD分析表明PGFEs中含有单酯、双酯、三酯和四酯,其中单酯为主要成分。

图1 不同脂肪链长(C10~C18)PGFEs的HPLC图Fig. 1 HPLC chromatograms of PGFEs with different aliphatic chain lengths (C10-C18)
2.2 PGFEs质量分数对乳液形成的影响
乳化剂形成和稳定乳液的能力取决于其分子和理化特性[17]。因此,通过在固定均质条件下绘制粒径与乳化剂浓度的关系图,评估PGFEs的脂肪链长对乳液形成的影响。如图2所示,对于PGFEs乳液,液滴大小最初随着PGFEs质量分数的增加而急剧降低,因为在均质过程中有更多的PGFEs分子快速吸附在液滴表面,从而减少液滴再次聚集[18]。然而,继续增加PGFEs质量分数,乳液粒径会达到一个相对恒定的值,表明液滴表面已完全被PGFEs分子饱和。此时液滴的大小与均质机破碎液滴的能力有关,与PGFEs浓度无关[19]。即使再增加PGFEs质量分数,只会增加水相中游离PGFEs含量,而无法进一步减小乳液的粒径。在后续实验中,使用刚好使液滴表面饱和的PGFEs质量分数(饱和质量分数)制备PGFEs纳米乳液。

图2 PGFEs质量分数对纳米乳液粒径的影响Fig. 2 Effect of PGFEs concentration on the particle size of nanoemulsions
2.3 PGFEs脂肪链长对乳液特性的影响
如表1所示,PGFEs乳液的粒径均小于200 nm且多分散系数(polydispersity index,PDI)小于0.2,表明PGFEs都能形成均匀分布的纳米乳液,这与Peng Bin等[10]报道一致。从图2和表1可得,PGC、PGL、PGM、PGP和PGS的饱和质量分数分别为4%、2%、1%、0.5%和0.5%,对应质量分数下乳液的粒径分别为(97.3±1.0)、(111.7±0.4)、(125.4±0.4)、(141.0±0.6)、(154.0±0.9)nm。一方面,脂肪链长越长的PGFEs能更高效地形成稳定的纳米乳液。另一方面,脂肪链长越短的PGFEs在饱和液滴表面条件下能形成更小的液滴,这可能与较短脂肪链长的PGFEs具有快速吸附动力学有关[20]。然而,Peng Bin等[10]发现与短链和中链PGFEs相比,长链PGFEs能形成更小的液滴。这矛盾结果可能与Peng Bin等[10]使用低质量分数PGFEs(<1.0%)制备乳液有关,在此质量分数下,短链和中链PGFEs未完全覆盖液滴表面,导致在乳液形成过程中液滴再次聚集,因而短链和中链PGFEs乳液具有较大的液滴。
乳液的电荷特性决定了液滴间的静电作用,因而对乳液的稳定性起重要作用。通常,液滴表面电荷越多,乳液表现出更好的长期稳定性[21]。如表1所示,PGFEs乳液均带有负电荷,这与Shu Gaofeng等[22]报道一致。相关研究报道了非离子表面活性剂稳定的纳米乳液均带有负电荷,这可能是由于油相和表面活性剂中含有阴离子杂质(比如,游离脂肪酸),或水相中氢氧根离子吸附到液滴表面所导致的[18]。此外,随着PGFEs脂肪链长的增加,液滴表面的负电荷显著增加(P<0.05),推测脂肪链长越长的PGFEs稳定乳液具有更好的贮存稳定性。
对生物活性物质具有高包封效率是构建有效递送体系的必要条件。如表1所示,PGFEs乳液对姜黄素的包封效率高达95%,且不同脂肪链长的PGFEs乳液间无显著差异(P>0.05)。这说明PGFEs纳米乳液可用于高效包封姜黄素,且包封效率与PGFEs的脂肪链长无关。

表1 PGFEs脂肪链长对纳米乳液特性的影响Table 1 Effect of aliphatic chain length of PGFEs on characteristics of nanoemulsions
2.4 PGFEs脂肪链长对乳液贮存稳定性的影响
作为食品工业的递送体系,纳米乳液需要具有良好的贮存稳定性。贮存温度是影响纳米乳液长期稳定性的重要因素,因此探究PGFEs乳液在4、30 ℃和50 ℃时粒径、粒径分布和PDI时间的变化。从图3可以看出,在4 ℃和30 ℃放置1 个月后,PGFEs乳液的粒径基本保持不变,且PDI小于0.2;而在50 ℃时乳液粒径和PDI随时间延长明显增加。通常,PDI表征乳液粒径分布的均匀性,当PDI<0.2时,纳米乳液被认为是单分布体系[21],与PGFEs乳液粒径分布的变化相对应(图4)。这表明较高的贮存温度会促进液滴的聚集,导致大液滴的生成,与相关文献[19,23]报道一致。在较高温度下,体系的黏度降低和液滴的布朗运动增加,引起液滴更频繁地相互碰撞,进而增加液滴聚集的可能性[19]。另一方面,较高温度会导致表面活性剂极性基团的部分脱水,从而降低了液滴间排斥作用,并最终导致液滴间聚集[19,23]。此外,不同PGFEs乳液在50 ℃时发生不同程度的失稳。如图3和图4所示,在50 ℃条件下PGC乳液的粒径仅稍有增加,且仍保持单分布体系(PDI<0.2);而其他PGFEs乳液的粒径剧烈增加,且从单分布变成多分布体系(PDI>0.2),表明PGC对热所导致的乳液失稳具有较强的抵抗作用。
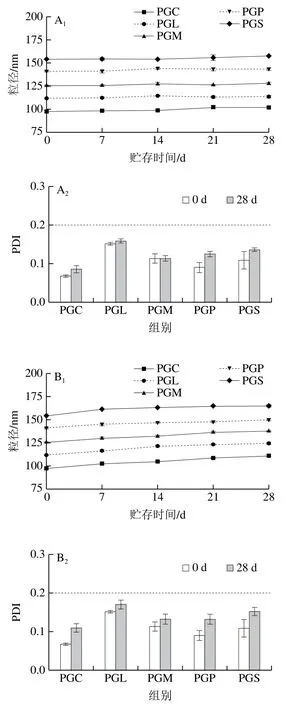
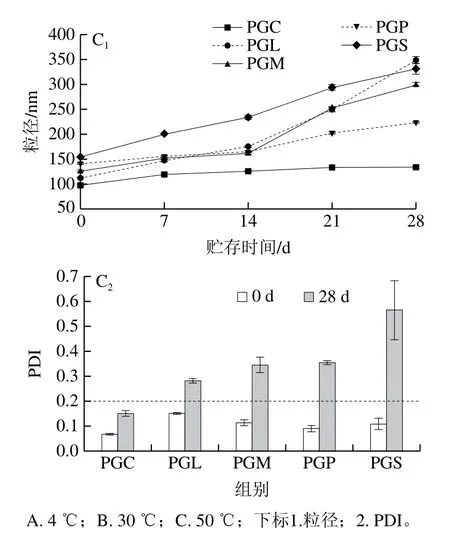
图3 在4、30 ℃和50 ℃时纳米乳液粒径和PDI随时间的变化Fig. 3 Changes in particle size and PDI of nanoemulsions stored at 4,30 and 50 ℃
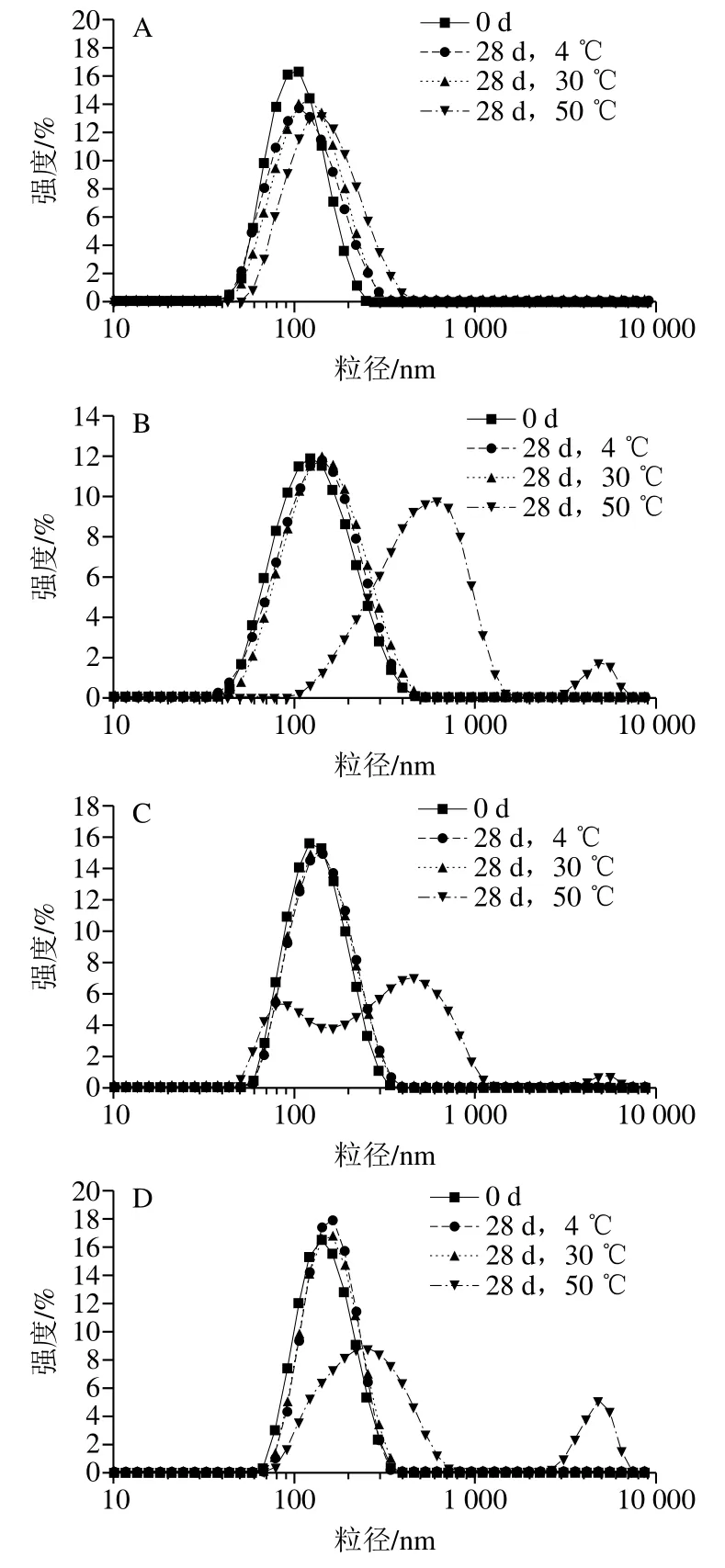

图4 在4、30 ℃和50 ℃放置28 d后纳米乳液粒径分布的变化Fig. 4 Changes in particle size distribution of nanoemulsions after 28 d storage at 4, 30 and 50 ℃
姜黄素受热易分解,因此贮存温度也是影响姜黄素制品化学稳定性的关键因素。近年来,大量研究探索把姜黄素包封在不同材料的纳米颗粒中以减小姜黄素的热降解[4,24]。如图5所示,在4 ℃和30 ℃放置1 个月后,PGFEs乳液中的姜黄素保留率在85%以上;在50 ℃时,PGFEs乳液中的姜黄素含量随时间延长快速下降,表明较高的贮存温度会加速姜黄素的降解。另外,不同PGFEs乳液在50 ℃时具有不同的姜黄素降解速率。于50 ℃放置1 个月后,PGC乳液仍保留约80%的姜黄素,而其他PGFEs乳液中姜黄素的保留率仅为50%~61%。与其他PGFEs乳液相比,PGC乳液在较高的贮存温度时能更好地保护姜黄素。根据PGFEs乳液在贮存过程中的粒径分析,PGC乳液在50 ℃时具有较好的物理稳定性,推测姜黄素的降解不仅与贮存温度有关,还可能与乳液的物理稳定性有关。稳定的乳液结构可以保护姜黄素不受外界环境影响,从而减少姜黄素在贮存过程中的降解[4]。
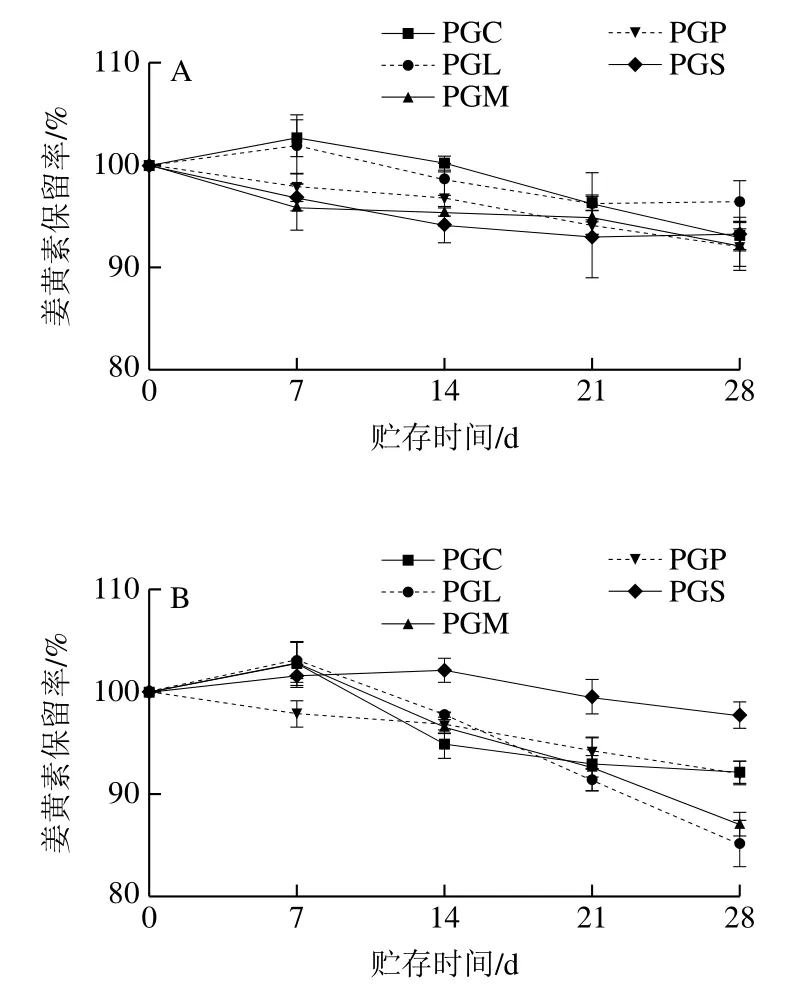
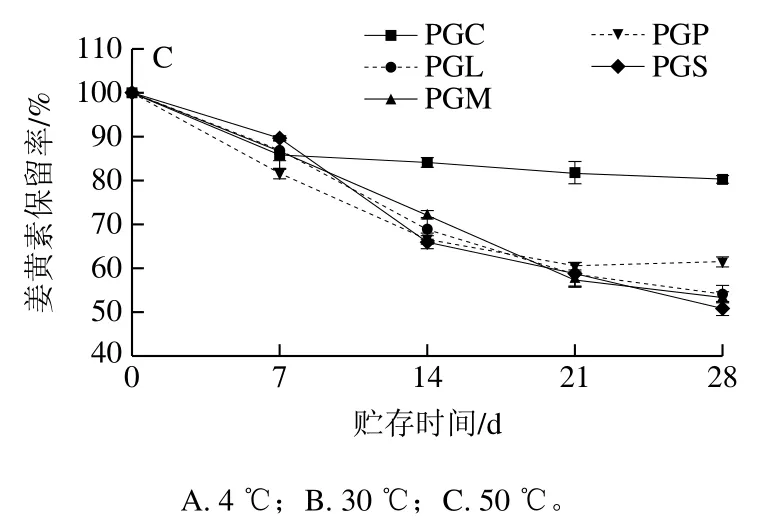
图5 在4、30 ℃和50 ℃时纳米乳液中姜黄素含量随时间的变化Fig. 5 Changes in the percentage of curcumin retained nanoemulsions stored at 4, 30 and 50 ℃
2.5 PGFEs脂肪链长对乳液抗氧化活性的影响
已有研究表明将姜黄素包封在纳米乳液中能改善姜黄素的抗氧化活性[25]。乳化剂的种类和浓度对姜黄素纳米乳液的抗氧化活性有一定影响[18]。因此,通过DPPH自由基清除实验和ABTS阳离子自由基清除实验评估不同脂肪链长的PGFEs对姜黄素纳米乳液的抗氧化活性的影响。PGFEs溶液对DPPH自由基和ABTS阳离子自由基均无清除活性,表明姜黄素纳米乳液的抗氧化活性来源于姜黄素。从图6可以看出,无论是DPPH自由基清除活性和ABTS阳离子自由基清除活性,姜黄素纳米乳液的IC50随着PGFEs脂肪链长的增加而增加。中链PGFEs乳液的IC50显著低于游离姜黄素的IC50(P<0.05),而长链PGFEs乳液的IC50与游离姜黄素的IC50无显著差异(P>0.05)。从表1可以得到,不同PGFEs乳液中姜黄素质量浓度无显著差异(P>0.05),说明姜黄素含量不是导致PGFEs乳液抗氧化活性差异的主要原因,进一步表明中链PGFEs可以提高姜黄素的自由基清除活性。Richards等[26]发现表面活性剂胶束能够将油滴中的抗氧化剂增溶到水相中,使水相中抗氧化剂的浓度增加2.3~7.5 倍,因而提高乳液的抗氧化活性。根据相关文献报道,姜黄素和生育酚纳米乳液的抗氧化活性随着表面活性剂(吐温20)浓度的增加而增加[27-28]。因此,中链PGFEs乳液的较高抗氧化活性可能是因为乳液使用的表面活性剂的质量分数较高(2%~4%),增加姜黄素在水中的分散度,从而提高乳液的抗氧化活性。
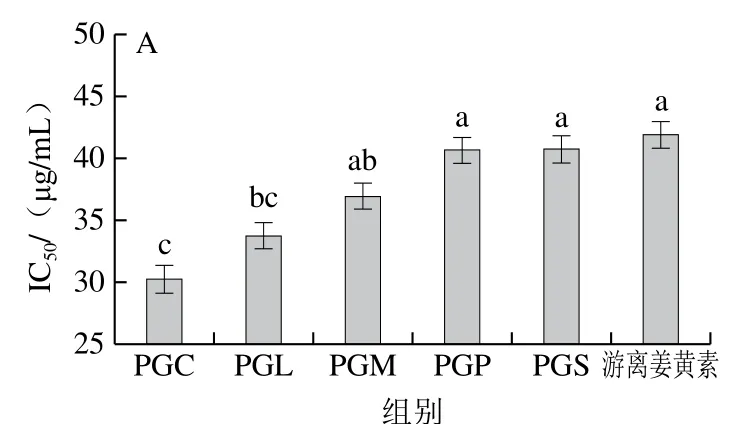

图6 纳米乳液的DPPH自由基清除活性(A)和ABTS阳离子自由基清除活性(B)Fig. 6 DPPH radical-scavenging activity (A) and ABTS radical cationscavenging activity (B) of nanoemulsions
2.6 PGFEs脂肪链长对乳液抗菌活性的影响
MIC是指在肉汤稀释实验中抑制微生物可见生长的最低抗菌剂浓度,MIC值越小,表示抗菌剂的抗菌效果越好[29]。如表2所示,长链PGFEs乳液对金黄色葡萄球菌和大肠杆菌无抗菌作用,而中链PGFEs乳液具有生长抑制效果,且PGC纳米乳液和PGL纳米乳液表现出不同的抗菌活性。PGC纳米乳液对金黄色葡萄球菌和大肠杆菌的MIC分别为0.32 mg/mL和0.63 mg/mL,是PGC溶液MIC的一半;PGL纳米乳液对金黄色葡萄球菌和大肠杆菌的MIC分别是0.63 mg/mL和1.25 mg/mL,与PGL溶液MIC相同。已有研究表明姜黄素抑制金黄色葡萄球菌和大肠杆菌所需质量浓度分别为150 μg/mL和300 μg/mL[30]。由于纳米乳液中姜黄素质量浓度(~80 μg/mL)低于其MIC,单靠姜黄素是无法实现纳米乳液对目标细菌生长的抑制,因此PGFEs乳液对目标细菌的抑制作用还取决于PGFEs自身的抗菌活性。其中,PGC溶液和PGL溶液对目标细菌具有相似的抗菌作用,预期相应的纳米乳液也表现出类似的抗菌活性。然而,本实验中PGC乳液的抗菌活性高于PGC溶液,而PGL乳液的抗菌活性与PGL溶液相似,表明PGC与姜黄素存在协同抗菌效应,而PGL与姜黄素无显著协同作用,这表明中链PGFEs还通过其他作用机制影响纳米乳液的抗菌效果。
已有文献报道,乳化剂可以通过三方面影响抗菌乳液的抗菌作用:1)乳化剂自身是否具有抗菌活性;2)影响包封的抗菌物质在水相的溶解度;3)是否作为目标微生物的营养底物[31-32]。因此,PGC和PGL纳米乳液抗菌活性的差异可能是因为PGC乳液(4%)中表面活性剂质量分数较PGL乳液(2%)高,能将更多的姜黄素增溶至水相中,从而促进姜黄素与细菌细胞膜直接相互作用,进而发挥出更强的抗菌活性。另一种原因可能是,较长碳链的PGL更易被微生物所利用,从而抵消掉PGL纳米乳液的一部分抗菌活性。以前文献也报道了类似的结论,Donsì等[32]使用4 种乳化剂制备精油纳米乳液,结果表明糖酯或吐温20和甘油单油酸酯能提高精油的水相平衡浓度,较短时间显著增强纳米乳液的抗菌活性,而卵磷脂和豌豆蛋白可作为微生物的营养底物,从而抵消掉纳米乳液一部分抗菌活性。
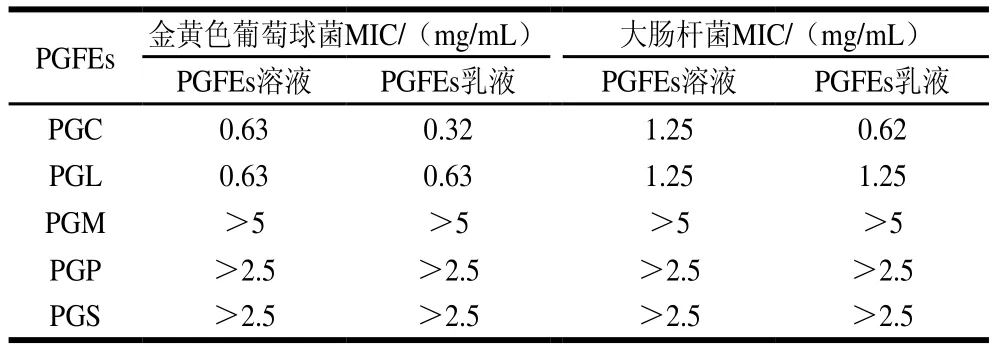
表2 PGFEs溶液和PGFEs纳米乳液对金黄色葡萄球菌和大肠杆菌的MICTable 2 MIC of PGFEs solution and PGFEs-stabilized nanoemulsions against S. aureus and E. coli
3 结 论
本研究以不同脂肪链长(C10~C18)的PGFEs为乳化剂构建姜黄素纳米乳液,并评价其乳液特性、物理化学稳定性及功能特性。PGFEs都能形成均匀分布的纳米乳液以及具有高姜黄素包封效率(约95%)。随着PGFEs的脂肪链长的增加,形成的乳液具有更大的液滴、更低的Zeta电位和相似的姜黄素包封效率。在贮存稳定性方面,PGFEs乳液的物理化学稳定性随着温度升高而降低。相比其他PGFEs,PGC对热引起的乳液失稳和姜黄素降解具有更强的抵抗作用。在功能特性方面,相比长链PGFEs乳液,中链PGFEs乳液既能显著改善姜黄素的抗氧化活性,又对金黄色葡萄球菌和大肠杆菌显示出抗菌效果,且PGC与姜黄素存在协同抗菌作用。因此,中链PGFEs,特别是PGC,可作为构建兼具抗氧化和抗菌活性的纳米乳液的高效食品乳化剂。
