芬顿氧化体系处理对白斑狗鱼肌原纤维蛋白结构和功能特性的影响
2022-03-30邓小蓉雷用东卢士玲
邓小蓉,雷用东,刘 娟,卢士玲,张 建
(石河子大学食品学院,新疆 石河子 832000)
白斑狗鱼(Esox lucius),俗称北梭鱼,是一种适应性强、生长速度快,体型大且寿命长的鱼类,广泛分布于北美、欧洲和亚洲的湖泊、河流和半咸水的沿海水系,对休闲游钓和商业捕鱼非常重要[1]。在中国,白斑狗鱼主要产于新疆阿勒泰地区的额尔齐斯河流域、乌伦古湖及附属水体,因其具有肉味鲜美、营养价值高、无肌间刺、养殖潜力大等特点而备受青睐,已被列为新疆水产业发展的重要土著鱼之一[2]。
在加工和贮藏过程中发生的蛋白氧化是影响肉类品质的重要因素之一[3]。羰基的形成和巯基的减少会进一步破坏蛋白质的结构和功能特性[4-5]。肌肉蛋白,特别是肌原纤维蛋白(myofibrillar protein,MP),易受活性氧的影响[6-7]。引起肉蛋白质氧化损伤的最主要和最有效的活性氧是羟自由基,羟自由基可以通过芬顿反应,由铁离子催化过氧化氢(H2O2)和细胞还原剂产生[8]。芬顿氧化系统(Fe3+、抗坏血酸和不同浓度H2O2)诱导的蛋白质氧化已在食品系统中进行了广泛研究[9-10]。
蛋白的氧化修饰常导致其理化性质变化,从而改变其功能,这些修饰可以参与鲜肉品质的调控,影响肉制品的加工性能[11-12]。然而,蛋白质氧化并不总是导致蛋白质功能的损害。一般来说,过度氧化的蛋白消化率较低,部分原因是蛋白聚集,而轻度氧化蛋白容易被相应的蛋白酶消化[13]。此外,Lu Han等[14]报道显示,一定程度的冷冻贮藏和羟自由基引起的轻度蛋白氧化,可以促进鳙鱼MP的凝胶结构和保水能力。Srinivasan等[15]报道,鳕鱼肉糜暴露于羟自由基生成系统中后表现出更好的凝胶化和乳化特性。Zhang Longteng等[16]的研究结果也表明,轻度氧化修饰(0.1~1 mmol/L H2O2)有利于凝胶形成能力的增强,而强氧化环境(5~10 mmol/L H2O2)则表现为凝胶强度减弱,结构性能降低。
白斑狗鱼肌肉蛋白易受自由基的破坏,在加工和贮藏过程中造成产品质量下降,并可能导致蛋白功能特性的改变。因此,测定不同氧化程度下蛋白质功能的变化,有助于进一步了解白斑狗鱼贮存或加工过程中的氧化修饰。鉴于此,本实验以白斑狗鱼MP为研究对象,采用羟自由基生成系统体外模拟氧化,研究不同氧化程度对MP结构和功能特性的影响,这些结果将对阐明氧化对白斑狗鱼肌肉蛋白质量的影响具有重要意义。
1 材料与方法
1.1 材料与试剂
白斑狗鱼(质量约1.5 kg)购于新疆石河子当地水产市场;去鳞、去内脏、流水冲洗干净,取鱼背部肌肉并切成均匀块状(质量约15 g),置于冰箱(-20 ℃)中备用。
牛血清白蛋白标准品 美国Sigma-Aldrich公司;其他化学试剂均为国产分析纯;实验用水均为超纯水。
1.2 仪器与设备
紫外-可见分光光度计 美国Varian公司;荧光分光光度计 美国Cary公司;Nicolet iS10傅里叶变换红外光谱(Fourier transformed infrared spectroscopy,FTIR)仪美国Thermo Fisher公司;Mini-protein III凝胶电泳仪、ChemiDoc MP凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 MP的提取
参考Deng Xiaorong等[17]的方法,取一定鱼背部肌肉,加入10 倍体积磷酸盐缓冲液A(50 mmol/L Na2HPO4、50 mmol/L NaH2PO4,pH 7.5 ),均质1 min,于4 ℃、8 000×g离心15 min,取上清液,沉淀用磷酸盐缓冲液A再提取一次。向沉淀中加入10 倍体积磷酸盐缓冲液B(50 mmol/L Na2HPO4、50 mmol/L NaH2PO4、0.6 mol/L NaCl,pH 7.5),均质1 min,于4 ℃、8 000×g离心15 min,收集上清液,即为所需MP。采用双缩脲法[18]测定蛋白质量浓度,以牛血清白蛋白为标准品,绘制得到标准曲线方程为:y=0.0253 6x+0.001 72,R2=0.999 57。所得MP溶液存放于-80 ℃冰箱,备用。
1.3.2 MP的氧化
参照Park等[19]的方法制备羟自由基生成系统。将提取的蛋白样品分别溶解在羟自由基生成系统的50 mmol/L pH 6.0磷酸盐缓冲溶液(含0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸、1~20 mmol/L H2O2)中,于4 ℃条件下分别氧化1、3、5 h,然后加入1 mmol/L乙二胺四乙酸以终止氧化。以未氧化MP为对照。
1.3.3 羰基含量的测定
采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)法测定MPs的羰基含量,评估蛋白氧化程度。用磷酸盐缓冲溶液B将MP溶液稀释至2 mg/mL,将1 mL稀释的MP溶液加入到1 mL 10 mmol/L DNPH溶液(用2 mol/L HCl溶液配制)中,室温下暗处静置1 h,每15 min搅拌一次。加入20 g/100 mL三氯乙酸溶液终止反应,8 000×g离心20 min,然后用乙醇-乙酸乙酯(1∶1,V/V)洗涤3 次。所得沉淀溶于3 mL 6 mol/L盐酸胍溶液中。以2 mol/L HCl溶液为对照,于370 nm波长处测定蛋白溶液吸光度。羰基含量以每毫克蛋白所含羰基物质的量表示,单位为nmol/mg,摩尔吸光系数为22 000 L/(mol•cm)[18]。
1.3.4 溶解度的测定
参照Wang Jingyu等[20]的方法并稍作修改。取5 mL 5 mg/mL MP溶液,于4 ℃、8 000×g离心20 min。收集上清液,用双缩脲测定蛋白质量浓度,计算上清液蛋白质量浓度与总蛋白质量浓度的比值,作为MP溶解度。
1.3.5 浊度的测定
参考Xia Xiufang等[21]的方法,取5 mL 1 mg/mL MP溶液(用磷酸盐缓冲液B配制)分别于30、40、50、60、70、80 ℃水浴中加热30 min。冷却静置1 h后,测定600 nm波长处溶液吸光度。浊度以A600nm表示。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
分别使用5%浓缩胶和12%分离胶进行SDS-PAGE分析。每个泳道中装入10 µL 1 mg/mL样品溶液,浓缩胶和分离胶的电压分别为70 V和110 V。电泳后用考马斯亮蓝染色,脱色后使用凝胶成像仪扫描成像。
1.3.7 FTIR分析
参照Kang Dacheng等[22]的方法进行样品预处理。将1 mg冻干蛋白样品与100 mg KBr混合研磨并压成小片。用FTIR仪在室温下扫描,扫描范围400~4 000 cm-1。用Peak fit 4.0软件采用高斯峰拟合算法分析MP二级结构。
1.3.8 起泡性及泡沫稳定性的测定
参照Motoi等[23]的方法。将10 mL 5 mg/mL的MP溶液(V0)放入50 mL塑料量筒中,在25 ℃条件下1 800 r/min搅拌1 min,立即读取泡沫体积,记为V1/mL。静置1 h后测量量筒内泡沫体积,记为Vt/mL。起泡性(Fc)和泡沫稳定性(Fs)分别按式(1)、(2)计算:

1.3.9 乳化性能的测定
采用Pearce等[24]的方法,将纯大豆油和5 mg/mL MP溶液按体积比1∶4加入50 mL离心管中,混合均匀。分别在第0分钟和第10分钟时取管底部0.5 cm处乳液50 μL,并分散到5 mL 0.1% SDS溶液中,在500 nm波长处测定乳液吸光度,以0.1% SDS溶液作为空白。乳化性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)分别按式(3)、(4)计算:

式中:ρ为MP质量浓度/(g/mL);φ为油相体积分数(20%);L为比色杯光程(1 cm);A1和A2分别表示第0分钟和第10分钟时乳液的吸光度。
1.4 数据处理与分析
采用Origin软件进行数据处理,采用SPSS软件进行分析,所有实验均重复3 次,结果以表示,个体均值之间的差异采用Duncan多重检验(P<0.05)。
2 结果与分析
2.1 氧化对白斑狗鱼MP羰基含量的影响

图1 氧化后MP羰基含量的变化Fig. 1 Changes in carbonyl group content of MP after oxidation
蛋白氧化可将一些氨基酸残基转换成羰基衍生物,羰基水平已被广泛用作蛋白氧化损伤的标志[25]。如图1所示,与对照组相比,MP羰基含量随着氧化程度的增加显著增加(P<0.05)。在不同H2O2浓度下氧化5 h后,羰基含量较对照组分别增加了15.92%、25.84%、29.33%、31.42%和34.50%。H2O2浓度为1~15 mmol/L,在氧化处理0~3 h内,MP羰基含量显著增加(P<0.05);随着氧化时间进一步延长(3~5 h),羰基含量略有增加,差异不显著(P>0.05)。羰基含量是蛋白质氧化程度的重要指标之一。MP羰基含量的增加可归因于某些氨基酸残基向羰基衍生物的转化,或氧化诱导的肽断裂[26]。有研究表明,随着羰基含量增加,蛋白质对热聚集的敏感性增加,从而导致MP结构和流变性能改变[27]。Li Yanqing等[28]也报道MP结构和功能随氧化程度的增加而发生改变。
2.2 氧化对白斑狗鱼MP聚集性的影响
2.2.1 MP溶解度的变化

图2 氧化后MP溶解度的变化Fig. 2 Changes in protein solubility index of MP after oxidation
溶解度是测定蛋白变性和聚集最实用的方法,是衡量蛋白质功能的一个很好的指标[29]。由图2可知,氧化处理后白斑狗鱼MP溶解度显著降低(P<0.05),在鸡肉[30]和猪肉MP[31]中也报道了类似结果。相同氧化时间下,MP溶解度随H2O2浓度的增加显著降低(P<0.05),在低浓度氧化条件下(1~5 mmol/L H2O2),溶解度下降幅度相对较小;随着氧化剂浓度的进一步增加(10~20 mmol/L H2O2),溶解度下降明显,在20 mmol/L H2O2、氧化5 h处理后,MP溶解度与对照组相比下降了72.19%。氧化处理后MP溶解度的降低可能是由于蛋白质分子构象发生变化形成了不溶性聚集体,氧化程度越高,溶解度越低,这可能是由于高氧化程度会导致蛋白质变性和沉淀,从而导致溶解度降低[32,33]。
2.2.2 MP浊度的变化

表1 氧化3 h后MP浊度的变化Table 1 Changes in MP turbidity after 3 h oxidation
浊度水平变化用于监测白斑狗鱼MP的聚集,MP聚集体的形成会导致溶液光密度的增加[28]。如表1所示,随着氧化水平的增加和温度的升高,MP浊度出现不同程度增加。不同温度下,MP在低浓度氧化条件下(1~5 mmol/L H2O2)的浊度变化程度相对较小,高浓度氧化条件下(10~20 mmol/L H2O2),MP浊度变化明显。随着温度的升高,特别是大于50 ℃条件下,MP浊度增加程度随着H2O2浓度增加而增加。结果表明,较高的氧化程度促使蛋白产生更多的聚集,这与3 种不同氧化体系(FeCl3、CuSO4或马骨骼肌肌红蛋白与2.5 mmol/L H2O2组合)氧化猪背长肌MP蛋白的结果相似[9]。Parkington等[34]也报道了类似结果,随蛋白羰基含量的增加,牛心肌肉糜中肌球蛋白聚集增加。许多功能特性受到不同蛋白之间相互作用的影响,因此,过度氧化导致的蛋白聚集可能会对肉类食品品质产生负面影响[35]。
2.3 氧化对白斑狗鱼MP构象的影响
2.3.1 SDS-PAGE分析

图3 氧化3 h后MP的非还原和还原SDS-PAGE图Fig. 3 Non-reduced and reduced SDS-PAGE patterns of MP after 3 h oxidation
对不同H2O2浓度、氧化3 h的MP进行非还原(添加β-巯基乙醇(β-mercaptoethanol,β-ME))和还原(不添加β-ME)进行SDS-PAGE分析,观察由氧化引起的蛋白质之间的分子内和分子间交联。如图3所示,清晰可见具有高强度的肌球蛋白重链(>200 kDa)和肌动蛋白(45 kDa)条带,以及其他一些相对较低强度的蛋白条带。还原SDS-PAGE图显示,氧化组和对照组的所有条带强度都没有明显差异,然而非还原SDS-PAGE图显示,肌球蛋白重链1的条带强度变浅,特别是H2O2浓度为10 mmol/L和20 mmol/L时,此条带基本消失。肌联蛋白和伴肌动蛋白、肌球蛋白重链7、肌动蛋白、条带1和条带2也观察到了类似结果。此外,还观察到非还原SDS-PAGE图顶部有一些蛋白质聚集。肌球蛋白是MP中最丰富的蛋白质,易受活性氧的影响,包括脂质自由基、脂质氢过氧化物、铁或铜/抗坏血酸/H2O2和肌红蛋白/H2O2,当受到氧化时,肌球蛋白会形成大的不溶性聚集体[36]。也有报道指出,由于羟自由基氧化,肌球蛋白灰度值降低[37-38]。羟自由基通过二硫键或其他相互作用引起蛋白交联,当H2O2浓度较高时,交联更明显[14]。结果表明,羟自由基氧化诱导了MP的二硫键交联,并形成了蛋白聚集体。
2.3.2 FTIR图谱分析

图4 氧化3 h后MP的FTIR图谱Fig. 4 FTIR spectra of MP after 3 h oxidation
如图4所示,与对照组相比,1 mmol/L H2O2氧化处理3 h使MP的FTIR各峰上移,H2O2浓度增加到10 mmol/L,图谱中各峰几乎与对照组重合,而H2O2浓度20 mmol/L MP的各峰下移。所有样品在3 300 cm-1附近均显示出一条宽而强的谱带,此谱带与酰胺A的—NH—和—OH拉伸振动有关;经不同浓度H2O2处理后该峰从3 300.47 cm-1分别略微左移至3 302.33(1 mmol/L)、3 302.78 cm-1(10 mmol/L)和3 393.24 cm-1(20 mmol/L)处,表明过度氧化引起MP中的分子间作用力发生变化[39]。1 655.42 cm-1和1 540.55 cm-1处的2 个峰为典型的蛋白谱带,分别与酰胺I带(—CO—拉伸和—CN拉伸)和酰胺II带(—NH弯曲、—CN拉伸和C=C拉伸)有关[40]。氧化后随着H2O2浓度增加,2 个峰均向较低波数处移动,这可能是由于包括NH2在内的功能性官能团的丢失[41]。
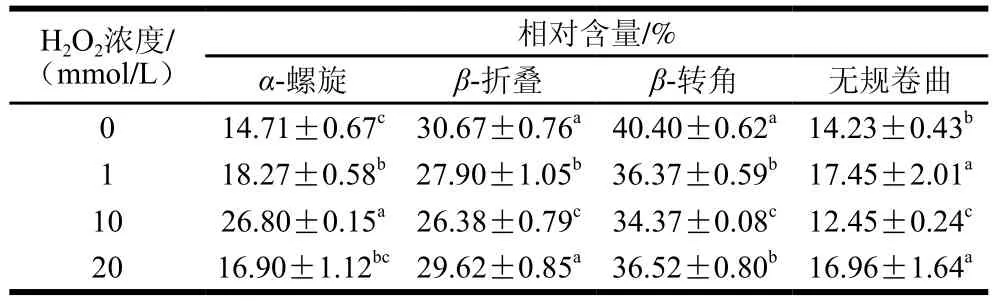
表2 氧化3 h后MP二级结构的变化Table 2 Secondary structure changes in MP after 3 h oxidation
由于酰胺I带(1 700~1 600 cm-1)主要是基于酰胺基的—CO—伸缩振动(约80%),因此可用于测定蛋白质的二级结构[42]。如表2所示,H2O2浓度0~10 mmol/L,随着H2O2浓度的增加,α-螺旋结构相对含量显著增加,β-折叠和β-转角相对含量逐渐减少,无规卷曲则相对含量在1 mmol/L时达到最大后下降。一般来说,α-螺旋结构由肽链内的氢键稳定,而β-折叠结构依赖于肽链间的氢键[43],β-转角归因于高度有序结构,而无规卷曲主要来自高阶结构的展开和相关蛋白的灵活性[44-45]。这些结果表明,羟自由基氧化导致部分有序结构(如β-转角)向α-螺旋转变,表明分子间作用力减弱,同时β-折叠相对含量的减少可能是由于蛋白-蛋白相互作用的减少导致分子间β-折叠结构的破坏[46-47]。当氧化剂浓度进一步增加至20 mmol/L,与H2O2浓度10 mmol/L相比,α-螺旋相对含量显著减少,β-折叠、β-转角和无规卷曲结构相对含量显著增加(P<0.05),表明α-螺旋展开,形成β-折叠、β-转角和无规卷曲。Sun Weizheng等[48]报道,经氧化剂处理后,猪肌肉蛋白的二级结构发生变化,α-螺旋减少,β-折叠结构增加;Liu Qian等[49]发现,大豆分离蛋白经羟自由基氧化修饰后α-螺旋和β-转角结构减少,β-折叠和无规卷曲结构增加。这些结果与本实验结果有所不同,可能是由于蛋白来源不同。
2.4 氧化对白斑狗鱼MP功能特性的影响
2.4.1 起泡性及泡沫稳定性的变化
如图5A所示,与对照组相比,氧化可显著增加MP的起泡性(P<0.05),特别是在中度氧化(5、10 mmol/L H2O2)条件下,MP起泡性最佳,且随着氧化时间的延长起泡性增强(P<0.05)。随着H2O2浓度的进一步增加,MP的起泡性又有所降低,但氧化MP的起泡性仍高于对照组。MP泡沫稳定性变化程度较小(图5B),特别是在1~10 mmol/L H2O2氧化后,泡沫稳定性仍能保持在88%以上。Kong Baohua等[50]在乳清分离蛋白的起泡性研究中也得到类似结果,5 mmol/L H2O2氧化5 h,乳清分离蛋白起泡活性较未氧化时显著改善(P<0.05)。Li Junsheng等[51]也报道适度氧化可以增加大豆分离蛋白的起泡能力,但是过度氧化会降低起泡能力,但对泡沫稳定性没有显著影响。结果表明,氧化可提高MP的起泡能力,而过度氧化(15、20 mmol/L H2O2)会形成较大的聚集体,从而导致MP的起泡能力有所下降。
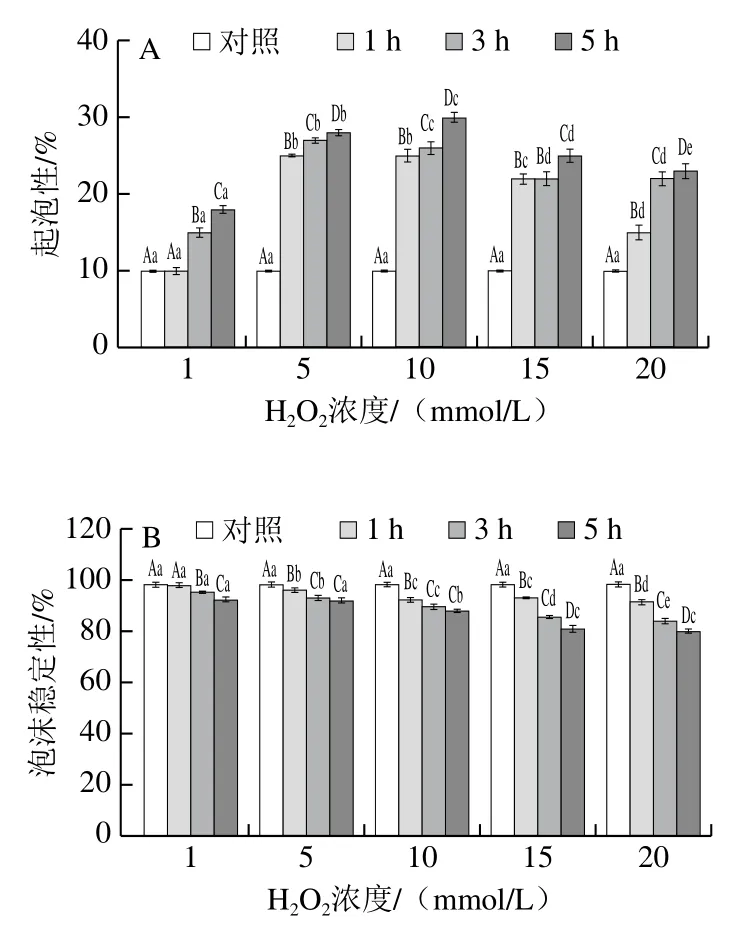
图5 氧化后MP起泡性(A)和泡沫稳定性(B)的变化Fig. 5 Changes in foaming activity (A) and foam stability (B) of MP after oxidation
2.4.2 EAI及ESI的变化
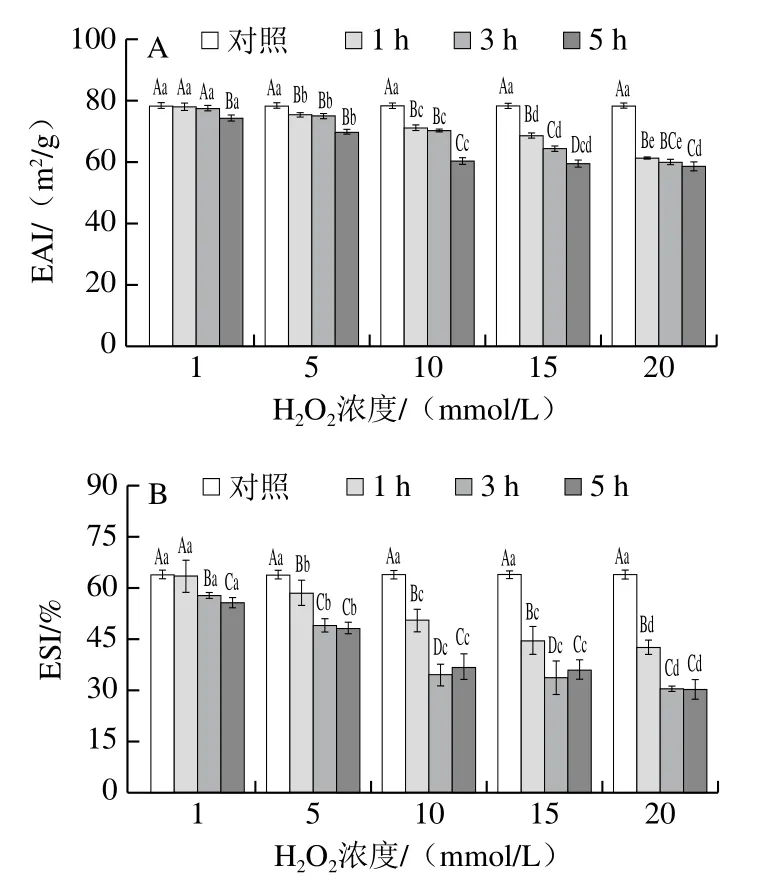
图6 氧化后MP乳化性(A)和乳化稳定性(B)的变化Fig. 6 Changes in emulsifying activity (A) and emulsion stability (B) of MP after oxidation
如图6A所示,与对照组相比,1.0 mmol/L和5.0 mmol/L H2O2氧化后MP的EAI降低程度较小;随着H2O2浓度的增加,MP乳化性降低程度明显增大(P<0.05)。此外,氧化3、5 h与氧化1 h相比,MP的ESI显著降低(图6B,P<0.05)。这些结果与Li Qin等[28]报道的研究结果相似。过度的氧化环境会引起蛋白质的构象变化并形成交联[5],肌肉发生氧化损伤[25],影响其水分状态和乳化特性。
3 结 论
氧化使白斑狗鱼MP羰基含量增加,促进MP交联,形成蛋白聚集体并引起MP构象的变化;适度的氧化处理显著提高了白斑狗鱼MP的起泡性(P<0.05),对泡沫稳定性影响极低;然而氧化降低了MP蛋白乳化性能,特别是H2O2浓度超过10 mmol/L时,MP的乳化性能明显降低。本研究结果表明适度氧化可改善白斑狗鱼肌肉蛋白的功能特性。
