鸭干扰素诱导的跨膜蛋白抑制基因3型鸭甲型肝炎病毒的增殖
2022-03-30王一丹陈弟诗张焕容任玉鹏
王一丹,陈弟诗,向 华,张焕容,任玉鹏*
(1.西南民族大学畜牧兽医学院,成都 610041;2.四川省动物疫病预防控制中心,成都 610041)
鸭甲型肝炎病毒(duck hepatitis A virus, DHAV)是小RNA病毒科家族成员,以引起鸭肝肿大、弥漫性出血和坏死为主要特征,对3周龄内雏鸭易感性和致死率最高,也是目前OIE规定需要法定报告的疾病之一[1]。根据DHAV的基因序列特征和遗传进化分析,可将DHAV分为DHAV-1、DHAV-2和DHAV-3三个亚型,其中DHAV-3型首次发现于韩国[2]。据调查,在2010-2015年,我国辽宁、山东、浙江、江苏、福建、广西、湖北和四川等多省来源样本中,DHAV-1和DHAV-3总阳性率高达91.4%(320/350);而2013年后的流行毒株以DHAV-3为主(占比达57.1%)[3]。当前对DHAV的防控主要依赖于对母鸭开产前的免疫接种和出壳雏鸭卵黄抗体注射,但现有商品化的疫苗或抗体仅针对DHAV-1,对DHAV-3感染的保护效果不佳[4],这使得养殖场鸭群一旦暴发病毒性肝炎将遭受经济损失。因此,对DHAV-3新型有效防治方法的研究具有必要性。
干扰素诱导的跨膜蛋白(interferon-induced transmembrane proteins, IFITMs)是近年来发现的位于多种组织细胞膜中,由膜蛋白受体CD225基因家族编码的具有免疫调节和广谱抗病毒效应的蛋白家族[5]。IFITMs主要由机体免疫系统在病原模式分子刺激下产生的Ⅰ型干扰素通过JASK-STAT信号通路诱导产生[6]。已有研究表明,IFITMs可抑制正黏病毒、副黏病毒(如禽流感病毒)的复制[7],阻止丝状病毒和冠状病毒(如COVID-19)的吸附入侵,抑制黄病毒的膜融合和内吞作用[8]。此外,IFITMs对口蹄疫病毒和柯萨奇病毒等[9]小RNA病毒的复制也具有类似的抑制作用。因此,IFITMs有望成为一类新型、高效的抗病毒药物。但目前国内外关于duIFITMs 是否对DHAV也具有抑制作用尚不清楚,因而深入探讨duIFITMs对DHAV-3感染的抑制作用和揭示其分子机制可以为duIFITMs成为一种新型有效的抗病毒分子奠定理论基础。
本研究以DHAV-3毒株对 3日龄 SPF雏鸭攻毒,通过对雏鸭肝组织中mRNA进行高通量测序分析,并结合Real-time PCR检测duIFITMs的表达水平变化,筛选出可能具有抗病毒作用的duIFITM家族成员,进一步在DELC中验证其对DHAV-3的抑制作用,为DHAV新型防治药物的研发奠定基础。
1 材料与方法
1.1 动物和毒株
用于攻毒的3日龄雏鸭由SPF樱桃谷鸭胚孵化,购自中国农业科学院哈尔滨兽医研究所,并在西南民族大学动物医学实验室动物房饲养至适龄。DHAV-3 SWUNC4 株(TCID50: 10-5.34·0.2 mL-1)由西南民族大学动物医学实验室分离、保存[10]。
1.2 主要试剂材料
PrimescriptTM反转录试剂盒、限制性内切酶HindⅢ、SacⅡ和pEGFP-N1购自宝生物工程(大连)有限公司;Gel Extraction Kit和Endo-Free Plasmid Mini Kit I购自美国Omega Bio-Tek 公司;Applied BiosystemsTMPowerTMSYBRTMGreen预混液和PageRulerTMPrestained Protein Ladder 购自赛默飞世尔科技(中国)有限公司;FuGENE® HD Transfection Reagent 购自美国 Roche Applied Science 公司;Anti-GAPDH Monoclonal Antibody 购自艾美捷科技有限公司;辣根过氧化物酶标记的山羊抗鼠 IgG 购自安诺伦(北京)生物科技有限公司;鼠抗 duIFITM1 由西南民族大学动物医学实验室制备并保存。
1.3 动物分组及攻毒
将3日龄雏鸭按每组9羽随机分成攻毒组和对照组。将经过0.22 μm滤器处理后的 DHAV-3 SWUNC4 株病毒尿囊液稀释至100 TCID50,按每羽 200 μL剂量由胸部多点肌肉注射方式攻毒。分别于感染后12、24和36 h剖杀攻毒组和对照组雏鸭各3只,无菌采集肝组织块,并立即浸泡在液氮中迅速冷冻,再转入DEPC处理且灭菌EP管,转入-80 ℃冰箱备后续研究使用。
1.4 基于RNA-Seq技术的转录组测序分析
以Trizol regeant法提取肝组织样本中的总RNA。用核酸蛋白仪 Nanodrop 2000 测定并计算提取的核酸的OD260 nm/OD280 nm比值,验证RNA样品纯度和完整性。分别将感染DHAV-3 12、24 h雏鸭肝的RNA样本送深圳华大基因科技有限公司,用Illumina MiseqTM2000技术平台对样本进行转录组测序。
用Albacore软件将通过RNA-seq技术得到的测序数据转化和处理;用Soapnuke软件以默认参数对获取片段碱基组成和质量分析以确定原始数据的质量,滤除reads中的测序接头和低质量碱基,获得clean reads用于信息分析。与参考基因组进行比对和分析。用NOISeq统计差异表达基因。并设置阈值log2fold change≥-1或>1,probability>0.8 得到样本之间的表达差异基因。GO富集分析和差异基因的KEGG pathway分析采用超几何检验和FDR矫正,FDR<0.05被认为属于显著富集,使用Omicshare在线分析绘图。根据pathway分析结果,重点筛选出免疫与炎症相关通路上的基因。用Cytoscap软件对所有的候选基因进行pathway富集和图形化分析。
1.5 差异表达基因的荧光定量PCR验证
根据转录组数据处理和生物信息学分析结果,筛选与雏鸭抗病毒免疫和炎症反应相关分子(IFN-α、IFN-β、RIG-I、MDA5、IFITM1、IFITM5、IRF1、IRF3、IL-8和IL-10等)。用 Real-time PCR法分别对攻毒后12、24和36 h肝组织样本中相关分子的mRNA含量进行验证。所用引物都参考GenBank上登录的绿头鸭相关基因序列,利用 oligo 7软件设计筛选,并以GAPDH基因作内参,详细信息见表1。

表1 荧光定量PCR验证所用引物信息
Real-time PCR反应体系:2×SYBR Green I PCR Mix 8 μL,上下游引物(10 μmol·L-1)各1 μL,cDNA 模板 1 μL,ddH2O 5 μL;反应条件:95 ℃ 2 min;94 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s,40个循环。并根据GAPDH基因扩增结果的Ct值计算2-△△Ct值,分析基因表达的倍数差异,同时结合转录组测序比较分析。
1.6 pEGFP-duIFITM1在DELC 中的过表达
根据NCBI上绿头鸭 IFITM1(AnasplatyrhynchosIFIM1, duIFITM1)cDNA序列作为参考(Accession number: NM_001310823.1),在基因两端引入HindⅢ和SacⅡ限制性内切酶识别位点和 Kozak 序列(GCCACC),由武汉金开瑞生物工程有限公司进行基因合成,片段大小为 450 bp,预测其表达蛋白大小约 15.8 ku。合成的基因连入 pMD19-T,并测序验证其正确性。分别对 pMD19-T-duIFITM1 和 pEGFP-N1 载体进行双酶切验证,反应体系均为质粒 8 μL,HindⅢ 1.5 μL,SacⅡ 1 μL,1.5×T+BSA Buffer 33 μL,ddH2O 6.5 μL,总体积 50 μL。将目的基因亚克隆至pEGFP-N1载体,构建pEGFP-duIFITM1重组质粒,并测序验证其正确性。
按照OMEGA公司的Endo-Free质粒提取试剂盒相关指南提取重组质粒。用 FuGENE® HD Transfection Reagent 脂质体转染试剂盒将pEGFP和pEGFP-duIFITM1分别转入生长良好,密度约80%的DELC单层细胞,每个试验组设三个重复,同时将脂质体直接加入细胞孔作对照。转染前测定质粒浓度,将2 μg(200~400 ng·μL-1)质粒样本同 100 μL DMEM 混匀;用无菌Hank’s 液漂洗细胞数次,按2∶5比例,把脂质体与质粒混匀感作20 min,按100 μL·孔-1缓慢加入细胞培养板;培养 5~6 h后将培养基更换为含10%小牛血清的无抗生素DMEM;转染 24~48 h 后通过倒置荧光显微镜观察细胞孔中的荧光。用MTT法检测过表达duIFITM1对DELC细胞活力的影响。
1.7 siRNA干扰 DELC中 duIFITM1的表达
用生长至80%的DELC细胞进行转染,按照FuGENE® HD Transfection Reagent说明书进行操作,将转染试剂与siRNA按照 3∶2比例混合,以Opti-MEM 培养基补足至体积55 μL,同时设置空白对照组。以上溶液轻轻混匀,室温放置15 min,将脂质体/siRNA复合体加入各细胞孔内,放入37 ℃ 5% CO2培养箱中培养48 h后,收集细胞,利用 Real-time PCR检测duIFITM1蛋白的mRNA表达水平,筛选有效的siRNA干扰片段。duIFITM1-siRNA序列由InvitrogenTM公司合成,序列见表2。通过MTT法测定siRNA 干扰对DELC细胞活力的影响。

表2 duIFITM1基因的siRNA序列
1.8 荧光定量PCR验证DELC中duIFITM1转录情况
用 Real-time PCR 分别对转染过表达质粒和siRNA 48 h的DELC 中,duIFITM1 mRNA 进行检测,验证其转录情况,所用引物和反应条件同“1.5”。
1.9 Western blot验证DELC中duIFITM1表达情况
将转染48 h的DELC用无菌PBS漂洗3次,加入RIPA裂解液作用5 min;用橡胶刮刀把瓶壁细胞刮落;将细胞悬液冰浴30 min;离心收集上清液,用BCA蛋白质定量试剂盒测定浓度和确定上样量为 50 μg·孔-1。将待测样本进行SDS-PAGE电泳后转入PVDF膜上,用5%的脱脂奶封闭3 h;用TBST 洗涤3次;分别用鼠抗 duIFITM1(1∶400)和鼠抗 GADPH(1∶2 000)作为一抗,4 ℃孵育过夜;再次TBST漂洗后,加入HRP标记的二抗羊抗鼠 IgG(1∶2 000),室温孵育30 min,用 TBST清洗4次,用 ECL试剂显色成像。
1.10 duIFITM1过表达和敲减对DELC中DHAV-3增殖的影响
按前述试验方法和条件将pEGFP-duIFITM1和duIFITM-siRNA分别转染 DELC 细胞,转染24 h弃去DMEM,用Hanks 液清洗2次,按100 TCID50接种DHAV-3 SWUNC4 株感作1 h后弃去病毒液,并用 Hanks 液清洗3次,加入维持液放入CO2培养箱连续观察。分别收集接毒后24、36、48和60 h的DELC样本并抽提 RNA。参考文献中的Taqman荧光定量方法[11]检测各时间点样本中病毒拷贝数。同时,分别测定 48和60 h的duIFITM1过表达和敲减组样本中 DHAV-3 的 TCID50以确定病毒滴度。将DELC细胞按104每孔铺于96孔板中,培养24 h。将DHAV-3用DMEM按10倍倍比稀释法稀释(10-2~10-9),各稀释度按 0.2 mL·孔-1接入微孔板中,以Reed-Muench法计算TCID50。
2 结 果
2.1 测序结果与参考基因组的比对
对转录组测序数据过滤处理后,总共得到300 M reads。通过将clean reads定位到北京鸭基因组之后,发现基因组的比对率为68.22%~78.24%;其中,unique 比对率为53.90%~61.25%(表3)。此外根据统计,所有reads的基因比对率为42.64%~49.38%。根据基因区的比对结果,作者通过RESM软件进行了基因的定量处理,标准化方法采用FPKM,总共检测出14 175个编码基因具有表达,其中,13 279~13 597个基因在单样本中都有表达。
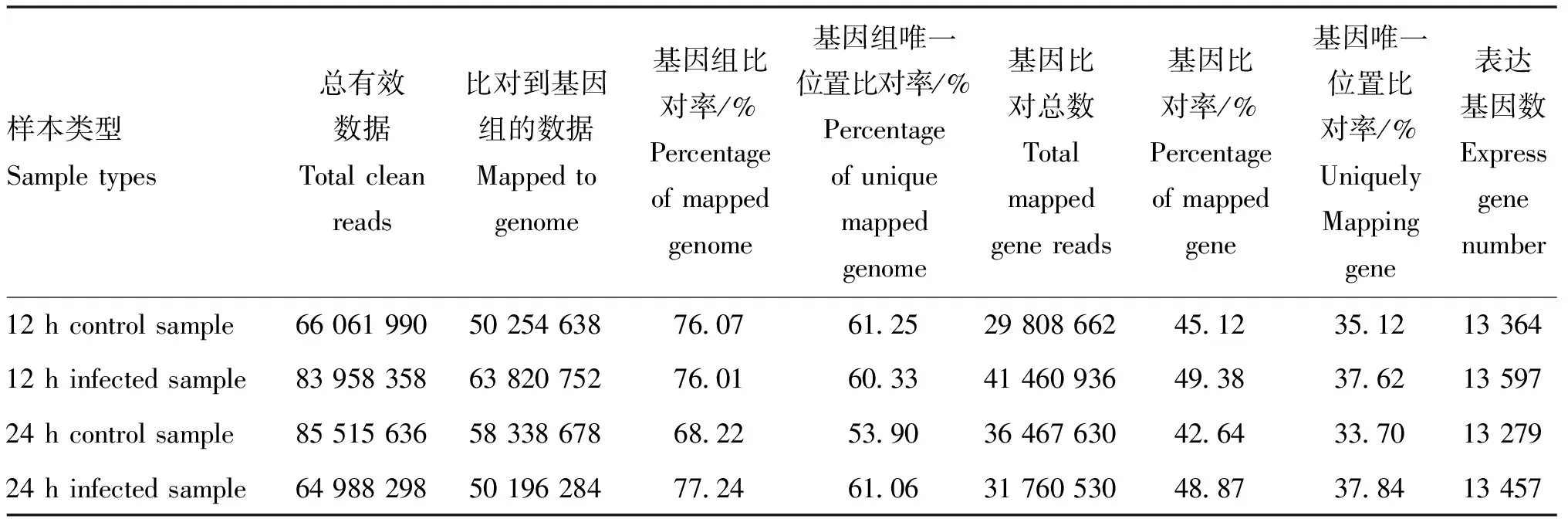
表3 转录组测序结果和参考基因的比对
2.2 差异表达基因的pathway分析
对各时间点表达水平有显著差异的基因进一步作 KEGG pathway 富集分析(图1)。其中,感染 DHAV-3 后12 和24 h 雏鸭肝中的差异表达基因相关通路数量分别为250和195条,两个时间点样本中显著富集的通路分别为54和20条(FDR<0.05)。此外12 h富集的通路主要集中在TNF 信号通路、NF-κB 信号通路、细胞因子互作、A型流感相关通路和TLRs相关通路等。感染24 h样本中差异表达基因则主要富集在A型流感相关通路、氧化磷酸化过程、趋化因子相关信号通路、NF-κB 信号通路、RLRs相关通路、JAK-STAT 信号通路和TLRs相关通路等。根据KEGG pathway富集分析结果进一步分析抗病毒免疫反应和炎症反应相关分子,从感染12和24 h表达差异基因中分别筛选出147个和64个关键基因。其中,duIFIITM1 和duIFITM5在12 h的log2FC值分别为5.452 669 1(P<0.05)和 3.921 245 889(P<0.05), 在24 h的log2FC值分别为10.464 801(P<0.05)和 1.793 824,这提示duIFIITM 可能在雏鸭早期感染DHAV-3过程中发挥重要作用。
2.3 抗DHAV-3感染免疫相关分子的Real-time PCR验证
通过对duIFITM1和duIFITM5两个家族成员的real-time PCR验证结果分析发现,duIFITM1在DHAV-3感染后的24和36 h分别达到对照组的4.42倍和7.14倍(P<0.01),但 duIFITM5 的水平变化并不明显。另外,对其他感染与免疫相关细胞因子的 Real-time PCR 法检测结果与RNA-seq技术检测分析结果基本相符(图2)。对上述关键分子的进一步分析发现,在 DHAV-3 感染后的 12~24 h 与小RNA病毒识别相关的部分 PPRs 表达水平未发生显著变化,如:RIG-I 和MDA5在 DHAV-3感染后的12和24 h样本中始终保持在较低水平的表达,且与对照组无显著差异,但在36 h后mRNA水平迅速上调到 4.23 倍(P<0.01)和3.61 倍(P<0.05);对两种Ⅰ型干扰素的检测也发现,IFN-α 和 IFN-β 在12和24 h的表达量与对照组相比无显著差异,直至 36 h 才分别达到对照组的 5.37 倍(P<0.01)和 2.45倍(P<0.05)。
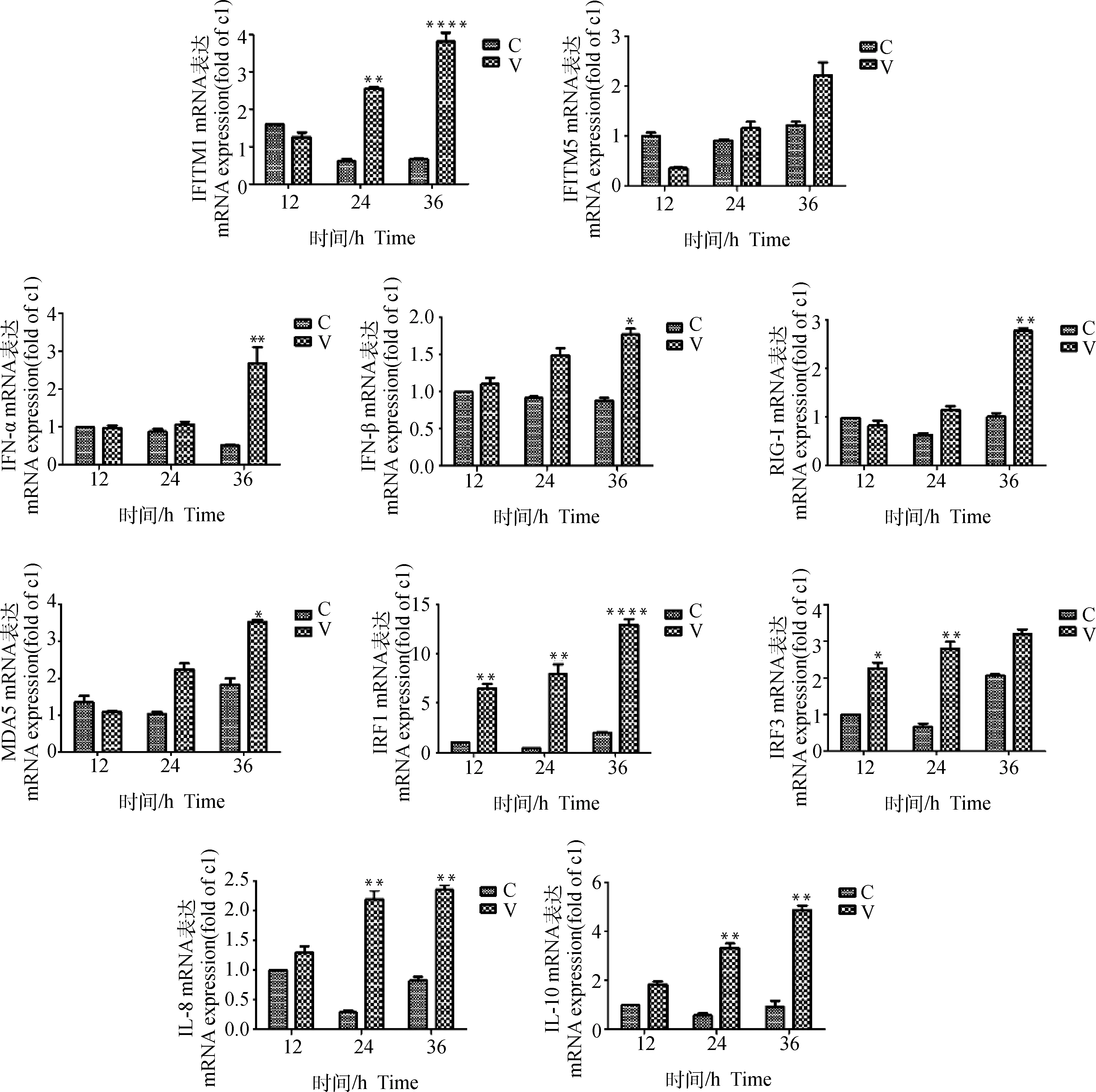
C.对照组; V.攻毒组。*.P<0.05; **.P<0.01; ****.P<0.000 1
此外,IRF1和IRF3在介导TLRs和RLRs识别病原相关分子产生干扰素过程和抗病毒免疫相关的信号通路交互作用中发挥着重要作用[12]。本次荧光定量PCR验证结果显示,在DHAV-3感染12 h后,IRF1和IRF3的表达水平都显著持续上升,表明二者在病毒感染和免疫相关的分子机制中发挥重要作用。
在本次验证过程中发现,感染后的24 h雏鸭肝中,与炎症反应和组织损伤程度相关的IL-8和IL-10的mRNA水平均显著上调(分别为对照组的6.47倍和5.69倍),可能提示病毒感染造成的肝损伤程度在24 h即可达到较高水平,这与朱玉东等[13]对DHAV-3人工感染雏鸭诱导表达的细胞因子检测结果相符。
2.4 duIFITM1对DHAV-3 SWUNC4株在DELC中的抑制作用
2.4.1 pEGFP-duIFITM1重组真核表达载体的鉴定 对构建好的重组pEGFP-duIFITM1质粒进行双酶切鉴定,经电泳观察结果发现在4 700和450 bp处出现了与预测大小相一致的亮带(图3)。对重组质粒序列分析并与参考基因序列(NM_001310 823.1)进行比对,结果核苷酸相似性为100%,表明pEGFP-duIFITM1 构建成功。

M.DL5000 DNA相对分子质量标准; 1.pEGFP-N1空质粒对照; 2.pEGFP-duIFITM1
2.4.2 重组真核表达质粒转染DELC细胞 将pEGFP-duIFITM1通过脂质体法导入DELC细胞中,分别在24和48 h于倒置荧光显微镜观察。结果在pEGFP和pEGFP-duIFITM1转染组均可观察到清晰的绿色荧光蛋白出现,且duIFITM1基因的引入对pEGFP绿色荧光的强度没有明显的影响,由此间接证明重组质粒被成功转入DELC细胞,同时载体蛋白在细胞中获得良好的表达(图4)。
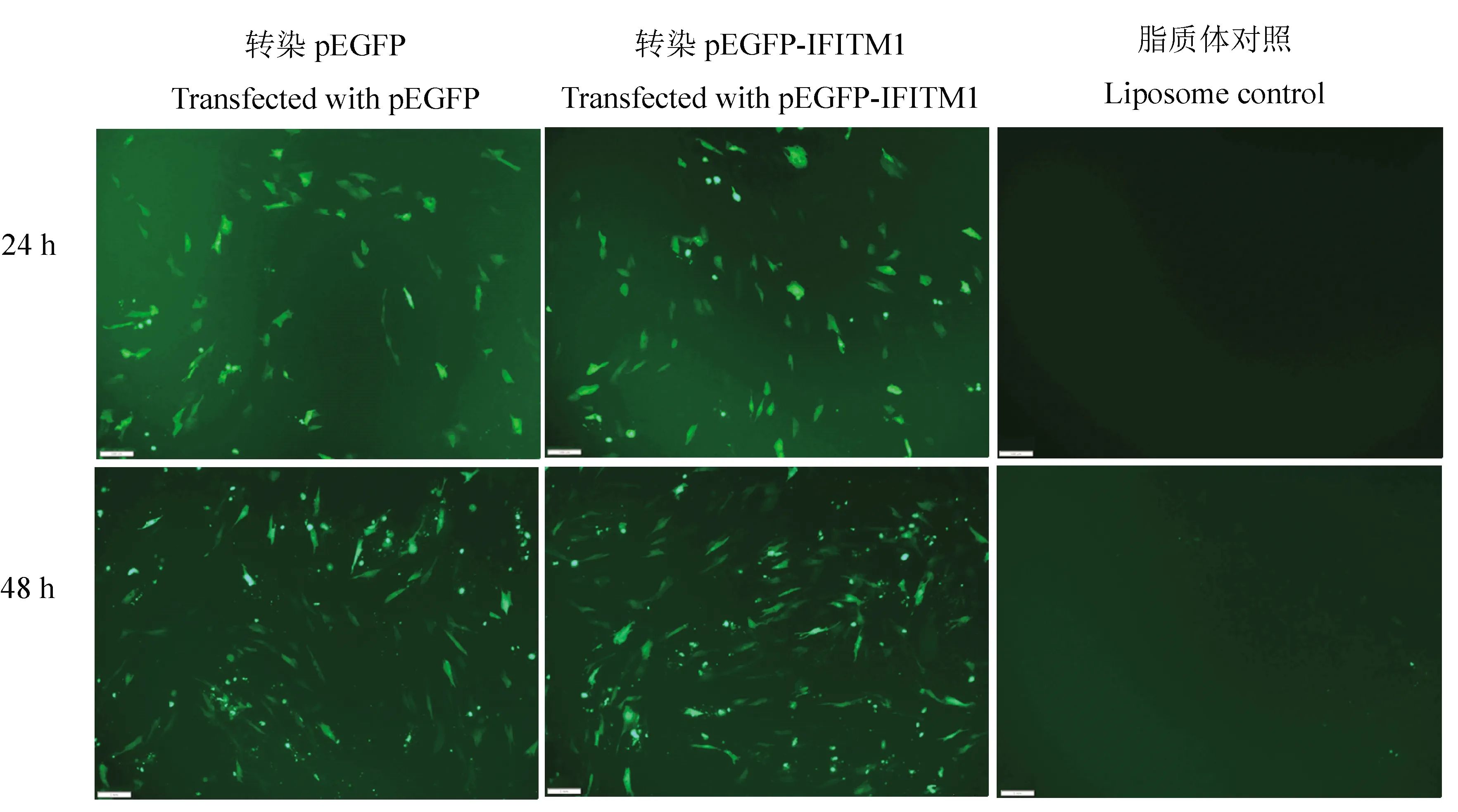
图4 pEGFP-IFITM1在DELC中的表达(bar=100 μm)
2.4.3 duIFITM1过表达和siRNA干扰的荧光定量PCR验证 分别收集转染 pEGFP-N1 和 pEGFP-duIFITM1 后 48 h 的 DELC,反复冻融3次后,Real-time PCR检测。结果显示,转染重组质粒后的DELC样本中,duIFITM1蛋白的mRNA水平显著高于pEGFP-N1空质粒组(P<0.01),pEGFP-duIFITM1 被成功转入鸭胚肝原代细胞且高效表达(图5A)。
以GAPDH为内参基因,Real-time PCR检测结果表明,与对照组相比duIFITM1-siRNA1、duIFITM1-siRNA2和duIFITM1-siRNA3下调duIFITM1表达量分别为 60.6%、55.0%和54.4%,因此,duIFITM1-siRNA1干扰效果更好(P<0.01)(图5B),后续研究选用duIFITM1-siRNA1作为干扰片段。

A.过表达;B.siRNA干扰; **.P<0.01
2.4.4 duIFITM1过表达和siRNA干扰的Western blot验证 分别刮取转染空载体和 pEGFP-duIFITM1后48 h的DELC细胞进行 SDS-PAGE和Western blot验证,以GADPH 蛋白为内参。在 pEGFP-duIFITM1 转染组样品泳道出现与预期大小相符的条带(15.8 ku),同时GADPH内参蛋白(36 ku)条带也清晰可见,且表达量相对稳定。上述结果进一步验证了duIFITM1在DELC中的成功表达(图6A、B)。
用Western blot法检测转染duIFITM1-siRNA1对DELC细胞中duIFITM1蛋白表达情况的影响。结果显示,相比于对照组,siRNA片段可以有效降低duIFITM1蛋白表达水平。同时GADPH内参蛋白稳定表达(图6C、D)。

A、B.过表达;C、D.siRNA干扰;A.pEGFP-IFITM1组出现目的条带;B.GADPH内参蛋白;C.si-IFITM1 干扰组目的蛋白表达量下降;D.GADPH内参蛋白
2.4.5 过表达和干扰duIFITM1对DELC活力的影响 细胞活力测定结果显示,与对照组相比,转染 duIFITM1-siRNA、pEGFP-N1和pEGFP-duIFITM1的DELC细胞在12、24、48、60和72 h等5个时间点的OD值均未出现明显变化,表明上述转染过程不会抑制DELC细胞的活力(图7)。

图7 DELC细胞转染后的活力测定
2.5 duIFITM1对DHAV-3 SWUNC4株在DELC中的抑制作用
分别在过表达和siRNA干扰duIFITM1的DELC中接种DHAV-3 SWUNC4株,对接毒后24、36、48和60 h的细胞样本中的病毒核酸含量进行检测,结果见表4。在接毒后48和60 h,pEGFP-N1组和duIFITM1-siRNA组病毒含量均显著高于pEGFP-duIFITM1转染组(P<0.01);同样,对48和60 h样本中病毒滴度进行测定,结果显示,过表达duIFITM1组病毒lgTCID50·0.2 mL-1值显著高于pEGFP-N1对照组(图8A)。上述结果证明过表达duIFITM1对DHAV-3在DELC增殖具有明显的抑制作用。但duIFITM1-siRNA组各时间点病毒核酸拷贝数和滴度均与NC组相比没有显著差异(图8B),表明降低duIFITM1表达量不能直接影响DHAV-3在宿主细胞中的增殖,这也可能与DELC中duIFITM1本底表达水平较低有关。

A.duIFITM1过表达细胞中病毒滴度变化;B.duIFITM1干扰细胞中病毒滴度变化。**.P<0.01

表4 duIFITM1过表达和干扰细胞中DHAV-3含量的变化
3 讨 论
根据IFITMs家族蛋白基因的分子特征及相关功能目前主要被划分成了三个亚家族[14]。第一个亚家族主要包含在人类发现的所有与免疫相关的IFITMs家族蛋白(IFITM1、IFITM2和IFITM3)以及和人IFITMs直系同源的鼠IFITM6和IFITM7[15]。IFITM2和IFITM3基因具有高度的相似性,IFITM1则独立形成一个小分支[16]。IFITM5和IFITM10分别属于IFITMs的第二个亚家族和第三个亚家族,IFITM5在成骨细胞、巨噬细胞和脾细胞中产生[17]。近年研究发现IFITMs多个家族成员对不同的病原具有抑制作用[18],且对某些病毒的抑制过程十分迅速,但具体分子机制尚未明确。如:IFITM1、IFITM2、IFITM3、IFITM5和IFITM6可通过与病毒包膜蛋白或入侵相关蛋白相互作用有效抑制IAV、MARV、EBOV和SARS病毒的入侵[19-20]。IFITM1可抑制HCV在细胞内的复制[21]。而IFITM1可以在膜融合、内吞和核内体等多环节介导宿主抗CSFV反应[22]。部分IFITMs还可能通过与氧固醇结合蛋白结合调节胆固醇运输作用,使胆固醇迁入晚期内体进而阻断病毒的融合[18]。上述研究表明,IFITMs可能成为新型高效的抗病毒分子。基于这一思路,本研究采用RNA-seq技术对DHAV-3 SWUNC4株感染雏鸭肝脏中mRNA进行高通量测序,并结合相关生物信息学软件对获得的所有转录本进行了系统分析,发现感染早期雏鸭肝中的duIFIITM1 和duIFITM5转录水平明显升高,这提示duIFIITM 可能在雏鸭早期感染DHAV-3过程中发挥重要作用。经Real-time PCR验证结果表明,duIFITM1在DHAV-3感染后的24和36 h显著上调,分别为对照组的4.42倍和7.14倍(P<0.01),而duIFITM5在24和36 h表达量没有明显变化,这一趋势与转录组测序结果相符,提示duIFITM1是DHAV-3感染早期发挥抗病毒作用的主要干扰素诱导蛋白家族成员之一。随后,本研究在DELC细胞中分别转染pEGFP-duIFITM1和duIFITM1-siRNA,构建duIFITM1过表达和敲减细胞模型,以验证duIFITM1对DHAV-3可能存在的抑制作用。结果显示,经Real-time PCR和Western blot试验验证表明duIFITM1在DELC中获得稳定高效表达;又分别测定过表达和敲减duIFITM1的DELC中,不同时间点病毒滴度和核酸含量变化。结果表明,在接毒后48和60 h,在duIFITM1过表达细胞中DHAV-3滴度及核酸量与pEGFP-N1对照组和duIFITM1-siRNA组差异显著(P<0.01),证明过表达 duIFITM1 对DHAV-3 在DELC 增殖具有明显的抑制作用。
此外,本研究通过高通量测序分析共获得多个与抗DHAV-3免疫反应相关分子和信号通路;其中TLRs分子表达上调和相关通路的富集出现在感染后12 h,RLRs信号通路相关分子的富集出现在24 h。目前,TLRs、RLRs和NLRs三类家族蛋白已被证实为小RNA病毒分子识别的主要PPRs[23];据此推测在感染早期 DHAV-3可能存在某种分子逃避机制使病毒相关PAMPs在感染初期不能大量激活RLRs,从而为病毒在宿主机体的潜伏和增殖创造条件;另一种可能是,病毒采取了某种干扰策略抑制了除 TLRs 外的其他两种 PRRs 的识别或相关通路的激活,从而增强病毒对宿主的侵袭力。类似的抑制作用在 DHAV-1 的感染分子机制研究中已被证实,如:DHAV-1 感染 24 h后 RIG-I 和 MDA5 的表达水平均显著下调,提示病毒对 RLRs 具有抑制作用[24]。本研究进一步对表达差异显著的12个免疫和炎症反应的关键分子进行了Real-time PCR验证发现,在 DHAV-3 感染12~24 h 样本中RIG-I 和 MDA5 的mRNA维持在较低水平,但36 h的表达量显著上升,这间接印证了关于病毒早期感染过程中存在逃避RLRs识别机制的假设,也表明DHAV-3对宿主的感染过程更倾向于选择免疫逃避策略而非类似 DHAV-1的免疫抑制。通过Real-time PCR检测还发现感染早期 RIG-I 和 MDA5 的表达水平较低与 IFN-α/IFN-β 早期表达滞后的变化趋势一致。目前研究已表明,RLRs 对 PAMP的识别后激活 IRF3 和 NF-κB 的磷酸化过程是Ⅰ型干扰素产生的重要分子机制之一,结合本研究结果,作者认为 DHAV-3感染早期IFN-α 和 IFN-β 的产生相对滞后与 RIG-I 和 MDA5 分子保持较低的表达水平有关。另一方面,两种干扰素表达水平变化与duIFITM1显著上升的趋势并不一致,这提示DHAV-3感染早期duIFITM1可能还受到其他细胞因子或蛋白的调节。当前已有研究发现,除干扰素外,IL-6和抑癌蛋白M也可诱导部分IFITMs的表达上调[25]。进一步深入探索duIFITM1诱导因子类型及其水平变化可能为以其作为新型抗病毒分子提供帮助。
4 结 论
首次证实duIFITM1抑制DHAV-3在DELC增殖,丰富了IFITMs抗病毒研究的相关资料,为以此开发新型抗病毒药物奠定了基础。同时,对雏鸭机体早期抗病毒免疫的多个关键分子的表达水平变化规律进行了系统研究和分析,为DHAV-3感染与免疫的分子机制深入探索提供重要参考。
