1例凝血因子Ⅺ缺乏症基因突变及临床表现分析
2022-03-29张婷婷薛卫斌蒋一斓王浩园罗福康
张婷婷 ,薛卫斌 ,蒋一斓 ,杨 霞 ,王浩园 ,罗福康△
1.重庆市第九人民医院医学检验科,重庆 400700;2.西南大学医学研究院,重庆 400700
凝血因子Ⅺ(FⅪ)又称血浆凝血酶原前质(PTA),是由肝脏和巨核细胞所产生的一种丝氨酸蛋白酶原。早期凝血理论认为FⅪ是内源性凝血途径的重要因子,由FⅫa激活参与凝血过程;修正后的凝血理论则认为FⅪ更重要的作用在于放大凝血级联反应,促进凝血酶的持续生成,抑制纤溶,稳定血凝块[1]。FⅪ缺乏症首次报道是在1953年,相关学者发现该病是一种有别于抗血友病球蛋白(AHG)缺乏(血友病A)和血浆凝血活酶成分(PTC)缺乏(血友病B)的出血性疾病,称为PTA 缺乏病(血友病C)[2];该病的遗传方式为常染色体不完全隐性遗传,与血友病X 染色体连锁的隐性遗传方式不同,故被剔除,现普遍称为FⅪ缺乏症。FⅪ缺乏症在人群中较罕见,发病率仅为1/106~1/105[3]。迄今为止,人类基因突变数据库[HGMD®gene result (cf.ac.uk)]报道了FⅪ基因的280多个突变个体。本研究通过基因测序技术,对1例FⅪ缺乏症患者进行FⅪ基因的全外显子扩增并测序,确定其基因的突变位点,同时利用生物信息学工具分析该突变的致病可能性,初步探讨该病例的发病机制。
1 资料与方法
1.1 一般资料 患者,女,汉族,30岁,停经52 d,要求终止妊娠,术前检查发现凝血功能异常。进一步完善活化部分凝血活酶时间(APTT)纠正试验和凝血因子活性检查确诊为FⅪ缺乏症。肝功能、血常规等检查均无明显异常。该患者身体健康,无出血及血栓倾向,月经规律,量中,无痛经。适龄结婚,孕3产2,顺产2女,丈夫及女儿均体健。
1.2 方法
1.2.1 标本采集及处理 采集2管患者静脉血标本2.7 mL,以3.2%枸橼酸钠1∶9抗凝,1管在规定的条件下(室温,1 500×g、15 min)离心得到乏血小板血浆(血小板计数<10×109/L)用于凝血指标检测。另1管静脉全血标本送重庆浦洛通医学检验实验室进行基因测序分析。
1.2.2 凝血指标检测 采用SYSMEX CS5100全自动凝血分析仪和SIEMENS配套凝血试剂检测患者凝血酶原时间(PT)、APTT、血浆纤维蛋白原水平(Fbg)、凝血酶时间(TT)及完善APTT 纠正试验和凝血因子Ⅱ活性(FⅡ∶C)、凝血因子Ⅴ活性(FⅤ∶C)、凝血因子Ⅶ活性(FⅦ∶C)、凝血因子Ⅷ活性(FⅧ∶C)、凝血因子Ⅸ活性(FⅨ∶C)、凝血因子Ⅹ活性(FⅩ∶C)、凝血因子Ⅺ活性(FⅪ∶C)、凝血因子Ⅻ活性(FⅫ∶C)检测。
1.2.3 二代测序 使用HiPure Blood DNA Mini Kit血液DNA 小量提取试剂盒(产品编号:D3111-03,生产批次号:DJC31-01)提取患者外周血DNA。通过超声打断的方式将患者血浆DNA 打断并制备文库,之后用IDT xGen Exome Research Panel v1.0 对目标区域进行捕获,再使用高通量测序平台对变异进行检测。本研究检测平均测序深度100X;Q30≥85%,Q20≥90%,参考基因组GRCh37/hg19。
1.2.4 一代测序验证 对含突变位点在内的220 bp碱基序列进行扩增,利用Primer Premier5.0软件设计特异性引物。引物序列为:正向5'-ATC TTT CTT TGG GGT TCA AGA A-3',反向5'-TGG CAC TCT TCG TTG GTC ACT A-3'。第一轮PCR(聚合酶链式反应)总反应体积25 μL;扩增体系为2×T5 Direct PCR Mix(Blood):12.5 μL;ddH2O:9.5 μL;正向引物:1 μL;反向引物:1μL;DNA 模板:1 μL。扩增程序:98 ℃预变性3 min,98 ℃变性10 s,60 ℃退火10 s,72 ℃延伸15 s,一共进行35个循环;72 ℃再次延伸3 min,4 ℃保存。将5 μL PCR 产物放在2.0%的琼脂糖凝胶上,通过电泳检测扩增效果。第一轮扩增完成后用磁珠(MagPure P1)纯化法进行纯化,然后进行第二轮PCR,总体积10 μL,扩增体系为Seq Buffer,1.9 μL,ddH2O:5.9 μL;Big Bye:0.25 μL。反向引物或正向引物:1 μL;DNA 模板:1 μL。扩增程序:96 ℃预变性1 min,96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,共进行25 个循环,4 ℃保存。第二轮扩增完成后,再用磁珠(DTR)进行纯化,最后取15 μL 纯化完成后的DNA 上机测序(上机仪器为一代测序仪ABI 3500)。
1.2.5 生物信息学分析 用ClustalX-2.1-win软件将人的FⅪ氨基酸序列与6个同源物种[褐家鼠(Rattus norvegicus)、小 家 鼠(Mus musculus)、猕 猴(Macaca mulatta)、牛(Bos troglodytes)、马(Equus caballus)、猪(Sus scrofa)]的氨基酸序列进行比对,分析突变氨基酸位点在物种进化过程中的保守性。在Uniprot数据库中查找FⅪ的ID 并获取该蛋白质FASTA 格式的氨基酸序列,用生物信息学在线工具Polyphen2预测突变位点的危害性,再利用蛋白质变异效应分析软件 PROVEAN 分析突变是否影响蛋白质功能。用SWISS-MODEL 预测野生型和突变型FⅪ的三维结构,在Pymol 软件中查看Thr517 和Asn517周围的氢键情况,分析第517位的Thr突变为Asn后蛋白质空间结构及分子间作用力的变化情况,参考蛋白质FⅪ的名称为“P03951”。
2 结果
2.1 凝血指标检测结果 对患者进行凝血4 项及APTT 纠正试验,结果显示,患者APTT 为74.6 s,高于参考范围上限;Fbg为4.32 g/L,比参考范围上限稍高。APTT(1∶1混合血浆即刻检测)、APTT(1∶1混合血浆孵育2 h)均在参考范围内,可以纠正,见表1。凝血因子活性检测结果显示患者FⅪ∶C 仅为4.1%,低于参考范围下限,其他凝血因子活性均正常,见表2。
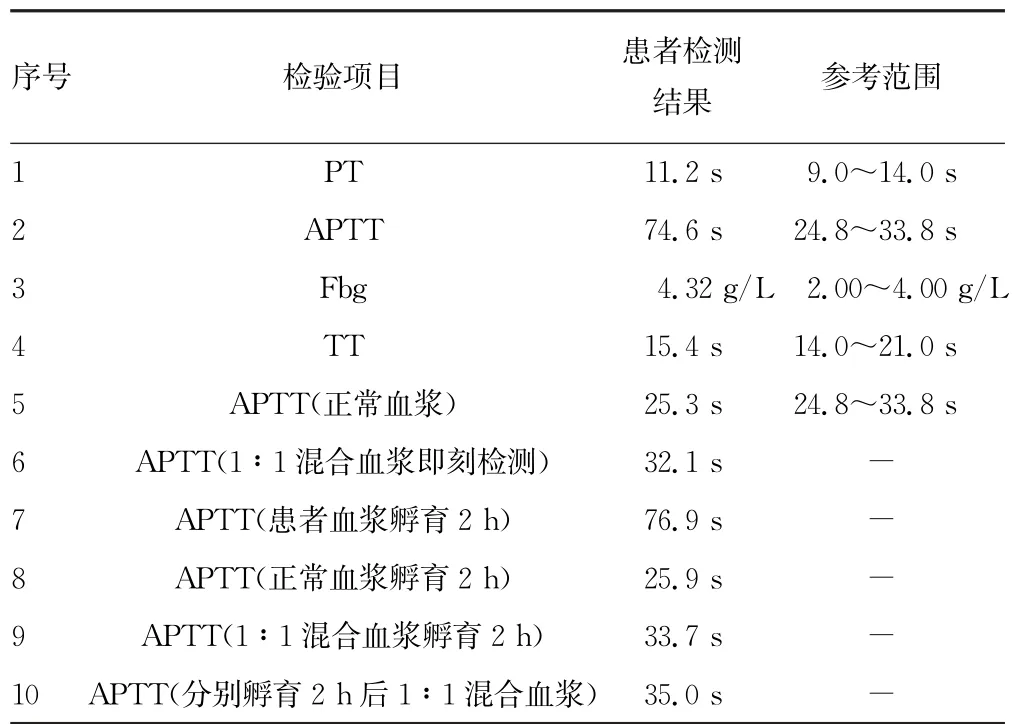
表1 患者凝血4项及APTT 纠正试验结果

表2 患者凝血因子活性检测结果
2.2 基因分析结果 全外显子高通量测序结果显示,患者F11基因的第13外显子出现了新的突变,新的突变位点为c.1550C>A/p.Thr 517Asn,一代测序验证此结果。与参考序列(NM_000128.3)相比,F11基因的CDS序列的第1 550个碱基由C变为了A,且为纯和突变,序列信息上传至NCBI(SRA Accession:PRJNA763306)。该突变在数据库中未见报道。见图1。

图1 患者F11基因测序结果
2.3 同源性与突变危害分析结果 ClustalX-2.1-win软件保守性分析结果表明,人类凝血因子Ⅺ突变位点Thr517在本文找的6种同源物种间高度保守。Polyphen2对F11基因突变位点p.Thr 517Asn的危害性预测结果显示,HumDiv和HumVar两个指标都是“PROBABLY DAMAGING”,得分分别为1.000和0.998。见图2。

图2 p.Thr 517Asn保守性分析和危害性预测
2.4 FⅪ三维结构模型分析结果 见图3。结果显示,Thr517位于β-折叠结构域。Asn517也位于β-折叠结构域。同时,Thr517 周围没有氢键,Val516 与Ala535有两个距离分别为1.9Å 和2.0Å的氢键,Glu518与Gln533有两个距离分别为2.3Å 和2.1Å氢键。图3D 显示Asn517 与Gln533 有一个距离为2.4Å的氢键,Val516 与Ala535 有两个距离分别为1.9Å 和2.1Å的氢键,Glu518与Gln533有两个距离分别为2.4Å 和2.1Å 氢键。图3C、图3D 中标记为①的是氢键,标记为②的柱状氨基酸为Val516,标记为③的柱状氨基酸为Thr517,标记为④柱状氨基酸为Glu518,标记为⑤的柱状氨基酸为Ala535,标记为⑥的柱状氨基酸为Gln533。
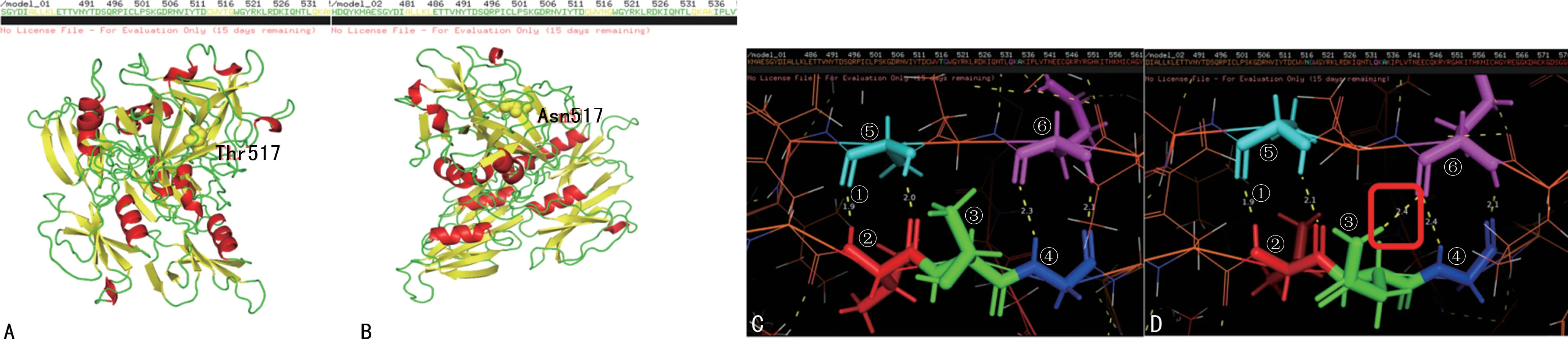
图3 野生型、突变型FⅪ三维结构模型图
3 讨论
FⅪ缺乏症的症状相对较轻,自发性出血罕见,主要见于受伤或手术相关的出血,尤其是当创伤涉及具有高纤维蛋白溶解活性的局部部位,如口腔或鼻腔、前列腺和尿道[4]。多数患者在术前检查凝血功能异常时发现,女性患者可因月经量过多而就诊[5]。研究表明,FⅪ∶C与出血严重程度之间缺乏相关性,一些轻度患者与重度患者的出血频率几乎相同[6]。目前实验室常规检测方法无法评估FⅪ缺乏症患者的出血风险,在FⅪ缺乏症患者中出血表现具有高度异质性而FⅪ的替代治疗可能会增加患者发生血栓风险[7]。对非出血患者,替代治疗存在过度使用的风险,而对于出血患者可能存在治疗不足,因此应该根据患者个体风险、手术部位及类型等采用个体化诊疗措施。
本研究中患者为育龄期女性要求终止妊娠,术前检查发现凝血功能异常,APTT 延长,FⅪ∶C 仅为4.1%,APTT 纠正试验显示纠正,可以排除凝血因子抗体及抑制物的影响[8]。患者肝功能、血常规等检查无明显异常,并无出血与血栓表现,已顺产2女且无异常出血。未纠正凝血功能行人工流产术中及术后亦未异常出血,术后第2天出院。大多数FⅪ缺乏症为遗传性,获得性FⅪ缺乏症非常罕见,多为个案报道,与免疫系统功能障碍、肿瘤及输血等因素相关,APTT 纠正试验不能纠正可将其与遗传性鉴别[9]。根据本研究中患者病史及相关实验室检查结果可初步诊断为遗传性FⅪ缺乏症。
FⅪ是一种有助于止血的血浆丝氨酸蛋白酶酶原,由两个FⅪ单体通过第321位的半胱氨酸产生的二硫键形成同源二聚体,并以此种方式存在于血浆中[10]。每个单体包含4 个串联的苹果(Ap)结构域(A1~A4),这些Ap结构域显示出彼此之间的序列同源性,还包含1个丝氨酸蛋白酶(SP)域,该域与其他凝血因子的丝氨酸蛋白酶域同源。FⅪ的激活导致位于第369位的精氨酸(Arg)与第370 位的异亮氨酸(Ile)之间的肽键断裂,形成包含 Ap 结构域的重链和包含 SP 结构域的轻链,在 His413、Asp462 和 Ser557处具有催化三联体(H413-A462-S557)。编码FⅪ的基因是F11,F11位于4号染色体长臂 (4q35),由15个外显子和14个内含子组成[11]。1号外显子编码5'端非转录区,2号外显子编码18个氨基酸的信号肽,3~10号外显子编码成熟蛋白位于氨基端的4个Ap结构域,其中每两个外显子编码1个Ap结构域,11~15号外显子编码的是多肽链羧基端的SP结构域[1]。目前,F11的突变位点约有280个,不同位点的突变,将对FⅪ产生不同的影响。
先前的研究中充分体现了氨基酸的变化引起蛋白质三维结构变化,从而导致蛋白质中氨基酸相互作用力的改变并影响其功能的事实。如LEE 等[12]研究发现位于F11的13外显子C.1517A>G/Asp506Gly的突变,C 端催化域中的Asp506残基通过形成氢键与A3域中的Arg202 相互作用,此突变造成了Asp完全被Gly取代并破坏了与Arg202的氢键相互作用,这种破坏可能会导致A3结构域的构象变化,从而造成患者凝血障碍;SU 等[13]研究发现Tyr503Cys的突变中,替换产生了半胱氨酸残基,导致形成额外的氢键和二硫键,影响FⅪ蛋白的结构和功能,Tyr503位于FⅪ催化结构域 (催化三联体:H413-A462-S557),因此Tyr503Cys突变可能会导致FⅪ功能严重缺陷;GAILANI等[14]研究发现Pro520Leu突变导致FⅪ催化效率降低;ZIVELIN 等[15]对Gly555Glu研究发现突变后将大大降低FⅪ激活率;叶佳佳等[16]研究发现Cys482Trp使FⅪ重要结构域缺失及作用力改变导致形成不稳定蛋白,可能导致FⅪ∶C下降。
本研究中二代测序结果表明患者F11基因中发现了新的突变位点c.1550C>A/p.Thr 517Asn,并通过一代测序验证该突变位点。在Ensemble数据库搜索,发现此位点位于F11第13外显子,FⅪ氨基酸序列第517位苏氨酸被天冬酰胺取代。经同源序列比对,Thr517在同源物种中高度保守,说明该位点的重要性和功能特异性。PoliPhen2在线预测蛋白突变影响的结果显示为“可能具有危害性”,HumDiv 和HumVar两个指标得分分别为1.000和0.998,表明此突变可能引起相关疾病。FⅪ三维结构建模显示,Thr517位于FⅪ的β-折叠域,且Thr周围并无氢键,但是与Thr相邻的516Val与Ala535有两个距离分别为1.9Å 和2.0Å的氢键,Glu518与Gln533有两个距离分别为2.3Å 和2.1Å的氢键。但是当Thr517突变为Asn后,Asn517与Gln533之间增加了一个距离为2.4Å的氢键,Val516 与Ala535 之间的两个氢键有一个距离由2.0Å 变为2.1Å,Glu518与Gln533之间的两个氢键有一个距离由2.4Å 变为2.1Å。由此可见,FⅪ的Thr517突变为Asn后,自身增加了额外的氢键,同时还改变周围氨基酸的氢键作用强度,从而影响了FⅪ的三维构象及其功能。此种改变可能导致FⅪ难以被FⅫ激活或催化活性显著降低,患者出现APTT 明显延长,其分子机制有待进一步研究。
本研究发现1例FⅪ缺乏患者,通过二代测序和一代测序证实其为遗传性FⅪ缺乏症,突变位点(c.1550C>A/p.Thr 517Asn),通过生物信息学分析,认为此突变是造成的凝血因子Ⅺ活性降低原因。该位点突变导致APTT 显著延长,但患者不会出现凝血功能障碍,诊疗过程中不需补充凝血因子。总之,本研究丰富了FⅪ遗传变异的数据库,也为临床工作中类似病例的诊疗提供了参考。
