miRNA-182与miRNA-187联合检测对前列腺癌诊断的价值*
2022-03-29史浩天范学武胡逸民
史浩天 ,范学武 ,田 龙△ ,胡逸民
1.河北北方学院附属第一医院检验科,河北张家口 075000;2.河北省人民医院心血管内科导管室,河北石家庄 050000;3.中国医学科学院肿瘤医院放疗科,北京 100021
前列腺癌(PCa)粗发病率位居中国男性恶性肿瘤第6位,且仍在升高[1]。局限性或区域性扩散的PCa患者5年相对生存率可达100.0%,但存在远端转移的PCa患者仅为30.2%[2]。因此,早期筛查确诊PCa并发现转移灶将会极大改善患者预后,具有重要的临床意义。
PCa早期筛查方法以血清前列腺特异性抗原(PSA)检验为主。PCa发病率随着PSA 水平升高而升高[3-6]。然而一些良性病变,如前列腺增生(BPH)也会导致PSA 升高。因此,单独检测PSA 对PCa的诊断特异度较低。目前,生物基因组标志物已经开始应用于多种肿瘤的筛查和治疗[7]。其中有关参与细胞转录后基因表达调控,长度约为22 个核苷酸的非编码单链RNA 分子微小RNA(miRNA)相关研究较多。miRNA 可作为致癌基因或抑癌基因在PCa中异常表达,对PCa的发生、发展和转移具有较大影响[8]。因此,在前列腺肿瘤组织,尿液和血清标本中检测特定miRNA 表达水平可能对提高PCa诊断准确率具有重大意义,但目前相关研究较少。
为了明确miRNA 对PCa的诊断意义,本研究检测了前列腺疾病患者前列腺影像学异常区域(IAA)组织中miRNA-182和miRNA-187表达水平并统计分析其与PCa各项临床资料间的关系和对PCa的诊断效能。
1 资料与方法
1.1 一般资料 选取河北北方学院附属第一医院2019年12月至2020年12月收治的33例PCa患者为试验组。纳入标准:(1)体质量指数在18~25 kg/m2;(2)患者接受多参数磁共振成像并确定IAA大小;(3)患者接受经直肠超声引导穿刺活检;(4)各项临床资料完整。排除标准:(1)前列腺存在严重钙化、肥大或感染;(2)合并直肠息肉或痔疮;(3)接受过前列腺按摩;(4)接受过其他针对前列腺疾病的治疗(手术、放化疗、激素治疗等)。患者年龄52~73岁,平均(65.2±7.8)岁;年龄≥60岁患者26例,<60岁7例;6例为Gleason评分(GS评分)≤6分的高分化腺癌患者,7例为GS评分=7分的中分化腺癌患者,20例为GS评分≥8分的低分化腺癌患者;患者PSA水平在0~<10 ng/mL的有5例,10~<20 ng/mL的有7例,≥20 ng/mL的有21例;肿瘤分期在T1~T2期有14例,T3~T4期有19例;全身骨扫描发生远端转移患者17 例,未发生转移者16 例;前列腺IAA≥1 cm 者9例,<1 cm 者24例。选取同期收治的前列腺增生(BPH)患者30例为对照组。本研究通过该院医学伦理委员会批准(伦理编号:W2021)。所有患者均签署知情同意书。
1.2 试剂和仪器 Trizon Reagent试剂盒和低温高速离心机均购自美国赛默飞世尔公司。逆转录试剂盒,实时荧光定量PCR 仪和试剂盒均购自日本Takara公司。生物组织研磨器购自法国Bertin 公司。miRNA-182、miRNA-187、U6逆转录引物、PCR 上下游引物均由美国Sigma生物科技公司提供,引物序列见表1。

表1 引物序列
1.3 方法
1.3.1 IAA 组织标本的获取 对所有患者进行经直肠超声引导穿刺活检,所有活检标本取自多参数磁共振影像确定的IAA。将活检标本置于研磨器中,Trizol充分裂解后加入氯仿进行离心。之后将上层水相抽至新的微量离心管中,加入同体积冷异丙醇以沉淀RNA。之后离心并丢弃上清液,使用75%预冷乙醇洗涤包含RNA的沉淀物,离心并丢弃上清液。最后,于RNA 提取试剂盒中加DEPC处理水溶解标本。采用紫外分光光度法检测总RNA 浓度及纯度,取吸光度比值为1.8~2.1的样品用于后续试验。
1.3.2 miRNA 表达水平的测定 以U6为内参,将样本逆转录为cDNA,并利用SYBR Premix ExTaq荧光 定量PCR 试剂盒、miRNA-182/187 引物和SYBRGreen 荧光染料,严格按照试剂盒说明书进行操作,进行实时定量逆转录。通过RT-qPCR 曲线获得荧光达到阈值的循环数,即Ct值,miRNA 相对表达水平计算公式为RQ=2-ΔΔCt。
1.4 统计学处理 采用SPSS19.0软件进行统计学分析。不符合正态分布的计量资料采用M(P25,P75)表示,组间比较采用秩和检验。根据受试者工作特征(ROC)曲线下面积(AUC)评估miRNA 对PCa的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 各组miRNA 表达水平比较 试验组IAA 组织中miRNA-182 表达水平明显高于对照组(P=0.002);miRNA-187表达水平明显低于对照组(P<0.001),见表2。

表2 两组miRNA 表达水平的比较[M(P25,P75)]
2.2 PCa患者miRNA 表达水平与临床资料的关系 结果显示,PCa患者miRNA-182 表达水平与所有临床资料无关;miRNA-187表达水平与血清PSA水平、远端转移、IAA 大小存在一定关系,PSA≥10 ng/mL、存在远端转移、IAA≥1 cm 时,miRNA-187表达水平明显降低(P<0.05)。但miRNA-187表达水平与年龄、GS评分、临床分期无关(P>0.05)。见表3。
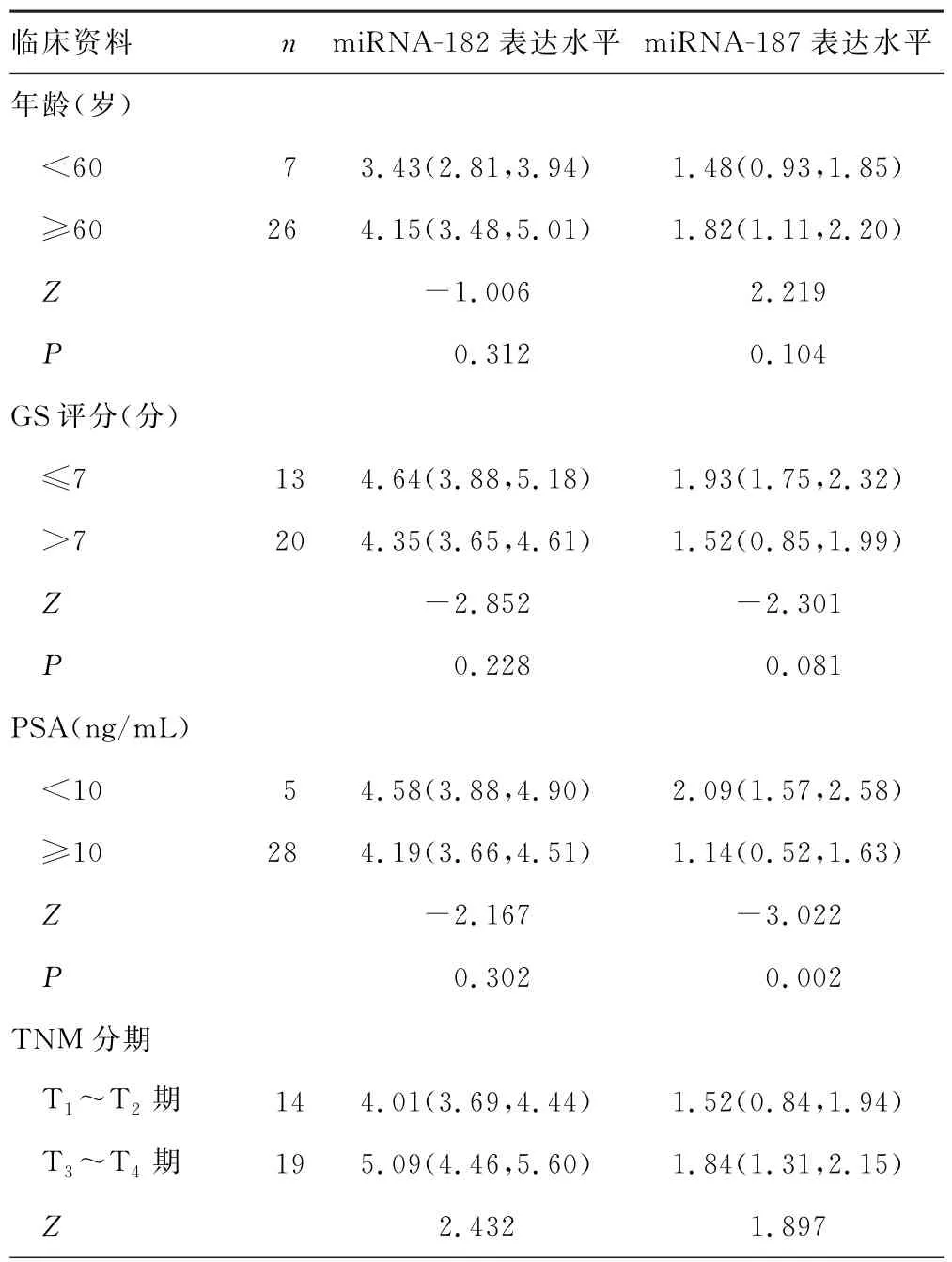
表3 miRNA 表达水平与各临床资料的关系[M(P25,P75)]
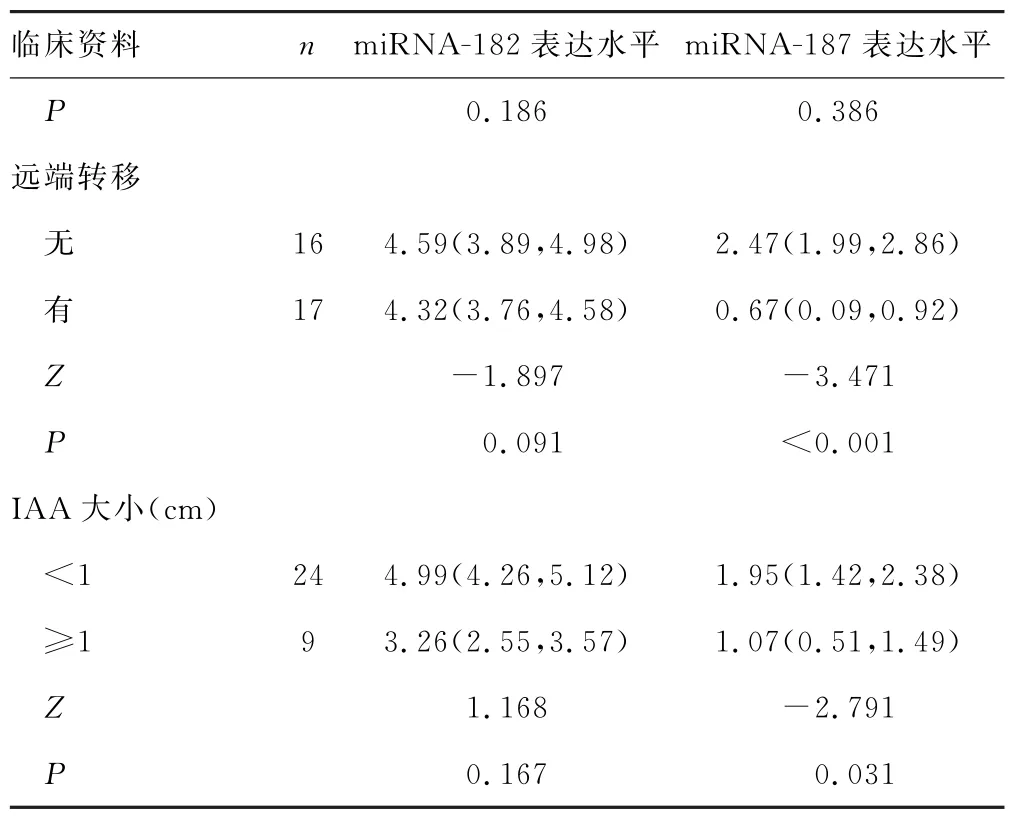
续表3 miRNA 表达水平与各临床资料的关系[M(P25,P75)]
2.3 miRNA的诊断效能 单独检测miRNA-182诊断PCa的AUC 为0.638(95%CI:0.522~0.711,P<0.01);单独检测miRNA-187 诊断PCa的AUC为0.741(95%CI:0.652~0.799,P<0.01);miRNA-182与miRNA-187 联合检测诊断PCa的效能最高,AUC为0.822(95%CI:0.771~0.839,P<0.01)。
3 讨论
miRNA 通过参与细胞转录后影响基因表达调控,即调节从DNA 到蛋白质的过程,影响细胞分化、增殖和凋亡等过程[9]。50%以上的miRNA 位点在肿瘤相关区域[10],其异常表达是肿瘤发生和进展的重要原因之一[11]。miRNA 对PCa的影响极为复杂,可分为表达水平升高而发挥“促癌”作用的miRNA-21、miRNA-34b等,以及表达水平降低而发挥“抑癌”作用的miRNA-15a、miRNA-206 等[12]。随着研究进展,同PCa密切相关的miRNA 不断被发现,其作用机制也逐渐清晰。
本研究发现,试验组IAA 组织中miRNA-182表达水平明显高于对照组(P=0.002);miRNA-187表达水平明显低于对照组(P<0.001)。刘云等[13]研究发现,miRNA-182在PCa组织中的表达水平明显高于癌旁组织,且在PCa 细胞系PC-3、LNCaP 和DU145中的表达均高于前列腺正常上皮细胞RWPE-1;miRNA-182可上调PCa细胞雄激素非依赖性生长,并通过干预多个抑癌基因表达来迟滞肿瘤细胞凋亡程序的启动;成功下调miRNA-182表达后,PCa细胞的增殖能力明显受到抑制,细胞凋亡能力明显增强,FOXO1表达水平明显升高,VEGF和p53的表达明显降低,从而降低了“促癌”作用。HU 等[14]研究中发现miRNA-187在PCa组织中的表达明显低于癌旁组织,而CD276表达水平明显升高。miRNA-187通过诱导CD276抑制PCa细胞增殖、侵袭、迁移和血管生成,促进其凋亡。成功上调miRNA-187 表达后,CD276表达降低,JAK3-STAT3-Slug 信号通路受到抑制,从而降低了“抑癌”作用[15-16]。
本研究结果显示,单独检测miRNA-182 诊断PCa的AUC 为0.638,单独检测miRNA-187 诊断PCa的AUC 为0.741,miRNA-182 与miRNA-187联合检测诊断PCa的效能最高,AUC 为0.822。郑兴明等[17]研究了miRNA-34b联合PSA 检测对PCa的诊断价值,结果显示,联合检测的诊断价值最高。未来研究中可以联合直肠指检、经直肠超声和多参数磁共振等临床资料进行诊断,可能会进一步提高诊断效能。
综上所述,IAA 组织中miRNA-182 和miRNA-187的联合检测对PCa诊断具有一定临床价值,值得临床推广应用。
