甜瓜“芝麻酥”的叶片愈伤组织及不定芽诱导研究
2022-03-29侯娇娇张江波张月玲
侯娇娇,张江波,张月玲
(1.焦作市中站区龙翔街道办事处,河南 焦作 454000;2.济源市农业科学院,河南 济源 459000)
甜 瓜(Cucumis melo L.)是 葫 芦 科(Cucurbitaceae)甜瓜属植物中的一种重要的瓜类作物,在我国瓜类作物栽培中占有较大种植面积。近10年来,随着植物基因工程技术的快速发展,借助转基因技术将目的基因导入甜瓜可以有效快捷地提高甜瓜的抗逆性并改良其品质。在甜瓜遗传转化的方法中,除花粉管通道法之外,其他方法均建立在组织和细胞再生完整植株的基础上。在组织培养方面,目前已能够通过子叶、真叶等外植体再生完整植株。1989年Dirks等以子叶和真叶为外植体,成功得到了5个甜瓜杂交种的再生体系[1];同年,Niedz等以甜瓜幼龄子叶为外植体获得了4个厚皮甜瓜基因型的再生体系[2];之后,Homma Y.等、Kathal R.等的研究涉及了更多的甜瓜基因型[3-4]。在国内,多以甜瓜子叶作为外植体进行再生体系的建立。王建设等建立了伊丽莎白主栽品种的再生体系[5];肖守华等、师桂英等建立了黄河蜜甜瓜等几个厚皮甜瓜品种的高效再生体系[6-7]。在真叶方面,2009年王福兰以甜瓜薄皮品种“甘甜一号”为材料,成功得到了甜瓜真叶再生体系[8]。但未见对芝麻酥甜瓜品种再生研究的报道。由于不同部位的外植体再生潜力不同[9],不同培养条件下外植体的再生潜力、频率存在很大差异[10],不同甜瓜品种的组培再生潜力因基因型不同而表现出明显差异,而且不同培养基种类,尤其是添加的植物激素种类及其配比对甜瓜组培再生潜力的影响也不同[11]。
甜瓜果实香甜,营养丰富。随着生活水平的提高,人们越来越注重其品质和产量。运用生物技术手段进行种质创新,培育出高产且优质的甜瓜新品种成为甜瓜遗传育种研究的新热点。甜瓜高效再生体系的建立,对于进一步进行甜瓜转基因等方面的研究十分必要,目前,已能够利用胚轴、胚根和子叶等外植体通过器官发生途径或体细胞胚途径再生完整植株。但国内关于叶片再生的报道较少,研究者多以甜瓜子叶作为外植体。因为利用叶片作为外植体,材料来源容易,可通过不断继代培养组培苗得到,尤其对于珍贵稀少的品种其意义更大。本文研究了不同激素组合、不同取材方式、不同光照条件等影响甜瓜叶片不定芽分化的因素,为应用转基因技术改良甜瓜性状奠定基础。
1 材料与方法
1.1 试验材料及仪器
甜瓜品种“芝麻酥”的成熟种子。MS培养基、6-BA、IAA。人工气候箱(MGC-250BP-2),超净工作台(SW-CJ-1F),高压灭菌锅,微波炉,电子天平(BL210S北京赛多利斯天平有限公司),冰箱,烘箱,量筒,手术刀,镊子,封口膜,烧杯,移液管,酒精灯等。
1.2 试验方法
1.2.1 培养基的配制。MS培养基的配制。以配制400 mL MS培养基为基础,配制方式如下:依次量取40 mL母液Ⅰ,4 mL母液Ⅱ,4 mL母液Ⅲ,4 mL母液Ⅳ于烧杯中,加入少量蒸馏水混匀,然后再加入称好的12 g蔗糖和3.2 g琼脂粉,搅拌混匀最后加蒸馏水定容至400 mL。用1 mol/L NaOH将培养基的pH值调至5.8左右,放入微波炉中加热融化琼脂。最后分装到三角瓶中,每瓶大约50 mL。不定芽诱导培养基的配制。在MS培养基上设置20种生长调节剂组合(表1),分别对外植体进行分化培养。
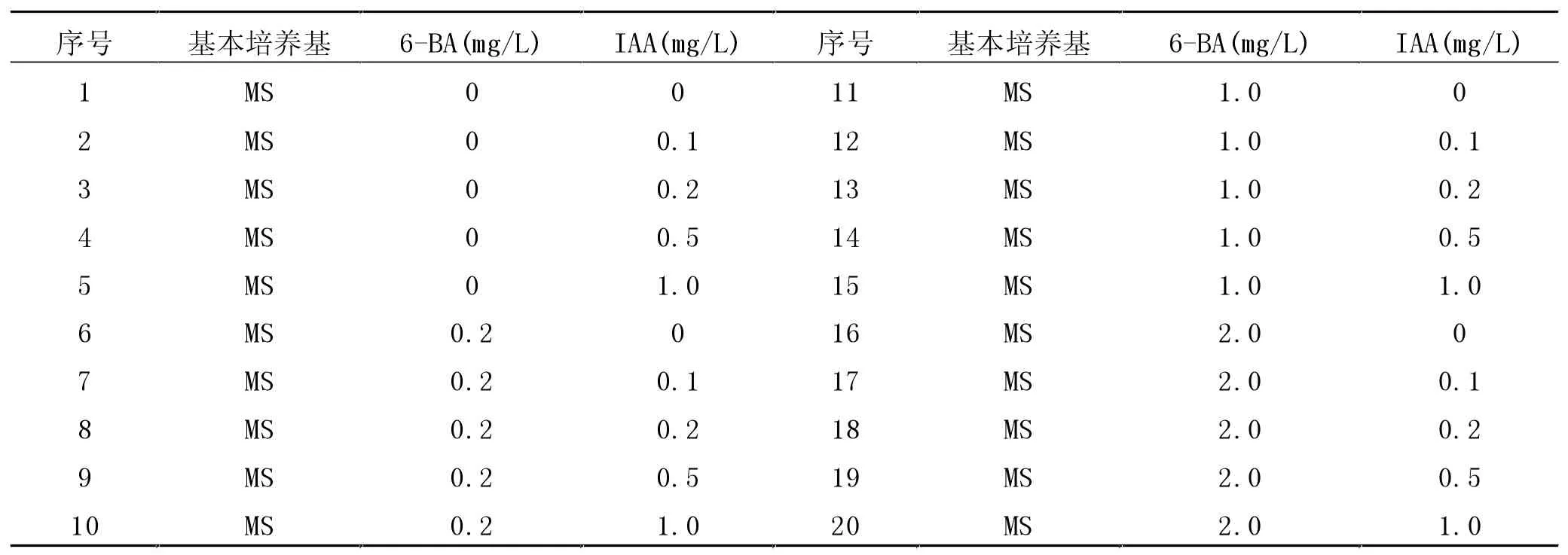
表1 20种诱导不定芽分化培养基
1.2.2 种子的接种。将甜瓜种子剥去壳后,0.1%的升汞表面灭菌5 min,无菌水冲洗4~5次,然后取出种子接种于MS固体培养基上。
1.2.3 预培养及不定芽诱导。(1)预培养:将接种好的种子放入条件为温度(25±1)℃光周期为16 h光照/8 h黑暗(正常光周期)的光照培养箱中,进行预培养10 d,以期获得下一步试验所需的材料,即叶片。(2)不定芽的诱导:在无菌条件下,取预培养获得的,新梢顶端未完全展开的叶片(不带叶柄),切成大约0.4 cm×0.4 cm甜瓜叶外植体小块,接种在不定芽诱导培养基上。然后转入温度(25±1)℃,光周期为16 h光照/8 h黑暗(正常光周期)的光照培养箱中进行培养,观察统计愈伤组织及不定芽的发生情况。
在叶片(不带叶柄)最佳激素条件下,取10 d苗龄新梢顶端未完全展开的叶片,不带叶柄、带叶柄(0.5 mm)两种取材方式,直接转入温度(25±1)℃,光周期为16 h光照/8 h黑暗(正常光周期)的光照培养箱中培养,观察统计愈伤组织及不定芽的发生情况。
在最适取材方式和最佳激素条件下选取试管苗幼嫩未完全展开叶片,接种于分化培养基上,设计前期暗培养时间为5 d,然后移至正常条件下培养,观察统计叶片不定芽的发生情况。
1.2.4 统计方法及数据分析方法。接种30 d后统计不定芽的发生情况。统计方法为:外植体不定芽分化率(简称“分化率”)=再生不定芽叶块数/接种叶块数×100%;外植体平均出芽数=再生不定芽总数/再生不定芽的叶块数;愈伤组织诱导率(愈伤诱导率)=愈伤块数/接种叶块数×100%。
2 结果与分析
2.1 甜瓜叶片不定芽诱导最佳激素组合的摸索
预培养10 d甜瓜叶外植体(不带叶柄)在不同浓度6-BA与IAA配比的MS培养基上大部分均能诱导出愈伤组织或不定芽丛(表2)。外植体在诱导培养基上接种后不断扩大,8 d左右,在外植体切口处长出细小、嫩绿的愈伤组织,17 d左右,在愈伤组织处长出芽丛。
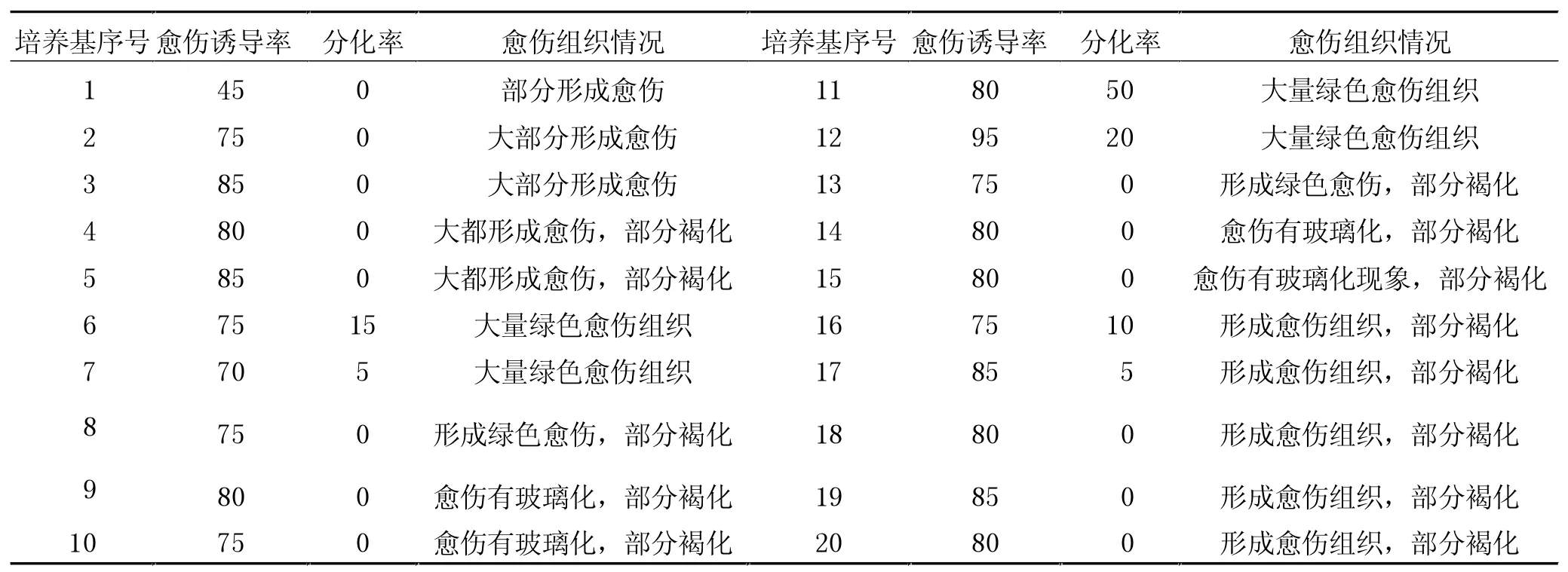
表2 6-BA与IAA对甜瓜叶片外植体发生不定芽和愈伤组织的影响(单位:%)
由图1可以看出,在6-BA 0.2 mg/L、1.0 mg/L、2.0 mg/L分别与IAA 0、0.1、0.2、0.5、1.0 mg/L配比时,随着IAA浓度的增加,不定芽发生频率都呈现出不断下降的趋势;其中6-BA 1.0 mg/L与IAA 0 mg/L配比时不定芽发生频率最高,达到50%,平均每个外植体上可诱导出1.6个健壮小芽,显著高于其他组合。
在不同浓度组合的6-BA与IAA的诱导培养基上,叶片分化率和平均出芽数差异很大。在MS+6-BA 1.0 mg/L(含琼脂0.8%、蔗糖3%)的诱导培养基上不仅分化率较高,而且玻璃化程度低,再生芽生长健壮,再生芽数多(图2)。随着IAA浓度的增加,外植体的分化率下降,且玻璃化现象也有加重的趋势。这是因为浓度过高的IAA含量促进了愈伤组织的形成,从而影响了不定芽的分化。6-BA对甜瓜的不定芽分化起着关键性作用,浓度过低产生芽丛较少,甚至没有芽丛产生,但是浓度过高,就会引起玻璃化苗的产生,芽丛减少(图3)。有研究表明,子叶块再生存在明显的极性,多在近轴端产生芽丛。叶片的再生,极性不像子叶块那样明显,所划伤口处能够较均匀产生芽丛。
2.2 不同外植体不定芽的诱导比较
在叶片外植体(不带叶柄)最佳激素浓度条件下,带叶柄的叶片切块不定芽诱导率较高,诱导率达65%,平均出芽数2.77个(表3),最早一批不定芽主要以直接出芽方式发生,没有明显的愈伤化过程。继续培养后,从外植体切口和与培养基贴近的一面长出愈伤组织,但愈伤组织多呈疏松霜花状,白色或淡绿色,少数疏松愈伤组织中长出绿色小瘤状物,小瘤状物以后可分化出不定芽(图4)。而叶片一般8 d左右,在近轴端长出鲜绿的愈伤组织。17 d左右在外植体愈伤组织处开始长芽丛。

表3 不同外植体不定芽的诱导比较
2.3 不同光照条件对不定芽诱导的影响
光照对带叶柄外植体的分化率、平均出芽数和出现不定芽所用时间有很大影响。直接转入正常光周期(光/暗培养时间为16 h/8 h)下培养的外植体,其不定芽的分化率最高为65%(再生培养基为MS+6-BA 1.0 mg/L),而且出现不定芽所用时间较短,外植体在接种后3~4 d就有所反应。暗培养,不定芽的再生率明显下降。这可能由于黑暗条件下,外植体内积累的生长素多,促进了愈伤组织的形成和生长。而激素平衡的改变和愈伤组织对养分的竞争不利于不定芽的分化,结果导致暗培养条件下外植体上的不定芽数明显少于正常光周期下培养的外植体上的不定芽数。而且暗培养后,外植体上的不定芽数明显少于正常光周期下培养的外植体上的不定芽数,叶片有不同程度的发黄,生长不健壮,所以出现不定芽所用的时间较长。因此,直接转入正常光周期下培养,对甜瓜离体外植体再生不定芽较为适宜。
3 讨论
3.1 植物激素的浓度
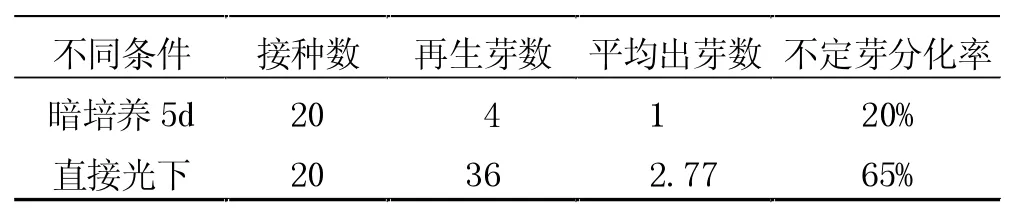
表4 不同光照条件对不定芽诱导的影响
植物的组织培养中确立最佳诱导条件是十分必要的,尤其是植物激素的浓度。本研究发现芝麻酥甜瓜品种的适宜培养基为MS+6-BA 1.0 mg/L,不需要IAA,这与陶兴林等[12]的试验结果基本相符。他们的研究也表明,在甜瓜不定芽诱导中,生长素是非必要的。这可能是由于甜瓜本身的内源生长素的含量比较高,如果再人为添加就会引起愈伤组织的发生,不利于不定芽的诱导。
细胞分裂素与生长素的比例是组织培养中激素使用的关键,应该根据培养的目的进行调节。原则上是生长素浓度明显高于细胞分裂素,则促进细胞脱分化,诱导愈伤组织,反之则促进细胞分化,但是我们在试验中发现细胞分裂素与生长素的种类对不同植物的敏感性差异很大,因此激素种类的选择应以植物种类不同而异。还发现在诱导不定芽的增殖生长中,为了使不定芽的分化保持较高的频率,加入较高浓度范围的6-BA对芽的分化有促进作用,但若6-BA浓度太高则明显抑制芽的分化,且再生芽多畸形玻璃化加重,难以发育成正常植株。此外,当6-BA浓度较高时,由于其后效应,常会抑制根的诱导,因此芽增殖后期逐渐降低细胞分裂素浓度对根的诱导是有利的。但降低幅度也不能太大,否则会抑制芽丛的生长,并且外植体有黄化现象。我们还发现同一处理中,在有的外植体表面上,仅仅维持在原来的状态,对诱导几乎没有反应;有的外植体已经形成很密的不定芽丛;而有的外植体只出现疏松愈伤组织,呈霜状或颗粒状,颜色为白色或褐色;有的外植体则同时诱导出愈伤组织和不定芽。这说明外植体对不定芽诱导有很大的影响,分析认为,同一处理中外植体表现的差异主要是由于不同外植体的自身状况导致的,包括外植体中的内源激素水平、营养水平等的差异而造成,所以在试验中,为了保持试验的准确性应该对外植体进行必要的选择,尽量保持一致。
在试验中,叶柄处诱导率较高,可能是由于叶外植体吸收培养基中的生长素和细胞分裂素主要是通过叶脉中的维管束进行的,而叶柄有较大维管束,有利于激素向叶片的运输,从而导致叶片激素浓度过高,利于愈伤组织的形成,而不利于形成不定芽,但是叶柄与培养基接触,培养基中的激素浓度有利于叶柄不定芽的形成。暗处理对许多植物的再生有促进作用,暗处理可减少外植体酚类物质的溢出,利于不定芽的分化。但是,同时黑暗条件下,有些植物外植体内积累的生长素多,促进了愈伤组织的形成和生长。而激素水平的改变和愈伤组织对养分的竞争不利于不定芽的分化。本试验结果表明,直接转入正常光周期下培养有利于外植体的再生。由于暗培养的作用比较复杂,暗处理对外植体再生芽诱导的作用机制尚需进一步研究。
3.2 甜瓜不定芽诱导过程中的玻璃化与褐化
在组培过程中经常出现的两个问题,一个是玻璃化,一个是褐化。玻璃化是组培中常见的现象,现在大多数学者的试验结果表明,玻璃化的形成与培养器皿内的水分、营养、激素有关。我们的试验中,上述所提到的玻璃化成因中只有激素水平的差异,所以出现的玻璃化现象可能是由于激素原因造成,试验得出的结果与上述一致。激素配比不同,细胞分裂素水平高的组合出现了不同程度的玻璃化。这也就再一次证明了激素是造成玻璃化的主要原因之一。
褐化的原因主要是植物组织经创伤后产生大量的酚类化合物,氧化后褐化造成。试验结果表明,低浓度的6-BA不但利于不定芽的诱导,而且畸形芽少,还可以减缓褐化程度;随着6-BA浓度的升高,褐化组织数目增加,褐化程度越重。可能是细胞分裂素刺激了多酚氧化酶的活性所致。所以,在甜瓜的组织培养过程中,在筛选了高效诱导再生的激素后,发现玻璃化、褐化现象时,应及时降低激素浓度、换用较弱的激素,既可减少褐化程度又可以减少玻璃化程度。
4 结论
在设定的20个激素组合诱导培养基中,以预培养10 d的甜瓜品种“芝麻酥”幼叶(不带叶柄)为外植体,培养在MS+6-BA 1.0 mg/L的诱导培养基上,培养条件为温度25℃,光照16 h/8 h光/暗周期,能够获得最佳不定芽诱导率,为50%。
在相同的激素组合、培养条件下,外植体取材方式对不定芽诱导率有一定影响,带0.5 mm叶柄的叶外植体不定芽诱导频率要高于不带叶柄的叶外植体(65%vs 50%)。
光照有利于甜瓜不定芽的诱导,前期黑暗培养则抑制不定芽的发生。
6-BA与IAA配合使用有利于甜瓜叶片愈伤组织的诱导,本研究中在MS+6-BA1.0 mg/L+IAA0.1 mg/L的诱导培养基上,愈伤组织诱导率最高,可达95%。
