马鞭草总苷对大鼠慢性前列腺炎/骨盆疼痛综合征的改善作用及机制研究
2022-03-29李长建焦玉涛王玉华吴春磊
李长建,焦玉涛,王玉华,吴春磊
(1.新乡医学院第三附属医院泌尿外科,河南新乡 453003;2.新乡医学院第一附属医院泌尿外科,河南新乡 453100)
慢性前列腺炎/骨盆疼痛综合征(chronic prostatitis/chronic pelvic pain syndrome,CP/CPPS)是成年男性常见的泌尿系统疾病,占慢性前列腺炎的90%以上,本病表现为不同程度的下尿路症状和性功能障碍,并伴有顽固持续性的盆腔会阴区域疼痛,严重影响患者的生活[1-2]。马鞭草(Verbena officinalisL.)为中医临床治疗前列腺炎的常用中草药,具有补肾益肝、利水消肿、润肠通便之功效[3]。马鞭草主要活性成分——马鞭草总苷对消痔灵诱导的慢性非细菌性前列腺炎(chronic nonbacterial protatitis,CNP)小鼠和大鼠模型均有较好的改善作用[4-5],因此,马鞭草总苷对CP/CPRS是否具有抗炎、镇痛作用值得进一步深入研究。p38丝裂原活化蛋白激酶(p38MAPK)信号通路与动物体内的应激反应和免疫调控密切相关,可通过调节炎性因子的活性广泛参与慢性前列腺炎疼痛的发生与发展[6]。本研究建立CP/CPPS大鼠模型,观察p38MAPK信号通路及辅助性T细胞(Th)1/Th2细胞平衡的变化,并进一步探讨马鞭草总苷对CP/CPPS的抗炎、镇痛作用及具体机制,以期为临床上CP/CPPS的治疗提供新的方法和依据,现将研究结果报道如下。
1 材料与方法
1.1 动物SPF级雄性SD大鼠45只,8周龄,体质量200~220 g,购自北京维通利华实验动物技术有限公司,动物质量合格证号:201912108,动物生产许可证号:SCXK(京)2019-1-005。实验大鼠饲养及组织取材均于新乡医学院实验动物中心完成。饲养环境:室温(23±2)℃,12 h循环明暗灯光,恒定湿度。饲养期间给予啮齿类动物标准颗粒饲料,自由饮水。
1.2 药品与试剂马鞭草总苷(总环烯醚萜苷含量为51.26%,批号:20190327),购自江苏南京青泽医药科技有限公司;吸附无细胞百白破联合疫苗(批号:20190408-3)购自武汉生物制品研究所;完全弗式佐剂,大鼠肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素8(IL-8)酶联免疫吸咐分析(ELISA)试剂盒购自美国Sigma公司;兔抗大鼠p38MAPK、p-p38MAPK多克隆抗体及基质金属蛋白酶9(MMP-9)单克隆抗体购自美国Abcam公司。
1.3 仪器IX73倒置荧光显微镜购自日本奥林巴斯光学有限公司;BD FACS Calibur流式细胞仪购自Beckman公司;Von Frey纤维丝测痛仪购自意大利Ugo Basile Srl公司;冷冻干燥机购自松源华兴有限公司;Chemi Doc XRS+System凝胶成像仪购自美国Bio-Rad公司;Multiskan Sky 450 nm酶标仪购自美国Thermo Fisher Scientific公司。
1.4 CP/CPPS大鼠模型的建立参考文献研究[7]的方法制备前列腺蛋白提纯液:处死5只雄性SD大鼠,剥离全部前列腺组织,加入等质量的生理盐水溶液制备成组织匀浆,低温离心(15 000 r/min,离心半径15 cm)30 min,收集上清,用冷冻干燥,机制备成冻干粉末(-80℃保存),临用前与适量生理盐水混合,制成1.0 mg/mL的前列腺蛋白提纯液。参考文献研究[8]的方法制备CP/CPPS大鼠模型:大鼠适应性喂养1周后,在实验的第0、7、14、28天,用10 g/L戊巴比妥钠腹腔麻醉,于大鼠盆腔区域皮下及双侧肩胛皮下多点(≥6)注射前列腺蛋白提纯液和完全弗氏佐剂(1∶1 200 μL),同时,腹腔注射0.5 mL百白破疫苗[8]。
1.5 动物分组与给药方法将造模成功的32只CP/CPPS模型大鼠按照随机数字表分为模型对照组,马鞭草总苷低、中、高剂量组,每组8只,另设8只正常大鼠作为空白对照组。在建模第30天开始进行马鞭草总苷的干预,连续22 d,每日1次。马鞭草总苷低、中、高剂量组分别对应灌胃30、60、120 mg·kg-1的马鞭草总苷[4],空白对照组和模型对照组则灌胃等体积的生理盐水。末次给药后的第2天,进行后续相关指标检测。
1.6 观察指标与方法
1.6.1 机械性异常痛敏测定末次给药后的第2天,参考文献研究[9]的方法,用Von Frey纤维丝测痛仪测定各组大鼠机械性痛阈。安静环境下,将大鼠放置在疼痛检测钢丝笼内,在适应10 min后,用Von Frey纤维丝垂直刺激其骨盆区域10次,每次进行10 s,2次刺激间隔20 s,刺激程度由轻及重(0.008~4 g),待大鼠表现出立即舔或抓蹭刺激区域、腹部急剧收缩或跳跃等阳性反应时,记录测痛仪的压力值,即为痛反应阈值(g)。
1.6.2 前列腺指数测定末次给药后第2天,各组大鼠禁食后称定体质量,处死大鼠,剥离前列腺组织并准确称质量,计算前列腺指数(前列腺指数=前列腺湿质量/体质量×100%)。
1.6.3 前列腺组织病理检查将上述获取的前列腺组织参考文献研究[10]的方法制备病理学切片。用体积分数4%甲醛溶液固定24 h,二甲苯透明,石蜡包埋,苏木素-伊红染色后,在显微镜下观察前列腺标本的组织病理学改变,分析各组大鼠前列腺的腺体结构、导管以及腺体周围间质的差异。
1.6.4 流式细胞术检测外周血Th1、Th2淋巴细胞百分比参考文献研究[11]的方法将获得的外周血进行细胞培养、活化及细胞表面抗原标记、破膜及胞内细胞因子染色。方法:100 μL外周血加入100 μL RPMI 1640培养液、刺激剂佛醇乙酯(PMA)(25 ng/mL)和离子霉素(Ion-omycin)(1 μg/mL),随后加入蛋白转运阻断剂蓝菌素A(BFA)(10 μg/mL),混匀后在体积分数5%CO2培养箱中37℃培养4 h,各加入CD3-PC5和CD8-FITC进行标记。加入Fix&Perm破膜剂分别固定、破膜和溶血。加入抗大鼠IFN-γ PE、IL-4 PE进行胞内细胞因子染色,随后上机检测。使用CD3+CD8-设门来圈定CD4+T细胞群,在收集1×104个细胞后,使用Cellquest软件分析得出Th1(CD3+CD8-/IFNγ+)和Th2(CD3+CD8-/IL-4+)的百分比及相应细胞分布。
1.6.5 ELISA法检测前列腺组织TNF-α、IL-1β及IL-8含量将上述获取的前列腺组织参考文献研究[12]的方法制备前列腺组织匀浆,4℃离心(3 000 r/min,离心半径15 cm)15 min,分离上清,严格按照TNF-α、IL-1β、IL-8试剂盒说明书步骤操作,最后应用全自动酶标仪在450 nm波长处检测光密度值,计算各指标含量。
1.6.6 蛋白免疫印迹(Western Blot)法检测前列腺组织总p38MAPK、p-p38MAPK及MMP-9的表达取前列腺组织,参考文献研究[13]的方法制备前列腺组织匀浆,提取总蛋白,用二喹啉甲酸(BCA)试剂盒进行蛋白定量。继而常规上样,聚丙烯酰胺凝胶电泳,转膜,封闭,兔抗鼠MMP-9单克隆一抗(1∶100稀释)、p38MAPK(1∶100稀释)多克隆一抗和p-p38MAPK(1∶100稀释)多克隆一抗孵育及辣根过氧化物酶标志鼠抗兔二抗(1∶2 000稀释)孵育,化学底物发光法显色,图像扫描分析,最后应用Image-QuaNT软件测量其光密度,以各β-actin为内参对照分析。
1.7 统计方法采用SPSS 21.0统计方法进行数据分析,计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析(One-way ANOVA)检验,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠前列腺组织病理变化比较图1结果显示:空白对照组大鼠前列腺组织结构完整清晰,未见水肿、充血,腺腔和间质内未见炎症细胞浸润,腺泡间纤维分布正常;模型对照组大鼠前列腺组织出现了严重的结构紊乱,可见明显的水肿和充血,腺腔内分泌物明显减少,腺腔和间质内有大量的炎症细胞浸润,腺腔壁上皮细胞明显增生;马鞭草总苷低剂量组大鼠前列腺组织可见轻微损伤破坏,可见水肿和充血,腺腔和间质内有中等量的纤维增生及炎症细胞浸润;马鞭草总苷中剂量组大鼠前列腺组织未见明显损伤破坏,未见水肿和充血,但腺腔和间质内有少量的纤维增生及炎症细胞浸润;马鞭草总苷高剂量组大鼠前列腺组织同样未见明显的损伤破坏、水肿和充血,整个前列腺基底膜较为完整,腺腔和间质未有纤维增生,但可见较少量的炎症细胞浸润。

图1 各组大鼠前列腺组织病理变化比较(HE染色法,×200)Figure 1 Comparison of histopathological changes of prostate tissues in various groups of rats(by HE staining,×200)
2.2 各组大鼠前列腺指数、机械痛阈值比较表1结果显示:前列腺指数与机械痛阈值各组间比较,差异均有统计学意义(P<0.05或P<0.01)。与空白对照组比较,模型对照组大鼠前列腺指数显著增加(P<0.05),机械痛阈值显著降低(P<0.01);与模型对照组比较,马鞭草总苷低、中、高剂量组的前列腺指数显著降低(P<0.05)、机械痛阈值均显著增加(P<0.05或P<0.01),且呈剂量依赖性。
表1 各组大鼠前列腺指数、机械痛阈值比较Table 1 Comparison of prostate index and mechanical pain threshold in various groups of rats(±s)

表1 各组大鼠前列腺指数、机械痛阈值比较Table 1 Comparison of prostate index and mechanical pain threshold in various groups of rats(±s)
①P<0.05,②P<0.01,与空白对照组比较;③P<0.05,④P<0.01,与模型对照组比较
前列腺指数/(mg⋅g-1)2.05±0.18 3.57±0.26①3.14±0.31①③2.52±0.24①③2.27±0.21③4.569 0.023机械痛阈值/g 71.22±6.75 41.57±3.98②47.59±4.41②③54.66±4.69②③66.78±5.38①④6.583 0.008组别空白对照组模型对照组马鞭草总苷低剂量组马鞭草总苷中剂量组马鞭草总苷高剂量组F值P值鼠数/只8 8 8 8 8
2.3 各组大鼠前列腺组织TNF-α、IL-1β及IL-8含量比较表2结果显示:TNF-α、IL-1β及IL-8含量各组间比较,差异均有统计学意义(P<0.05或P<0.01)。与空白对照组比较,模型对照组的TNF-α、IL-1β及IL-8含量均显著增加(P<0.01);与模型对照组比较,马鞭草总苷低、中、高剂量组的TNF-α、IL-1β及IL-8含量均显著降低(P<0.05或P<0.01),且呈剂量依赖性。
表2 各组大鼠前列腺组织TNF-α、IL-1β及IL-8含量比较Table 2 Comparison of contents of TNF-α,IL-1β and IL-8 in the prostate tissues in various groups of rats (±s,ng·g-1 prot)
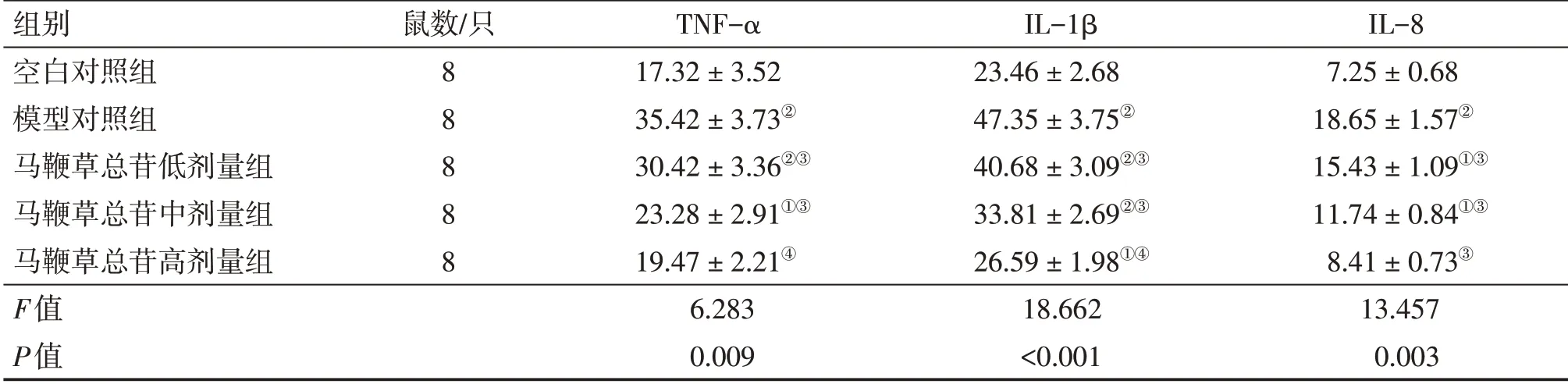
表2 各组大鼠前列腺组织TNF-α、IL-1β及IL-8含量比较Table 2 Comparison of contents of TNF-α,IL-1β and IL-8 in the prostate tissues in various groups of rats (±s,ng·g-1 prot)
①P<0.05,②P<0.01,与空白对照组比较;③P<0.05,④P<0.01,与模型对照组比较
组别空白对照组模型对照组马鞭草总苷低剂量组马鞭草总苷中剂量组马鞭草总苷高剂量组F值P值IL-8 7.25±0.68 18.65±1.57②15.43±1.09①③11.74±0.84①③8.41±0.73③13.457 0.003鼠数/只8 8 8 8 8 TNF-α 17.32±3.52 35.42±3.73②30.42±3.36②③23.28±2.91①③19.47±2.21④6.283 0.009 IL-1β 23.46±2.68 47.35±3.75②40.68±3.09②③33.81±2.69②③26.59±1.98①④18.662<0.001
2.4 各组大鼠前列腺组织p38MAPK信号通路相关蛋白表达的比较图2、表3结果显示:p38MAPK蛋白相对表达量各组间比较,差异无统计学意义(P>0.05),但p-p38MAPK、MMP-9蛋白相对表达量及p-p38MAPK/p38MAPK比值组间比较,差异有统计学意义(P<0.05)。与空白对照组比较,模型对照组的p-p38MAPK、MMP-9蛋白相对表达量及p-p38MAPK/p38MAPK比值均显著增加(P<0.05);与模型对照组比较,马鞭草总苷低、中、高剂量组的p-p38MAPK、MMP-9蛋白相对表达量及p-p38MAPK/p38MAPK比值均显著降低(P<0.05),且呈剂量依赖性。

表3 各组大鼠前列腺组织p38MAPK信号通路相关蛋白表达的比较Table 3 Comparison of expression of p38MAPK signaling pathway-related proteins in prostate tissues of various groups of rats (x±s)

图2 各组大鼠前列腺组织p38MAPK信号通路相关蛋白Western Blot电泳条带Figure 2 Western Blot electrophoretic bands of p38MAPK signaling pathway-related proteins in prostate tissues in various groups of rats
2.5 各组大鼠外周血Th1、Th2淋巴细胞百分比及Th1/Th2比值的比较表4结果显示:Th1淋巴细胞百分比及Th1/Th2比值各组间比较,差异有统计学意义(P<0.05)。与空白对照组比较,模型对照组大鼠Th1淋巴细胞百分比及Th1/Th2比值显著升高(P<0.05),Th2淋巴细胞百分比显著降低(P<0.05);与模型对照组比较,马鞭草总苷低、中、高剂量组的Th1淋巴细胞百分比及Th1/Th2比值显著降低(P<0.05),Th2淋巴细胞百分比显著升高(P<0.05),且呈剂量依赖性。

表4 各组大鼠外周血Th1、Th2淋巴细胞百分比及Th1/Th2比值的比较Table 4 Comparison of Th1,Th2 lymphocyte percentage and Th1/Th2 ratio in peripheral blood in various groups of rats (x±s)
3 讨论
慢性前列腺炎/骨盆疼痛综合征(CP/CPPS)是慢性前列腺炎的常见类型,临床主要以改善排尿不畅、缓解疼痛、提高患者生活质量为主[14]。马鞭草总苷为马鞭草中的主要活性成分。在本研究中,马鞭草总苷对CP/CPPS模型大鼠干预后,可显著保护前列腺组织,减少前列腺的纤维增生及炎症细胞浸润,同时可明显降低模型大鼠的前列腺指数,不同程度地改善前列腺增大的症状。这表明马鞭草总苷对CP/CPPS具有较好的改善作用。阴部或前列腺区域酸胀痛甚至剧痛是困扰CP/CPPS综合征患者的主要问题,在临床一直备受重视[15]。在本研究中,马鞭草总苷的干预可明显提高CP/CPPS模型大鼠的机械痛阈值,表明马鞭草总苷能够有效缓解CP/CPPS的疼痛症状。预测临床应用马鞭草可能可以有效克服CP/CPPS患者伴随的持续性、难治性的疼痛问题,故对此作用及机制我们做了进一步的探讨。
有研究表明,在Ⅲ型前列腺炎患者的前列腺液中均发现了IL-1β、TNF-α等炎症因子的升高,认为该炎性细胞因子参与了CP/CPPS的病理进展,其表达水平与CP/CPPS患者的病理性疼痛等问题密切相关[16]。在本研究中,马鞭草总苷的干预能够明显减少CP/CPPS模型大鼠前列腺组织中TNF-α、IL-1β及IL-8炎性因子的含量,并且随着剂量的增加,降低作用更明显,这与上述马鞭草总苷改善CP/CPPS模型大鼠前列腺病理进程及疼痛阈值结果相一致。p38 MAPK信号通路广泛参与了动物体内的应激反应和炎症反应,有研究表明,炎症因子TNF-α作为p38 MAPK信号通路的上游启动因子可激活p38 MAPK信号通路,使其磷酸化水平提高,继而又加剧炎性因子和MMP-9的表达,造成前列腺炎组织进一步损害[17-18]。在本研究中,马鞭草总苷干预后,CP/CPPS模型大鼠前列腺组织MMP-9蛋白相对表达量及p-p38MAPK/p38MAPK比值均显著降低,表明马鞭草总苷抑制了p38MAPK蛋白的磷酸化,其可通过调控p38MAPK信号通路降低炎症因子的表达,进而改善CP/CPPS的炎症反应和疼痛。
自身免疫和T细胞增殖反应参与了CP/CPPS的病理进程,T细胞亚群(Th1/Th2)之间的相互协调对于维持男性泌尿生殖系统的正常免疫平衡尤为重要,Th1细胞分泌的IFNγ可抑制Th2类细胞因子的产生,而Th2细胞分泌的IL-4则能够下调Th1细胞的功能[15,19]。在本研究中,马鞭草总苷干预后,CP/CPPS模型大鼠外周血Th1淋巴细胞百分比及Th1/Th2比值显著降低,表明马鞭草总苷能够调节T细胞亚群比例,对CP/CPPS过程中的Th1/Th2漂移起到恢复作用。
综上所述,马鞭草总苷能有效降低CP/CPPS模型大鼠的前列腺指数。抑制炎症反应,其作用机制可能与下调p38MAPK信号通路相关调控蛋白和调节Th1/Th2细胞亚群比例有关。本研究初步探究了马鞭草总苷治疗CP/CPPS的抗炎、镇痛作用,显示马鞭草总苷临床治疗CP/CPPS有一定的应用前景。
