慢性间歇性缺氧小鼠下颌骨三维结构及组织形态
2022-03-29张卫兵
顾 红,王 威,张卫兵,2
阻塞性睡眠呼吸暂停综合征(OSAS)是一种呼吸性睡眠障碍,其特征是上呼吸道扩张肌张力改变导致夜间反复发作上呼吸道部分或者完全阻塞,这种阻塞通常在上呼吸道呼吸存在情况下,上呼吸道气流减少或者完全停止,导致间歇性低氧血症和觉醒[1]。OSAS患者多伴有口呼吸习惯,这种习惯将改变颅面生长模式[2]。多导睡眠监测是OSAS诊断的金标准,治疗手段主要包括持续性正压通气治疗(CAPA)[3]、牵张成骨[4]、正畸/正畸-正颌联合矫治[5]等。正畸临床中口腔矫治器通过下颌前移,改善软腭或者舌位置增加气道口径来减少气道塌陷。我们通过建立慢性间歇性缺氧(CIH)小鼠模型,观察模拟OSAS的CIH小鼠下颌骨骨量变化,旨在探讨CIH对骨代谢的影响[6-7]。
1 材料与方法
1.1 材料
8周龄C57BL/6雄性小鼠12 只,体质量20~25 g,由南京医科大学动物实验中心提供,实验设计由南京医科大学动物伦理委员会批准通过,伦理号:IACUC2106015。
慢性间歇性低氧小鼠模型建立的主要试剂和仪器:苏木精-伊红染色试剂盒(碧云天,上海)、全自动脱水机(Leica,德国)、石蜡包埋机(Leica,德国)、石蜡切片机(Leica,德国)、显微镜及图像摄取(Leica,德国)、micro CT(Skyscan1176,荷兰)。
1.2 方法
1.2.1 动物模型的制备 将12只C57BL/6雄性小鼠随机分成对照(CON)组和慢性间歇性缺氧(CIH)组,每组各6 只。自由进食、饮水,适应性喂养1周后进入实验。将CIH组放置于低氧氧舱内模拟间歇性低氧,计算机控制氧气浓度,氧气浓度在正常浓度与低浓度之间循环,每120 s循环一次,每一个循环内,氧气浓度由21%左右逐渐下降到5%左右,然后再恢复到21%左右。供气瓶分为氧气瓶和氮气瓶,通过减压阀经CIH控制系统对气体进行充入和暂停。每天上午9:00开始间歇性低氧刺激,每天刺激8 h。8 h以外常规饲养。常氧组箱内氧气浓度维持21%浓度不变[8]。饲养4 周后,麻醉后断颈处死,取右侧下颌骨进行实验。
1.2.2 micro CT观察小鼠下颌骨三维结构 每组选择6 只小鼠,麻醉后断颈处死,取右侧下颌骨,冲洗后置于多聚甲醛固定液固定24 h后,流水冲洗过夜,将样本置于固定器内以15.6 μm层厚进行micro CT扫描,扫描参数55 kVp,83 μA。
使用Skyscan分析软件进行三维重建和数据分析。扫描后所得数据首先用Data Viewer软件调整下颌骨位置,使所有下颌骨组织均为外侧面朝前,内侧面朝后,咬合面朝上。再使用CT Vox软件进行图像重建,设定感兴趣区域(ROI)为小鼠第一磨牙牙槽间隔区域的松质骨。最后用CTAN软件对目标ROI进行三维重建,并对选定区域进行骨骼分析。得到下颌骨感兴趣区域内松质骨的各项骨结构进行测算,观察指标包括:骨骼体积/组织体积(bone volume/total volume, BV/TV),骨小梁厚度(trabecular thickness,Tb.Th),骨小梁数量(trabecular number,Tb.N),骨小梁间距(trabecular separation,Tb.Sp)[9]。
1.2.3 苏木精-伊红染色观察脱钙后小鼠下颌骨组织形态 取缺氧组和对照组各6只小鼠的下颌骨多聚甲醛固定,10%EDTA脱钙1个月,常规脱水,石蜡包埋后,制作连续切片。石蜡切片脱蜡至水,苏木精染色5 min,水洗,1%盐酸乙醇消化1~2 s,流水冲洗,镜下看细胞核是否着色,伊红染色1 min,看着色程度,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜观察下颌骨组织变化。
1.3 统计学方法
2 结 果
2.1 实验动物数量分析
纳入小鼠共12 只,全部进入结果分析,无死亡和感染。
2.2 间歇性缺氧小鼠下颌骨松质骨显微结构变化
慢性间歇性缺氧4 周后,实验选取小鼠下颌骨第一磨牙牙槽间隔的松质骨为感兴趣区域,如图1中黑色实线框所示,从三维重建的影像来比较慢性间歇性缺氧组和对照组形态差异,结果显示缺氧组下颌骨发生骨质破坏,下颌体、下颌支、下颌角骨质较对照组有明显的骨质吸收。
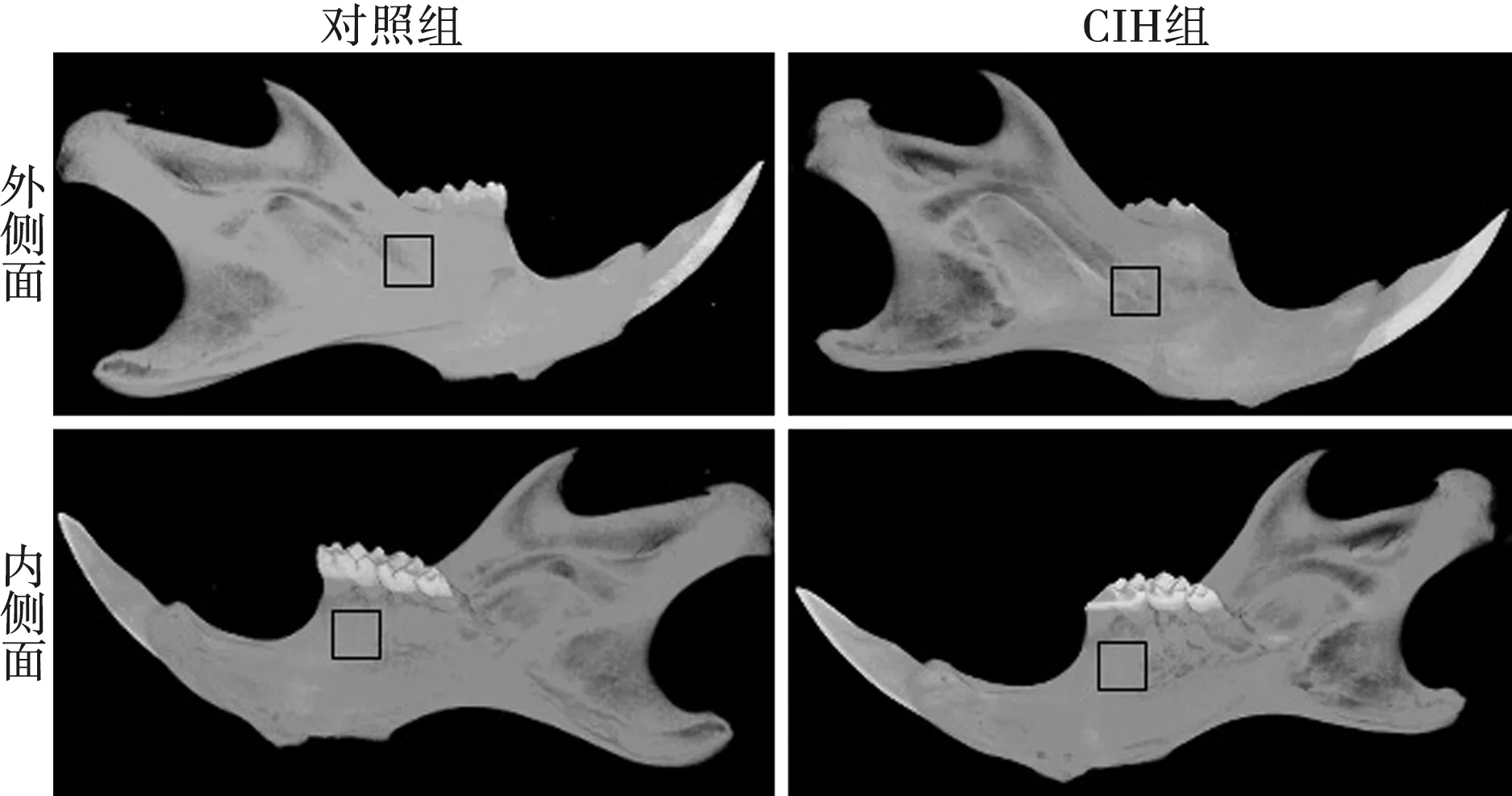
图1 对照组及CIH组小鼠下颌骨的三维重建图像Fig.1 Three-dimensional reconstruction image of the mandible in the control group and CIH group
图2显示慢性间歇性低氧组较对照组,骨小梁体积变小,数量减少。通过对感兴趣区域进行三维重建,并对该区域进行骨骼参数分析,结果显示与对照组相比,CIH组下颌骨感兴趣区域内松质骨骨骼体积/组织体积、骨小梁数量、骨小梁厚度及骨小梁均显著性减少,骨小梁间距显著性增加(P<0.05),见图3。
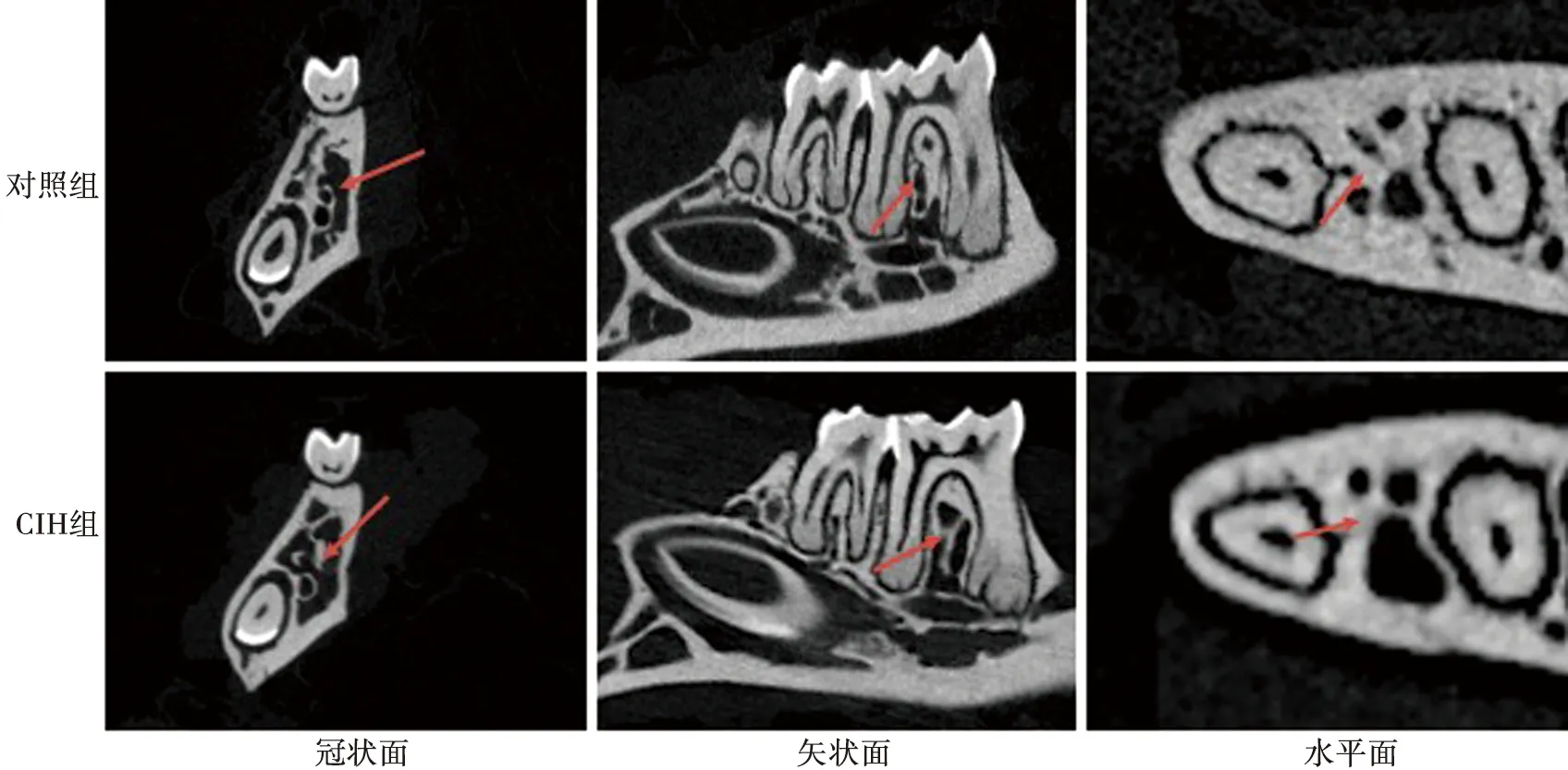
图2 对照组和CIH组下颌第一磨牙感兴趣区域CT平扫图像Fig.2 CT scanning image of the region of interest in the first molar of mandible bone in the control group and CIH group
2.3 两组小鼠下颌骨松质骨组织形态
苏木精-伊红染色显示,慢性间歇性低氧组小鼠下颌第一磨牙根分叉区域的牙槽骨骨量下降,板层状骨减少,形成不规则小梁骨,骨髓腔细胞排列紊乱。下颌骨松质骨骨小梁数目减少,体积变小,见图4。
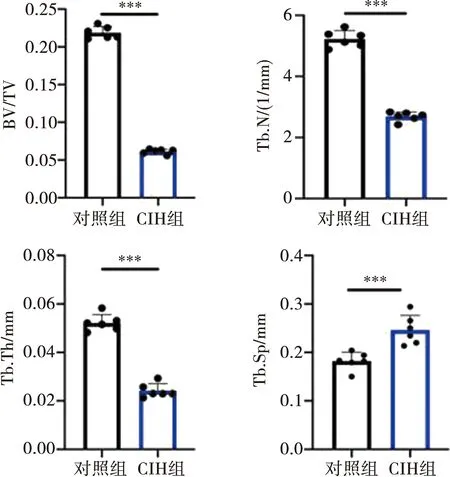
***:P<0.05
3 讨 论
下颌骨的生理结构正畸牙移动的基础,牙齿在力的作用下,在下颌骨内缓慢移动。下颌松质骨和骨小梁排列成轨道以及肌力轨道,骨小梁的粗细,数目以及排列与力学功能密切相关[10]。
OSAS是一种常见疾病,目前研究表明OSAS与骨代谢存在一定的关联性[11],青少年OSAS患者通常伴有骨发育异常、继发性骨质疏松[12],而中老年OSAS患者多有骨质疏松,增加了骨折的风险[13]。OSAS多见于老年患者中,但是也会影响年轻人群,尤其是一些患有腺样体/扁桃体肥大的人群中,儿童肥胖的患病率越来越高,因此OSAS在年轻人中也越来越普遍。通过多导睡眠监测,约45%的中重度肥胖青少年被诊断出OSAS[14]。青少年患者处于生长发育高峰期,如果患有OSAS,睡眠质量差,代谢紊乱,性腺功能减退,骨骼很容易受到影响,无法达到峰值骨骼质量,加速了骨量损失,最终导致骨量低下。因此早期对这个问题进行纠正,有利于骨骼重建,纠正骨骼质量、结构、强度不足的问题[15]。然而OSAS是否会影响下颌骨改建的研究报道甚少。
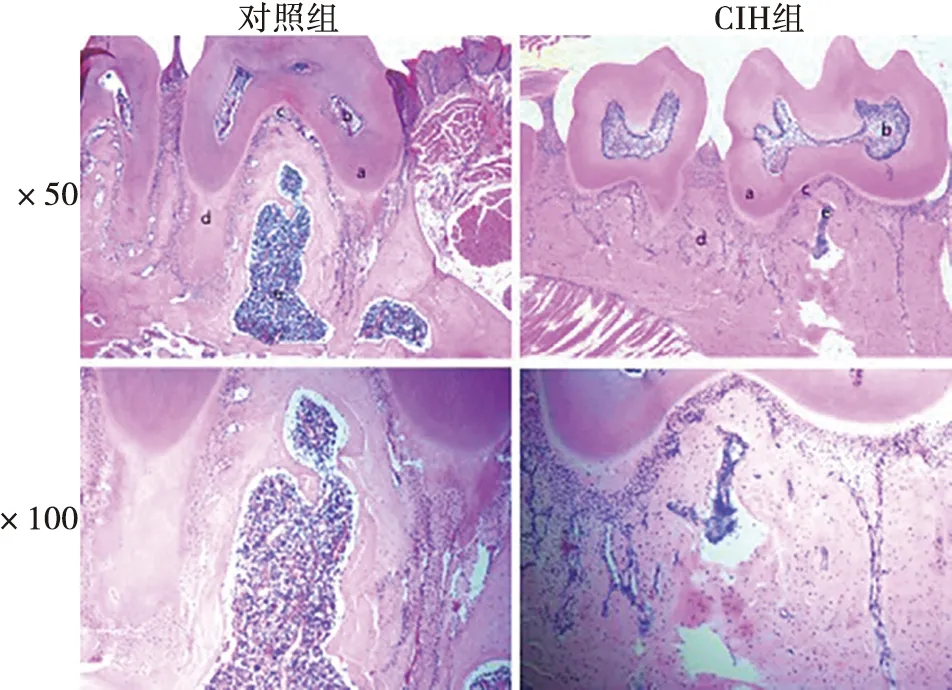
a:牙本质;b:牙髓腔;c:牙周膜;d:牙槽骨;e:骨髓腔; 与对照组相比,CIH组小鼠下颌骨松质骨骨小梁数目减少
本研究选择8周龄雄性小鼠为研究对象,避免性别对结果产生影响。机械应力通过调控骨改建来影响骨小梁以及结构,骨小梁的结构、排列影响正畸[16],因此选择了生长期小鼠的磨牙区进行下颌骨骨微结构分析。micro CT技术通过三维重建,能从骨的质和量反应骨小梁数量、结构改变,尤其是松质骨骨微结构改变提供了精确完善的数据,被广泛应用于骨量和骨形态学的各项研究[17]。
实验结果发现,与对照组相比,慢性间歇性缺氧组下颌骨松质骨骨量显著下降,提示慢性间歇性缺氧组颌骨的强度受到了影响。对于OSAS患者,夜间反复缺氧,缺氧和骨代谢异常有一定的相关性。研究表明,缺氧能阻断成骨细胞的生长和分化,并能刺激破骨细胞的生成,增强破骨细胞的活性,增加骨的重吸收[18]。缺氧时HIF-1α明显上调,直接刺激增强破骨细胞活性,抑制间充质干细胞成骨、成脂分化,并能阻止PTH在成熟骨骼中的骨代谢[19-21]。缺氧会在体内形成一个酸性环境,这种环境能激活破骨细胞并且抑制成骨细胞的矿物质沉积[18]。缺氧常伴随着氧化应激,氧化应激是体内氧化和抗氧化作用失衡的一种状态,与骨吸收和骨量低密切相关[22]。
由于OSAS患者常夜间觉醒,白天嗜睡,身体的生物节律被破坏,而成骨细胞和破骨细胞均有昼夜节律性,会受到昼夜节律的破坏和睡眠不足的影响[23]。
大多数文献显示OSAS患者的血清中,瘦素水平升高[24],食欲素和褪黑素水平下降[25]。褪黑素能激活交感神经,高水平的瘦素会产生低骨质量表型,瘦素缺陷有高骨质表型[26]。食欲素在OSAS患者低骨量中也发挥了作用,食欲素基因敲除小鼠的骨量明显减少,骨形成速率低下,矿物质沉积率下降,成骨细胞数量减少,破骨细胞数目不变,抑制骨形成[27]。褪黑素在睡眠和调节昼夜节律方面也起着重要作用,在小鼠研究中,褪黑素能通过清除局部骨吸收产生的自由基破坏破骨细胞的功能,促进MSC分化为成骨细胞[22],而OSAS患者的昼夜节律被打破,褪黑素分泌受到干扰,有可能对骨骼产生负面影响[15]。
综上所述,长期慢性间歇性低氧将会导致小鼠骨松质结构发生改变,但是其具体引起下颌骨乃至全身骨骼结构改变的具体机制有待进一步研究。
