苦瓜皂苷与乳清蛋白水解物协同对二肽基肽酶-IV的抑制活性
2022-03-28于海坤热罕古丽吴尚仪陈佳丽夏扣娜李墨翰岳喜庆
于海坤,热罕古丽,吴尚仪,陈佳丽,夏扣娜,李墨翰,岳喜庆
(沈阳农业大学食品学院,辽宁沈阳 110866)
糖尿病是一种以高血糖为特征的代谢内分泌疾病,主要由胰岛素分泌绝对或相对不足、胰岛素抵抗而引起的[1,2],通常伴有多种慢性并发症,导致多种器官系统严重受到损害,发病率极高,已成为一种常见且多发的疾病,对人类健康产生严重危害[3,4]。据国际糖尿病联盟(IDF)统计显示,全球患糖尿病成人在2013年约有3.87亿人,2019年已增至4.63亿人,预计到2030年将超过5亿,2045年高达7亿左右[5]。目前临床上对糖尿病的治疗以口服降糖药物和胰岛素治疗为主,如双胍类[6,7]、促胰岛素分泌剂类[8,9]、α-葡萄糖苷酶抑制剂类[10,11]、噻唑烷二酮类[12]、磺酰脲类等[13]。使用口服降糖药在维持血糖控制方面有一定的效果,但不能预防糖尿病的长期并发症,长期使用会伴有严重副作用[14,15]。而天然来源的二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)抑制剂能够延长肠促胰岛素的有效时间,降低餐后血糖浓度,具有安全性能高,不易诱发体重增长、低血糖等不良反应,有效性及耐受性较好等优点,是近些年新兴治疗二型糖尿病的一种方法[16,17]。因此毒副作用低且具有降低血糖活性的天然植物及其生物活性成分、功能因子是目前的研究热点。
苦瓜享有“植物胰岛素”之称,其主要生物活性成分是皂苷和多糖,在降血糖方面有较好的功效,是迄今为止受赞誉最多、辅助治疗糖尿病研究最广泛的植物之一[18]。其中苦瓜皂苷(momordica saponins,MS)能够一定程度上改善胰岛素抵抗和增加胰岛素敏感性能[19,20],同时可以修复受损β细胞[21],抑制肠道对葡萄糖的吸收[22]。此外,MS与其他降糖药叠加使用可以更好的血糖控制。牛乳是一种低血糖指数(glycemic index,GI)食品,牛乳中的乳清蛋白可以显著提高糖尿病人高 GI饮食时的胰岛素水平,具有稳定餐后血糖水平的作用[23]。临床证实,乳清蛋白水解物比乳清蛋白本身更有助于糖尿病人的血糖控制[24],乳清蛋白水解物中的生物活性肽具有抑制DPP-IV的活性、抑制α-葡萄糖苷酶活性、改善胰岛素抵抗等作用[25],通过促进胰高糖素肽分泌、提升肠促胰素含量、调节血糖、控制食物的摄入等降低餐后的血糖水平[26,27]。然而,苦瓜皂苷与乳清蛋白水解物协同降血糖的作用尚未见报道。目前对于糖尿病的治疗早已不单单依赖调节血糖药物,而是通过药物控制血糖,同时结合合理的膳食及适度的运动,因而寻找天然来源的DPP-IV抑制剂具有较高的研究价值,动物源抑制剂与植物源抑制剂协同作用调节血糖有待进一步研究。
本文研究乳清蛋白胃蛋白酶水解物(whey protein pepsin hydrolysates,WPPHs)、乳清蛋白胰蛋白酶水解物(whey protein trypsin hydrolysates,WPTHs)及MS的DPP-IV抑制活性,并进行协同试验,测定消化后水解物及MS的DPP-IV抑制活性变化,并对其消化特性进行评估,旨在通过此研究补充动植物源抑制剂协同作用调节血糖作用机理,进一步推进 DPP-IV抑制类降血糖功能性产品开发进程。
1 材料与方法
1.1 材料与试剂
苦瓜皂苷粉,市售苦瓜皂苷粉(皂苷含量为10%);分离乳清蛋白粉(92%,食品级),新西兰恒天然公司;邻苯二甲醛(OPA),国药集团化学试剂有限公司;胃蛋白酶(酶活力≥250 U/mg),上海麦克林生化科技有限公司;胰蛋白酶(酶活力≥250 U/mg),鼎国生物技术有限责任公司;DPP-IV抑制活性试剂盒,Abnova艾美捷科技有限公司
1.2 仪器与设备
JB-1型磁力搅拌器,天津市欧谱仪器仪表有限公司;VS-1涡旋仪,北京中时维兴仪器设备公司;CR-21G离心机,日立公司;荧光酶标仪,Eppendorf公司;FD5-3型真空低温冷冻干燥机,上海龙捷仪器有限公司;7200-紫外-可见分光光度计,尤尼柯有限公司。
1.3 实验方法
1.3.1 乳清蛋白水解
乳清蛋白→配成质量浓度为0.05 g/100 mL溶液→水浴处理(80 ℃10 min)→加蛋白酶水解→调节pH值→灭酶(90 ℃10 min)→冷却至室温→离心→取上清液备用
1.3.2 单因素试验设计
以水解度及DPP-IV抑制率作为评价指标,在不同影响因素下对胃蛋白酶和胰蛋白酶的水解条件进行优化,优化实验设计如表1所示。

表1 胃蛋白酶、胰蛋白酶水解条件优化单因素试验Table 1 Single factor test for optimizing hydrolysis conditions of pepsin and trypsin
1.3.3 响应面试验
根据单因素试验结果,选取 pH值(A)、酶解时间(B)、不同酶添加量(C)为自变量,以DPP-IV抑制率为响应值,根据Box-Behnken中心组合设计原理设计响应面分析试验,试验因素与水平设计见表2、3。

表2 胃蛋白酶水解条件优化响应面试验因素与水平Table 2 Factors and levels of response surface experiment for optimization of pepsin hydrolysis conditions
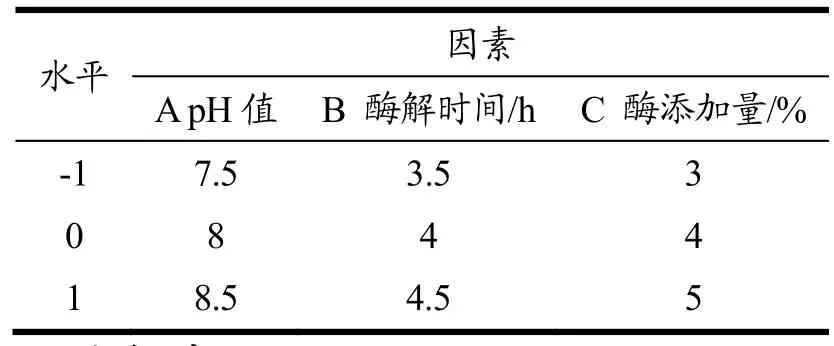
表3 胰蛋白酶水解条件优化响应面试验因素与水平Table 3 Factors and levels of response surface experiment for optimization of trypsin hydrolysis conditions
1.3.4 水解度测定
将400 μL去离子水、丝氨酸标准溶液、样品溶液分别加入到盛有3 mL OPA试管中作为空白样、标准样、样品,精准反应2 min,立即测定其在340 nm波长下的吸光度。为避免试验顺序对结果产生影响,在试验开始、结束时分别测定丝氨酸标准样吸光值,试验重复3次并取均值。水解度如下式计算:
式中:
h——水解肽键数;
htot——总肽键数;
ODS1——样品吸光值;
ODS2——标准样丝氨酸吸光值;
ODB——空白样去离子水吸光值;
M——丝氨酸溶液浓度,mol/L;
X——样品中蛋白质含量。
1.3.5 DPP-IV抑制率测定
参考 Matheeussen等[28]的方法略有修改。将DPP-IV分析缓冲液、人重组 DPP-IV(DPP-IV与DPP-IV分析缓冲液体积比为 1:5)、质量浓度为 1 mmol/L西他列汀阳性对照抑制剂、DPP-IV底物按顺序准确移取至96孔板中,加样量见表4。
放置烘箱中37 ℃温育30 min,在激发波长为355 nm、发射波长为460 nm的荧光酶标仪中测定其荧光强度,DPP-IV抑制率按下式计算:
式中:
I——样品DPP-IV抑制率;
OD1——阴性对照组荧光吸光度;
OD2——样品组荧光吸光度。
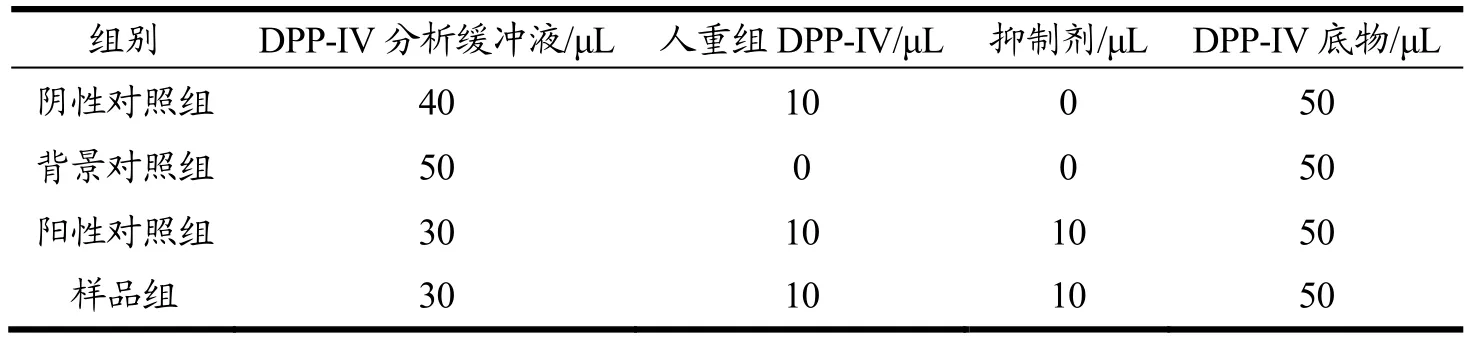
表4 各试剂添加量和顺序Table 4 Addition amount and order of each reagent (unit: μL)
1.3.6 与乳清水解物协同作用
将浓度为1 mg/mL乳清蛋白胃蛋白酶水解物、乳清蛋白胰蛋白酶水解物分别与0.2 mg/mL、1 mg/mL、5 mg/mL MS混合均匀,以DPP-IV抑制率作为指标考察其协同作用。
1.3.7 胃肠道消化模拟试验
模拟胃消化:取适量样品在 5%甲酸中溶解为质量浓度为1 mg/mL溶液,胃蛋白酶添加量为1%,在37 ℃条件下孵育1 h。在100 ℃水中加热5 min后停止反应,每种样品至少重复三次试验。
模拟肠道消化:取适量样品溶解于磷酸盐缓冲液(pH=7.0),其中弹性蛋白酶、胰蛋白酶、糜蛋白酶添加量分别为0.2%、1%和1%,在37 ℃条件下孵育1 h。在100 ℃水中加热5 min后停止反应,每种样品至少重复三次试验[29]。
1.4 数据处理
所有实验均至少重复 3次,数据以平均值±标准差的形式表示,选用SPSS(version 22.0)统计分析及Design-Expert 8.0.6进行数据处理,当p<0.05时认为该数据在统计学意义上具有显著性差异。
2 结果与讨论
2.1 单因素试验
2.1.1 酶解时间对乳清蛋白水解度及 DPP-IV抑制率的影响
由图1可知,在试验时间范围内,胃蛋白酶、胰蛋白酶水解乳清蛋白的水解度呈递增趋势(p<0.05),在不同时间段内水解度增大趋势存在明显差异,刚开始水解时由于酶可作用的肽键数较多,水解度增加明显,底物浓度随着水解时间延长而降低,可被催化的酶切位点逐渐减少,导致水解度增加趋势减缓。水解物 DPP-IV抑制率的变化趋势为先上升后下降,WPPHs、WPTHs的DPP-IV抑制率分别在2 h时、4 h时最高,DPP-IV抑制率均为14.05%,随着酶解时间逐渐延长DPP-IV抑制率显著下降(p<0.05),与吉薇[30]对南极磷虾蛋白源 DPP-IV抑制肽的研究结论一致。可能是蛋白质水解生成的肽含量增多,DPP-IV抑制率不断上升,但持续水解,酶解程度过大,导致得到活性多肽进一步水解成氨基酸,多肽含量降低,DPP-IV抑制活性也随之降低[31]。
2.1.2 水解pH值对乳清蛋白水解度及DPP-IV抑制率的影响
不同蛋白酶存在最适pH范围,由图2可知,胃蛋白酶、胰蛋白酶水解乳清蛋白水解度及水解物DPP-IV抑制率随pH值增加均呈现出先上升后下降的趋势。pH值分别在2.5、8时,二者均达到最大值,随着pH值继续增大水解度及DPP-IV抑制活性显著降低(p<0.05),与刘利军等[32]在酶法水解乳清蛋白过程中对pH的优化研究结果相近。出现此现象的原因可能是pH影响酶分子的构象以及酶与底物的结合和催化,在酸碱不适宜条件下,维护酶三维结构的许多非共价键受到干扰,使蛋白酶的空间构型产生变化,导致酶活力降低甚至失活[33];推测也可能是DPP-IV抑制肽的结构发生变化使其活性下降。因此胃蛋白酶、胰蛋白酶水解乳清蛋白最优pH值分别为2.5和8。
2.1.3 酶添加量对乳清蛋白水解度及 DPP-IV抑制率的影响
由图 3可知,胃蛋白酶、胰蛋白酶水解乳清蛋白水解度随着酶添加量增加呈上升趋势,在 2%~4%与5%~6%时水解度显著增高(p<0.05)。酶添加量较小时,底物浓度过高,底物大多都堆积在酶活动中心,阻碍产物分子的扩散及水解速度;酶添加量适宜时,酶能够很好地作用于均匀分布在酶周围的底物,水解度增加;酶添加量过大时,虽然底物分散的更均匀,酶的浓度却降低,酶解反应速度减缓[34]。水解物DPP-IV抑制率呈现先上升后下降趋势,随着酶添加量的增加,蛋白质逐渐分解,DPP-IV抑制率增大,在4%时DPP-IV抑制活性达到最大,WPPHs、WPTHs的DPP-IV抑制率分别为15.18%、14.97%。继续添加蛋白酶后,蛋白分子水解完全,导致 DPP-IV抑制活性的多肽分子减少,这与Nongonierma等[35]的结论相似。
2.2 胃蛋白酶、胰蛋白酶水解乳清蛋白响应面试验结果
2.2.1 胃蛋白酶水解乳清蛋白响应面设计方案及实验结果
响应面因素水平设计方案及结果见表 5。将数据进行二次多项式回归拟合,得各因素回归方程为:Y=15.45+0.95A-0.23B+0.43C+0.35AB+0.51AC+0.78B C-1.08A2-0.92B2-2.24C2,利用Design-Expert 8.0.6 软件对试验结果进行方差分析,结果见表6。

表5 胃蛋白酶水解乳清蛋白响应面试验设计与结果Table 5 Design and results of response surface test of pepsin hydrolysis of whey protein
由表6可知,该回归模型F值为28.36,p<0.01,差异极显著,失拟项F值为1.78,p>0.05,差异不显著,且R2为0.9733,R2adj为0.9390,表明该WPPHs模型成立且设计合理。由 F值可以判断出各因素对WPPHs的DPP-IV抑制率的影响顺序为:pH值(A)>酶添加量(C)>酶解时间(B)。
在响应面分析中,响应面曲面倾斜度、等高线形状反映交互作用的程度,响应面曲面越陡、等高线形状越接近椭圆形因素间的交互作用显著,反之,则交互作用不显著[36,37]。通过对图4中的响应面及等高线的形状分析发现,与AB相比,AC、BC等高线的形状更接近椭圆形,响应面倾斜度更陡峭,因此判断酶添加量与pH值及酶解时间之间的交互作用比pH值与酶解时间之间的交互作用对DPP-Ⅳ抑制率影响较显著。
2.2.2 胰蛋白酶水解乳清蛋白响应面设计方案及实验结果
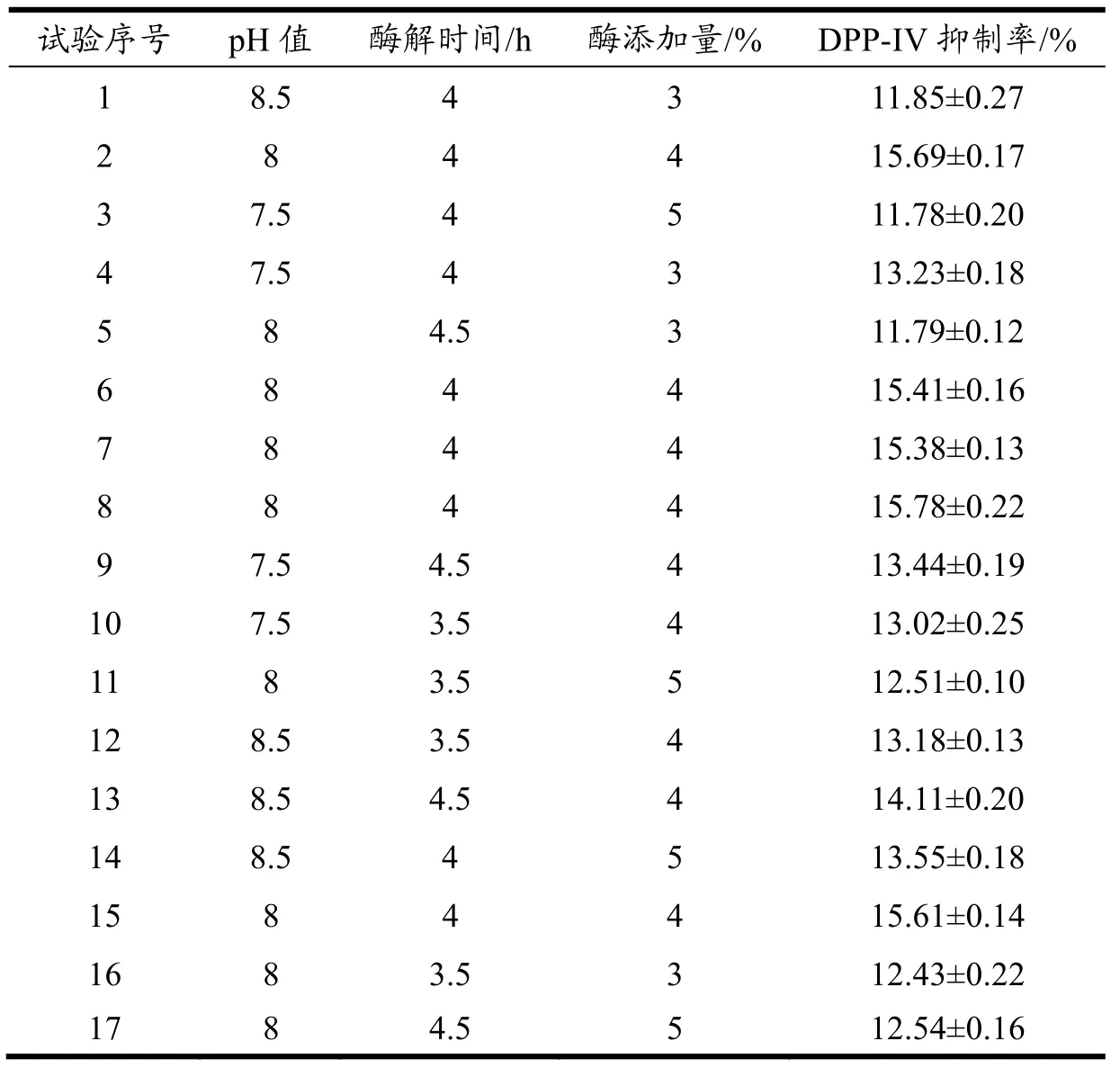
表7 胰蛋白酶水解乳清蛋白响应面试验设计与结果Table 7 Design and results of response surface test for trypsin hydrolysis of whey protein
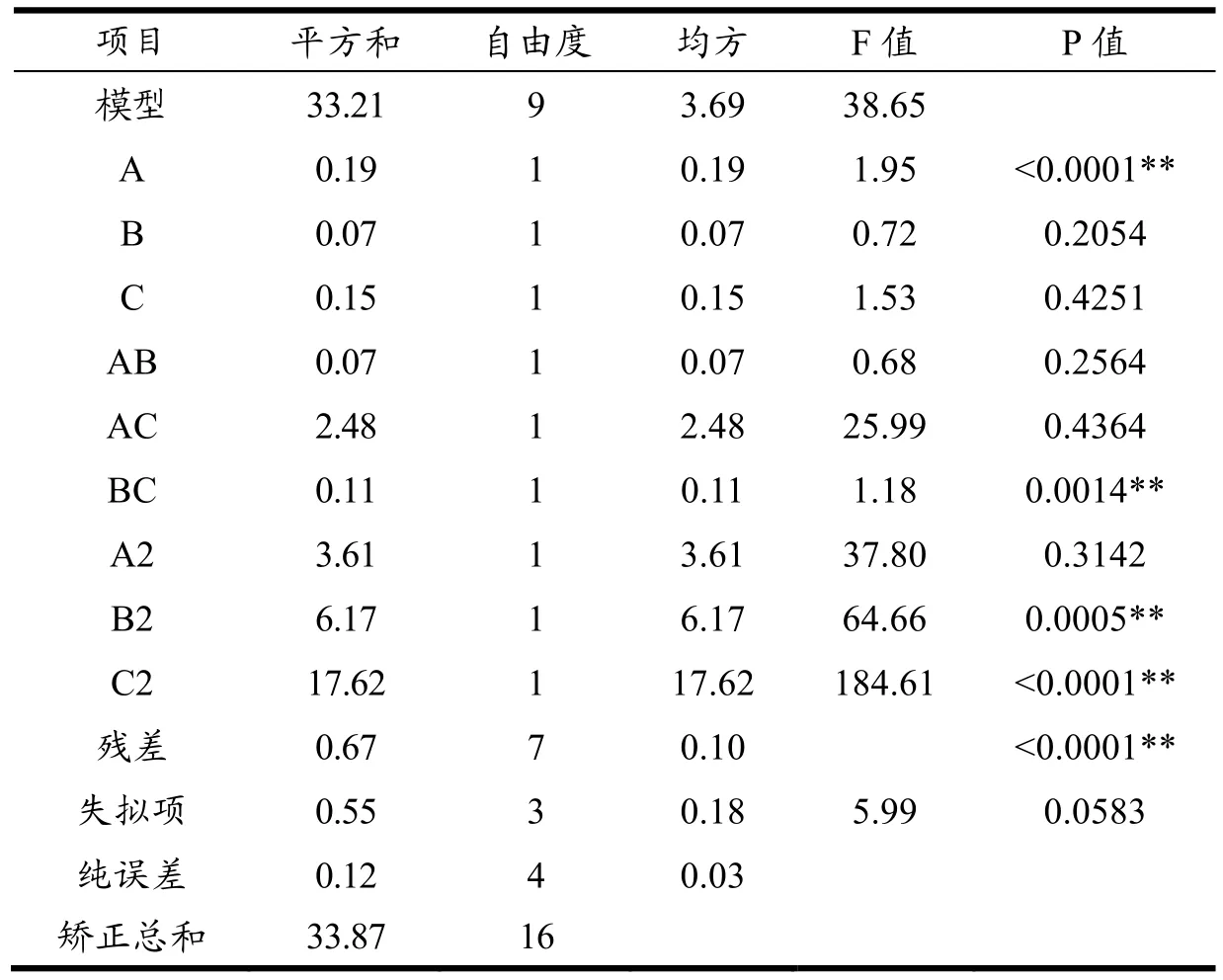
表8 乳清蛋白胰蛋白酶水解物DPP-IV抑制活性回归模型方差分析Table 8 Regression model variance analysis to inhibition rate of DPP-IV of pepsin hydrolysis
响应面因素水平设计方案及结果见表 7。将数据进行二次多项式回归拟合,得各因素回归方程为:Y=15.57+0.15A+0.092B+0.14C+0.13AB+0.79AC+0.17 BC-0.93A2-1.21B2-2.05C2,利用Design-Expert 8.0.6软件对试验结果进行方差分析,结果见表8。
由表8可知,该回归模型F值为38.65,p<0.01,差异极显著,失拟项F值为5.99,p>0.05,差异不显著,且R2为0.9803,R2adj为0.9549,表明该WPTHs模型成立且设计合理。由 F值可以判断出各因素对WPTHs的DPP-IV抑制率的影响顺序为:pH值(A)>酶添加量(C)>酶解时间(B)。
由图5可知,pH值与酶添加量及酶解时间与酶添加量之间的交互作用响应面倾斜度更陡峭,等高线的形状更接近椭圆形,说明它们二者的交互作用对WPTHs的DPP-IV抑制率的影响较大,pH值与酶解时间的交互作用影响较小,与表8的方差分析结果一致。
2.2.3 水解最优工艺条件及结果验证
通过响应试验分析得出乳清蛋白胃蛋白酶水解优化通过回归方程求解得到最佳提取工艺条件为pH值2.74、酶解时间2.02 h、酶添加量4.15%,根据实际操作调整为pH值2.7,酶解时间2 h,酶添加量4%。按照优化条件进行重复验证试验,结果取均值得此水解物的DPP-IV抑制率为15.43%,与预测值相对误差仅为 0.28%,说明实验结果可靠;对乳清蛋白胰蛋白酶水解优化,通过回归方程求解得到最佳提取条件为pH值7.57、酶解时间3.99 h、酶添加量3.87%,根据实际操作调整为pH值7.6、酶解时间4 h、酶添加量4%。据以上最优条件进行验证可得此水解物的DPP-IV抑制率为14.62%,与预测值14.80%几乎一致,充分验证了试验效果较好。
2.3 DPP-IV抑制率测定结果
将优化条件下得到的WPPHs、WPTHs及MS分别配置成质量浓度为1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL、5 mg/mL,测定其DPP-IV抑制率。WPPHs质量浓度与其 DPP-IV 抑制率的拟方程为y=0.0864x+0.0014(R2=0.9992);WPTHs质量浓度与其 DPP-IV抑制率拟方程为 y=0.0685x+0.0012(R2=0.9990);MS质量浓度与其DPP-IV抑制率的拟方程为 y=0.0955x+0.0036(R2=0.9992),将抑制率为50%代入公式可得胃蛋白酶水解物抑制 DPP-IV的半抑制浓度(half maximal inhibitory concentration,IC50)为5.77 mg/mL;胰蛋白酶水解物抑制DPP-IV的IC50为 7.28 mg/mL;MS抑制 DPP-IV 的 IC50为 7.28 mg/mL,与文献报道结论相似[38,39]。
2.4 MS与乳清水解物协同作用研究
由图6可知,将不同剂量MS与WPPHs和WPTHs的DPP-IV抑制率进行比较可得:MS剂量不断提高,MS的DPP-IV抑制率也逐步上升;低剂量和高剂量组MS与水解物混合物DPP-IV抑制率较两种成分抑制率单独累积相比无显著性差异;而中剂量组MS与水解物混合物具有一定的协同作用,MS与 WPPHs和WPTHs复配的DPP-IV抑制率较两种成分单独累积相比,DPP-IV抑制率分别提高6.54%与3.76%。由此推测,当MS与水解物体积比为1:1时具有一定的协同作用,其混合物抑制作用效果显著高于两者单独累加(p<0.05)。水解物占比过高时,抑制率主要取决于水解物或两种成分的单独作用,因此未产生相互作用与影响;当MS的占比过高时,水解物因含量较少从而未能表现出协同作用。
2.5 胃肠道消化模拟实验
由图7可知,WPPHs、WPTHs及MS经过模拟胃肠道消化后 DPP-IV抑制率均发生显著改变(p<0.05)。WPPHs的DPP-IV抑制率经胃消化后降低2.02%,而经肠道消化后DPP-IV抑制率却升高2.23%,推测可能肠道内的酶对WPPHs进一步水解,使得具有DPP-IV抑制活性的肽段含量大幅度增加,因此其抑制作用增强;WPTHs的DPP-IV抑制率经胃消化后升高0.99%,但是经过肠道消化后DPP-IV抑制率降低 4.12%,推测消化过程有新的酶参与水解,使水解物的组成成分发生变化,有部分肽链断裂导致新的小分子多肽生成[40];MS的DPP-IV抑制率经胃消化后显著升高7.01%,经肠道消化后降低2.70%,推测可能是 pH值对 MS的抑制效果产生了影响。Velarde-Salcedo等[41]研究的苋菜蛋白水解物及董宇婷[38]研究的燕麦多肽水解产物在经过胃肠消化后DPP-IV抑制率出现一定程度的下降;张颖等[42,43]对牛羊乳酪蛋白、鲢鱼水解产物研究发现,在经过体外消化后 DPP-IV抑制活性并没有显著的变化;而Nongonierma等[35]及Huang等[44]分别对乳清蛋白胰酶酶解物、三条金枪鱼肉蛋白水解物的研究过程中发现,胃肠模拟消化会显著增加其水解产物的DPP-IV抑制活性。经肠胃消化后不同来源于蛋白水解物 DPP-IV抑制活性稳定性存在差异,可能与所含的关键有效活性肽组分的氨基酸序列结构有关。
3 结论
通过单因素试验及响应面试验确定了WPPHs及WPTHs具有DPP-IV抑制活性。当pH值2.7,酶解时间2 h,酶添加量4%时,WPPHs的DPP-IV抑制率最高为15.43%,IC50为5.77 mg/mL;当pH值7.6、酶解时间4 h、酶添加量4%时,WPTHs的DPP-IV抑制率最高为14.62%,IC50为7.28 mg/mL,胃蛋白酶水解物的抑制活性高于胰蛋白酶水解物。实验研究发现MS也具有DPP-IV抑制活性,IC50为5.20 mg/mL,MS与WPPHs和WPTHs复配体积比为1:1时还具有协同抑制DPP-IV活性作用,DPP-IV抑制率分别提高6.54%与 3.76%,其抑制效果显著高于两者单独累加(p<0.05)。通过体外试验可知,WPPHs的DPP-IV抑制率经胃消化后显著下降(p<0.05),经肠道消化后DPP-IV 抑制率却显著升高(p<0.05),而 WPTHs及MS胃肠消化后结果则相反。试验为动植物源DPP-IV抑制剂研究提供了新思路,也为DPP-IV抑制类降血糖功能性产品开发提供了理论依据和科学参考。
