大王马先蒿对四氯化碳诱导肝纤维化小鼠的保护作用*
2022-03-28张春雷吴新玉王栋陆倩董莉张金娟廖尚高
张春雷,吴新玉,王栋,陆倩,董莉,张金娟,廖尚高
(1.贵州医科大学药学院,省部共建药用植物功效与利用国家重点实验室,贵安新区 550025;2.贵州医科大学民族药与中药开发应用教育部工程研究中心/贵州省药物制剂重点实验室,贵阳 550004;3.贵州医科大学基础医学院,贵安新区 550025)
肝纤维化是指由化学毒物性损伤、慢性肝炎病毒感染、自身免疫性肝病、酗酒等因素引起的以肝内结缔组织非正常增生为主要特征的病理生理过程[1]。中药治疗肝纤维化具有疗效高、低毒副反应、费用低等优点,逐渐得到人们的重视[2]。TGF-β1/Smad信号通路在肝纤维化的发生及发展中具有重要作用,调控层粘连蛋白(laminin,LN)、透明质酸(hyaluronic acid,HA)及羟脯氨酸等蛋白的表达,最终导致肝纤维化的发生与进展[3]。α-平滑肌肌动蛋白(α-SMA)是肝纤维化活化的标志物,Ⅰ型胶原蛋白(Collagen I)主要反映肝纤维化程度[4]。大王马先蒿(PedicularisrexC.B.,PR)为玄参科(Scrophulariaceae)马先蒿属(Pedicularis)植物,临床上用于慢性肝炎、肝硬化腹水等症的治疗[5-6],现代研究表明,大王马先蒿的化学成分主要为苯丙素、环烯醚萜、黄酮等[7]。基于肝纤维化是肝硬化的早期阶段,笔者推测对肝硬化或肝硬化腹腔积液有疗效的药物可能对肝纤维化有效。因此,本研究拟进一步通过建立四氯化碳(CCl4)诱导的小鼠肝纤维化模型,探讨大王马先蒿对CCl4诱导的小鼠肝纤维化体内作用,为大王马先蒿抗肝纤维化的临床应用及相关药物的研发奠定基础。
1 材料与方法
1.1动物 清洁级昆明小鼠,60只,雄性,体质量(20±2) g,由贵州医科大学实验动物中心提供,实验动物生产许可证号SCXK(黔)2018-0001;自由饮水,光照12 h/黑暗12 h,温度18~22 ℃,相对湿度50%~60%条件下饲养,适应性饲养1周后用于正式实验。
1.2药物和试剂 大王马先蒿(PedicularisrexC.B.Clark,PR)全株,经贵州医科大学药学院龙庆德副教授鉴定(批号:201910)。秋水仙碱(批号:S15A8C34051)购自上海源叶生物科技有限公司;CCl4(批号:L1602077)购自阿拉丁工业公司,临用前用橄榄油稀释;TGF-β1(批号:ab179695),α-SMA(批号:ab124964)均购自美国Abcam公司,Smad3(批号:L1602077),Collagen I(批号:10423R)均购自北京博奥森生物技术有限公司,GAPDH(批号:T0004)购自美国Affinity公司;天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)检测试剂盒(批号分别为20200109,20200110)购自南京建成生物工程研究所;透明质酸(HA)酶联免疫吸附试剂盒(ELISA Kits)(批号:B16011450),层粘蛋白(LN)酶联免疫试剂盒(ELISA Kits)(批号:A22011449)购自武汉华美生物工程有限公司,PC-Ⅲ ELISA Kits (批号:L210104920),IV-C ELISA Kits (批号:L210104913)购自武汉云克隆科技股份有限公司;4%多聚甲醛组织固定液(批号:69111800)购自Biosharp 公司。
1.3仪器 全波段多功能酶标仪(美国 Bio-Tek 公司,型号:ELX800);移液器(德国 Eppendorf 股份公司,型号:P13199E); XH-B 型旋涡混合器(江苏康健医疗用品有限公司);K30 型干式恒温器(杭州奥盛仪器有限公司);CP124C 型电子天平[奥豪斯仪器(常州)有限公司,感量:0.1 mg];Centrifuge 5810R 型高速冷冻离心机(美国 Eppendorf 公司);HK-UP-20 分析型超纯水机(合肥宏科科技有限公司);SIM-F140AY65 雪花制冰机(日本三洋电机株式会社)。
1.4药材提取 大王马先蒿样品制备:称取大王马先蒿2 kg,第1次加95%乙醇提取2 h滤过,第2次加95%乙醇提取1 h,滤过,合并滤液,浓缩至浸膏备用。
1.5造模、分组及给药[8]将60只雄性昆明小鼠随机分为正常对照组、模型对照组、秋水仙碱组[9]及大王马先蒿小、中、大剂量组,每组10只;大王马先蒿组给药剂量设置依据该药临床剂量(每天15~30 g)[10],选择每天26 g的临床剂量换算成小鼠等效剂量小剂量[200 mg·kg-1,0.1 mL·(10 g)-1],再依次得出中剂量[400 mg·kg-1,0.1 mL·(10 g)-1]与大剂量[800 mg·kg-1,0.1 mL·(10 g)-1]。除正常对照组外,其余各组小鼠按照文献[11]方法均腹腔注射经橄榄油稀释的CCl4溶液(1 mL·kg-1)造模,每周2次,连续12周,正常对照组腹腔注射等体积橄榄油;实验第5周,秋水仙碱组灌胃0.1 mg·kg-1秋水仙碱,大王马先蒿小、中、大剂量组分别灌胃200,400,800 mg·kg-1大王马先蒿提取物,正常对照组和肝纤维化模型对照组灌胃给予等体积0.5%羧甲基纤维素钠;每天1次,持续至第12周结束,期间密切观察小鼠外表,活动状态。
1.6血清中ALT、AST、HA、LN、PCⅢ及Ⅳ-C水平检测 末次给药1 h后,使用水合氯醛麻醉小鼠,眼球取血,待室温沉降2 h后,3000 r·min-1离心15 min(r=5 cm),分离血清,按照试剂盒说明书中的操作方法,检测大王马先蒿对肝纤维化小鼠血清AST、ALT、HA、LN、Ⅲ型前胶原(PCⅢ)及Ⅳ型胶原(Ⅳ-C)水平的影响。
1.7肝组织TGF-β1,Smad3,α-SMA及Collagen I表达检测 小鼠取血后迅速在冰盘上取出肝组织,称取固定部位的肝组织100 mg,经预冷的0.9%氯化钠溶液漂洗冲去表面血液及滤纸拭干后,加入RIPA细胞裂解液,置于冰水浴中进行裂解(20 min),然后离心(10 000 r·min-1,15 min,r=5 cm)[12];二喹啉甲酸(BCA)法测蛋白浓度。取等量蛋白(10 μg)行10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,常规方法进行转膜、封闭后,加入TGF-β1(1:1000),Smad 3(1:1000),α-SMA(1:1500)及Collagen I(1:500)一抗,4 ℃冰箱过夜后室温孵育1 h;经缓冲液TBST洗膜后(10 min×3次),加入辣根过氧化物酶标记的羊抗兔抗体(二抗),继续室温孵育1 h后,TBST洗膜(10 min×3次),增强化学发光法显影。采用图像分析软件分析各条带吸光度值,通过目的条带吸光度与内参(GAPDH)吸光度的比值进行半定量分析。
1.8苏木精-伊红(HE),马松(Masson)染色 实验时取肝组织放入4%多聚甲醛中,后经乙醇脱水、石蜡包埋等步骤后,行连续切片后封闭。常规方法进行HE和Masson染色,镜下观察肝组织病理形态。
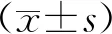
2 结果
2.1大王马先蒿对肝纤维化小鼠一般状态的影响 实验开始前,各组小鼠精神状态好,活动能力强,毛色白,有光泽。随着实验的进展,由CCl4诱导的模型对照组小鼠出现形体消瘦,皮毛竖立,欠光泽,活动减少,反应迟缓,摄食量减少。实验结束时,正常对照组毛色光泽,饮食如常,活泼好动;模型对照组小鼠明显出现食欲减退,形体瘦弱,体质量减轻,竖毛,毛色略暗,反应略显迟缓,呈现疾病状态;秋水仙碱组、大王马先蒿小、中、大剂量组小鼠,活动频率如常,摄食一般。取肝脏组织后观察发现,正常对照组肝脏表面光滑,透亮,无异常;模型对照组肝脏与周围组织粘连明显,边缘圆顿,质地硬,肝脏表面呈弥漫的细小结节伴有淡黄色腹水;大王马先蒿小、中、大剂量组和秋水仙碱组的情况对比模型对照组有所减轻。
2.2大王马先蒿对肝纤维化小鼠肝脏和脾脏指数的影响 通过称量小鼠的体质量、肝脏和脾脏的质量,按照公式:脏器系数=脏器质量/小鼠体质量×100%计算,本实验采用肝脏指数,脾脏指数进行比较。肝脏受到损伤越重肝脏指数越高。和正常对照组小鼠肝指数和脾指数比较,模型对照组明显升高,差异有统计学意义(P<0.05)。秋水仙碱组和大王马先蒿小、中、大剂量组小鼠的肝指数和脾指数相比模型对照组降低,差异有统计学意义(P<0.01)。秋水仙碱组与大王马先蒿各剂量组间差异无统计学意义(P>0.05)。见表1。

表1 大王马先蒿对肝纤维化小鼠脏器指数的影响 Tab.1 Effect of Pedicularis rex on organ index in liver fibrosis mice
2.3大王马先蒿对肝纤维化小鼠血清ALT、AST、HA、LN、PCⅢ及Ⅳ-C水平的影响 与正常对照组比较,肝纤维化模型对照组小鼠血清 HA、LN、PCⅢ、Ⅳ-C、AST及ALT 水平升高 (P<0.01),提示造模成功;与肝纤维化模型对照组小鼠比较,小、中、大剂量大王马先蒿组与秋水仙碱组小鼠血清HA、LN、PCⅢ、Ⅳ-C、AST、ALT水平均降低 (P<0.01),大王马先蒿大剂量组血清HA水平与药秋水仙碱组相比,差异有统计学意义(P<0.01),其余各组无明显差异。见表 2。

表2 大王马先蒿对肝纤维化小鼠血清HA、LN、PCⅢ、Ⅳ-C、ALT和AST水平的影响 Tab.2 Effect of Pedicularisrex on serum HA, LN, PCⅢ, Ⅳ-C, ALT and AST levels in liver fibrosis mice
2.4大王马先蒿对CCl4性肝纤维化小鼠肝脏病理变化的影响 采用HE和Masson染色进行观察,正常对照组肝组织结构清晰,肝小叶完整,肝细胞索排列整齐,以中央静脉为中心呈放射状排列,汇管区仅有少量的纤维组织。肝纤维化模型对照组小鼠部分肝小叶结构紊乱,有脂肪空泡、大量炎症细胞浸润,并有假小叶形成,肝细胞普遍坏死,胶原纤维大量增生并形成纤维间隔。秋水仙碱组肝纤维化情况有所好转,肝细胞索排列基本整齐,见少量的纤维间隔形成,肝细胞坏死减少,脂肪空泡减少,炎症减轻,在汇管区观察少量纤维组织增生。大王马先蒿小、中、大剂量组与模型对照组相比,肝纤维化的现象有所好转,汇管区胶原纤维增生减少,纤维间隔变窄,肝细胞坏死程度减轻,脂肪空泡减少,炎症细胞浸润减少,见图1,2。
2.5大王马先蒿对CCl4诱导肝纤维化小鼠肝组织TGF-β1/Smad3信号通路,α-SMA及Collagen I表达的影响 与正常对照组比较,肝纤维化模型对照组小鼠肝组织 TGF-β1、Smad3、α-SMA及Collagen I表达增加 (P<0.01);与肝纤维化模型对照组小鼠比较,小、中、大剂量的大王马先蒿组小鼠肝组织TGF-β1、Smad3、α-SMA及Collagen I蛋白表达均降低 (P<0.01),大王马先蒿大剂量组与秋水仙碱组比较,Smad3及α-SMA表达水平较秋水仙碱组显著降低(P<0.01)。见图3、表3。

表3 大王马先蒿对肝纤维化小鼠肝组织TGF-β1,Smad3,α-SMA及Collagen I表达的影响 Tab.3 Effect of Pedicularisrex on the expressions of TGF-β1, Smad3, α-SMA and collagen I in liver tissue of liver fibrosis mice
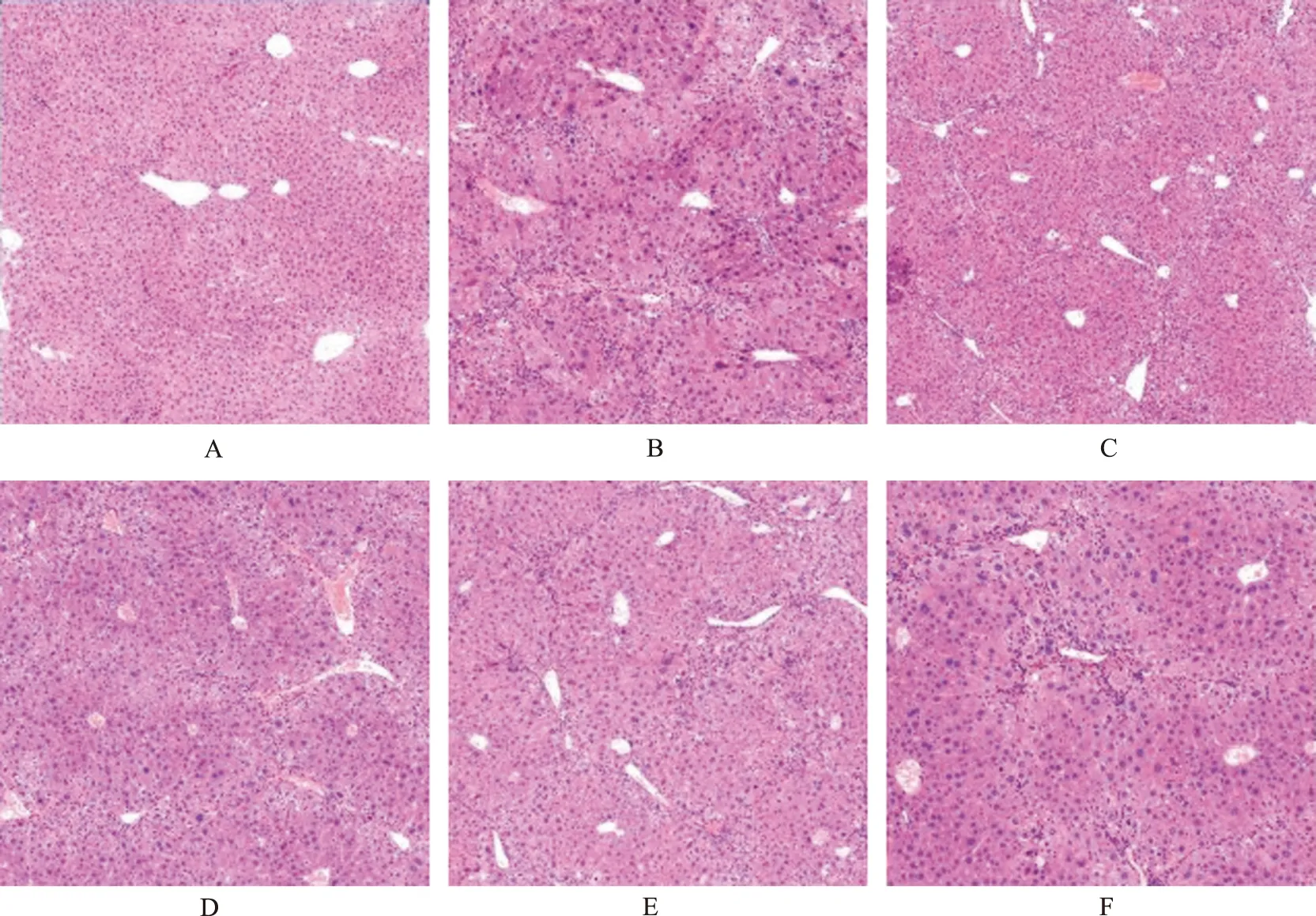
A.正常对照组;B.模型对照组;C.秋水仙碱组;D.大王马先蒿小剂量组;E.大王马先蒿中剂量组;F.大王马先蒿大剂量组。图1 大王马先蒿对肝纤维化小鼠肝脏病理组织学的影响(HE,×200)A.normal control group;B.model control group;C.colchicine group;D.Pedicularis rex low-dose group;E.Pedicularis rex medium-dose group;F.Pedicularis rex high-dose group.Fig.1 Effect of Pedicularis rex on liver histopathology in liver fibrosis mice(HE,×200)

图3 Western blotting检测各组 TGF-β1、Smad3、α-SMA及Collagen I蛋白表达Fig.3 Expressions of TGF-β1, Smad3, α-SMA and collagen I proteins detected by Western blotting
3 讨论
肝纤维化是肝脏受到各种慢性炎症损伤时,肝细胞外基质异常分泌并沉积的可逆性创伤修复过程。腹腔注射CCl4出现肝损伤或坏死,从而导致肝纤维化的发生。通过CCl4诱导建立的肝纤维化动物模型,其肝组织在形态学、病理生理学等方面与人类肝纤维化相似。因此,用CCl4诱导动物肝纤维化模型,已被广泛应用于防治肝纤维化药物筛选及其作用机制的研究[13]。当肝功能受损时,可引起肝细胞损伤,细胞膜通透性增加,导致细胞内ALT、AST渗出进入血液,使其血液浓度明显增加[14],AST和ALT是肝功能损伤最敏感的指标。另一方面,由于HA、LN、PCⅢ、Ⅳ-C参与ECM合成,是肝组织正常结构被破坏的重要因素,肝纤维化过程常伴有肝细胞受损和HA、LN、PCⅢ、Ⅳ-C水平明显升高,检测血清中这4种指标可准确、灵敏地反映肝内纤维生成的情况,是临床诊断肝纤维化的敏感指标[15]。本实验结果表明,大王马先蒿可以有效降低肝纤维化模型小鼠血清中HA、LN、PCⅢ、Ⅳ-C、AST和ALT水平,表明大王马先蒿具有保护肝脏免受损伤,降低肝纤维化的作用。另外,肝组织病理变化也说明大王马先蒿给药组减少了CCl4引起的胶原纤维增生和肝细胞变性,减少了肝脏切片中炎性细胞分布。另外,与CCl4诱导的模型对照组相比,大王马先蒿给药组还可降低小鼠的肝脏和脾脏指数,减轻脏器的肿胀及脂质化程度。以上结果都表明大王马先蒿对CCl4诱导的肝纤维化小鼠具有较好的保护作用。
TGF-β1通过激活肝星状细胞(HSC)和成纤维细胞生成细胞外基质(ECM)蛋白,是肝纤维化过程中的关键介质[16]。而Smad蛋白可将TGF-β1信号由细胞浆转导至细胞核,从而调控LN、HA及羟脯氨酸等蛋白的表达,最终导致肝纤维化的发生与进展[17-18]。此外,α-SMA被认为是肝纤维化标志物、Ⅰ型胶原蛋白及Ⅲ型胶原蛋白反映了肝纤维化程度,并参与一系列炎症和纤维化的过程[19]。本研究实验结果表明,灌胃给予肝纤维化模型小鼠小、中、大剂量大王马先蒿后,模型小鼠肝组织TGF-β1、Smad 3、α-SMA及Collagen I蛋白表达水平明显降低。这些结果表明,大王马先蒿对CCl4诱导的肝纤维化小鼠的保护作用可能与抑制TGF-β1/Smad信号通路,进而阻止肝星状细胞活化,下调α-SMA和Collagen I蛋白表达有关。
综上所述,大王马先蒿对CCl4诱导的肝纤维化小鼠具有较好的保护作用,该作用与抑制TGF-β1/Smad信号通路及下调α-SMA和Collagen I蛋白表达有关。
