药物基因多态性对肾移植受者西罗莫司血药浓度影响系统评价*
2022-03-28任相霖陈璐张远张丽娟边原舒永全童荣生侯一夫
任相霖,陈璐,张远,张丽娟,边原,舒永全,童荣生,侯一夫
(1.四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072;2.电子科技大学医学院,成都 610054;3.电子科技大学附属医院,四川省人民医院器官移植中心,成都 610072;4.四川省医学科学院·四川省人民医院临床免疫转化医学四川省重点实验室,成都 611713)
西罗莫司(sirolimus,SRL)又被称为雷帕霉素,临床上主要用于防治器官移植术后抗排斥反应及自身免疫性疾病[1]。SRL最常见的不良反应为高脂血症[2],且已证实其谷浓度(C0)与血清总胆固醇和三酰甘油水平显著相关[3]。牟静等[4]研究结果显示,SRL的稳态谷浓度(Css)>8 ng·mL-1时,患者各项肝功能指标明显升高。KAHAN等[5]研究表明SRL的Css>13 ng·mL-1与高三酰甘油血症的发生有关,但Css<5 ng·mL-1会引起排斥反应。另有研究[6]表明SRL的治疗窗随时间延长而降低,因此需要血药浓度监测(TDM)以指导给药剂量的调整,使SRLCss在治疗浓度范围。
SRL主要通过CYP3A家族酶代谢,且为P糖蛋白(P-gp)的底物,因此考虑个体间编码药物代谢酶、药物转运体基因序列的差异,可能是导致SRL血药浓度个体差异的主要原因。细胞色素P450(Cytochrome P450,CYP)是分布最广泛的代谢酶系[7],影响药物的吸收、代谢和消除[8],其中CYP3A亚家族是最重要的代谢酶,然而CYP3A在人体中的表达,可存在30倍以上差异[9]。P-gp是多药耐药基因1(Multidrug Resistance 1,MDR1)所编码,将药物从胞内泵到胞外,从而降低靶细胞内的药物浓度。因此本研究运用系统评价的方法对筛选的文献进行汇总、归纳和统计分析,进一步探究CYP3A4、CYP3A5和MDR1基因多态性与肾移植受者SRL血药浓度与单位体质量剂量比(C/D)的关系,以期提高SRL用药安全性,为辅助医生制定SRL最佳的初始治疗方案提供循证参考。
1 资料与方法
1.1纳入标准 文献纳入标准:①国内外公开发表的CYP3A4、CYP3A5以及MDR1基因多态性对肾移植受者SRL C/D影响和药动学关系的相关研究,语种不限;②研究对象以SRL为基础免疫抑制剂治疗的移植稳定期患者,SRL给药方法、剂量不限;③研究人群年龄、种族、性别不限,基因多态性检测方法不限;④有具体的C/D值,且单位为[ng·mL-1per mg·kg-1]或可以根据单位转换,表达为同一单位。
1.2排除标准 文献排除标准:①摘要、综述、病历报道及会议文章;②内容不符、重复研究资料及资料不全而无法获取全文的研究;③不能提取或转换成所需数据的研究;④联合使用影响SRL血药浓度的药物,如利福平、雷诺嗪和五味子等;⑤质量较低的文献。
1.3暴露因素 根据患者基因型检测结果,将患者分为野生纯合子、突变杂合子和突变纯合子3种不同的基因型;随后将患者按照不同遗传模型进行分组分析。
1.4资料筛选和提取 需要提取的主要内容如下:①一般信息包含题名、第一作者、发表年限、国家、地区;②患者信息包含患者年龄、性别、种族、样本量;③干预措施信息包含试验设计、基因分型方法、用药方案、基因均衡;④结局指标信息包含基因分型结果、SRL的C/D值。研究负责人制定文献资料提取表格,并由两名研究者独立选择相关文献,并提取以上信息;交叉核对时有差异的地方,则与第三位研究者讨论解决。
1.5纳入文献的质量评价 由两名研究者分别采用纽卡斯尔-渥太华量表对纳入的研究进行质量评价,分别通过研究人群选择、暴露评价和可比性三方面总计8个条目进行半量化评价,除可比性条目最高能给2分外,其余条目最多则为1分,满分为9分。
1.6检索策略 两位评价者独立的利用计算机检索PubMed、Embase、Cochrane Library、CBM、WOS、中国知网、维普、万方数据库关于药物基因多态性对肾移植患者SRL C/D影响的相关研究,最终检索时间为2021年9月。中文检索词:西罗莫司、雷帕霉素、基因多态性、多药耐药基因、CYP3A5、CYP3A4、ABCB1、MDR1;英文检索词:Sirolimus、Rapamycin、polymorphism、CYP3A5、CYP3A4、ABCB1、MDR1。采用主题词结合自由词的方式进行检索。对纳入文献和相关Meta分析的参考文献回溯分析,对比数据库检索结果,查找未包含于后者的相关文献。
1.7统计学方法 本研究根据患者的基因分型结果,对各遗传模型的分组都进行分析,但由于原始数据情况和各基因特点,不同基因选择的遗传模型不同。采用RevMan 5.4.1版统计软件进行Meta分析。首先采用Q检验进行异质性检验,若各研究结果间无异质性(P≥0.05,I2≤50%),采用固定效应模型对效应量进行加权合并;若各研究结果间存在异质性(P<0.05,I2>50%),采用随机效应模型对效应量进行加权合并,且对异质性来源进行分析,必要时进行亚组分析;最后给出Meta分析森林图,并绘制漏斗图;合并数据采用加权均数差(MD)和95%置信区间(95%CI)进行评估。
2 结果
2.1文献检索流程及结果 根据检索式,在各大数据库中共检索出相关文献416篇,删除重复文献后,由两名研究者按照纳入与排除标准筛选文献;经阅读题目和摘要筛选出符合上述标准研究83篇;经阅读全文后最终筛选出文献10篇[10-19],其中英文研究8篇,中文研究2篇,筛选流程如图1所示。累计纳入病例750例,都为肾移植受者,纳入研究的基本信息如表1所示。
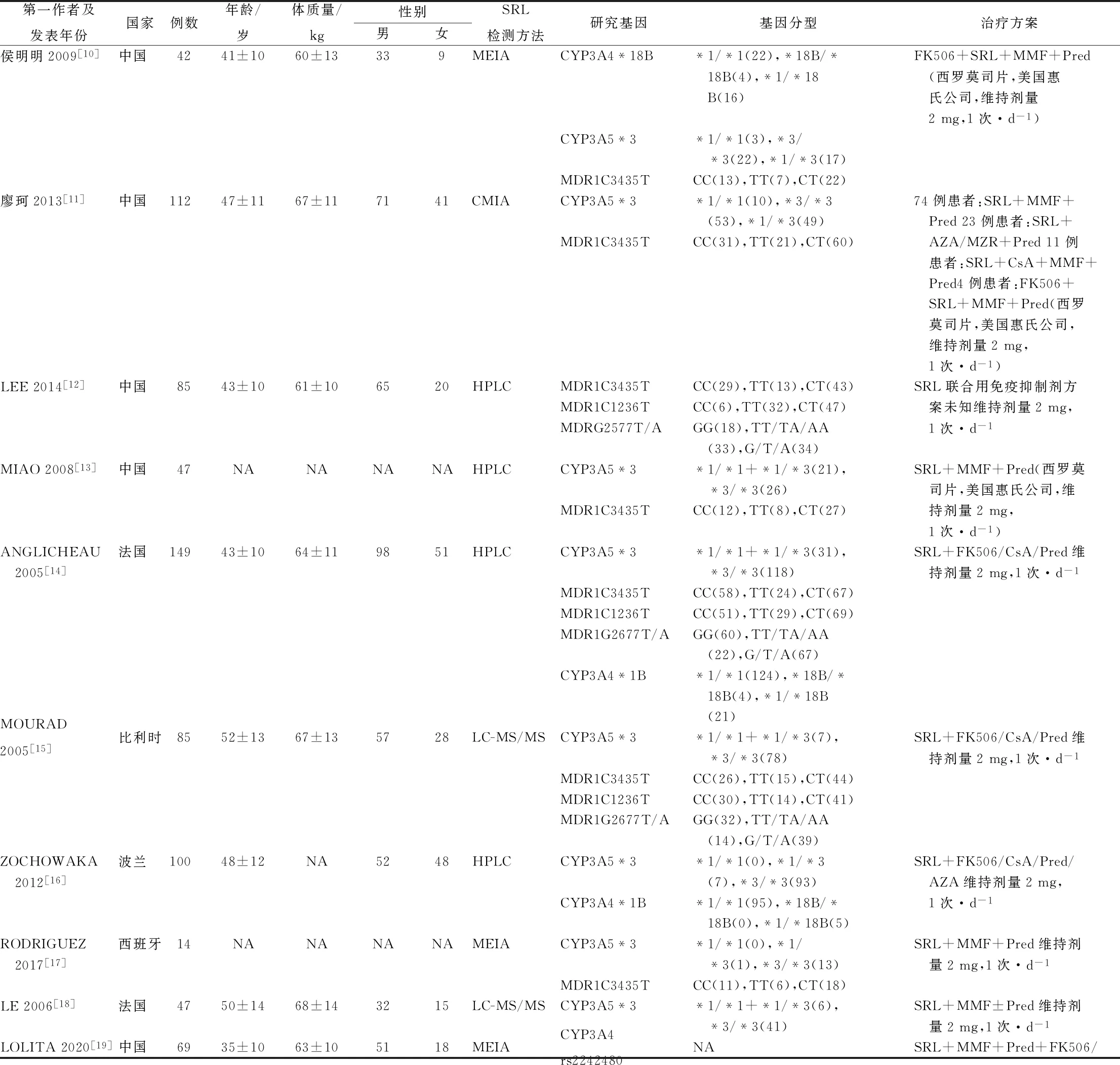
表1 纳入研究基本信息Tab.1 Basic information of included studies

续表1 纳入研究基本信息Tab.1 Basic information of included studies

图1 文献筛选流程Fig.1 Flow chart of literature screening
2.2纳入研究质量评价 此次纳入的10篇研究的质量评分均>5分,质量较好,可进行进一步系统评价。纳入10篇研究的质量评价结果如表2所示。
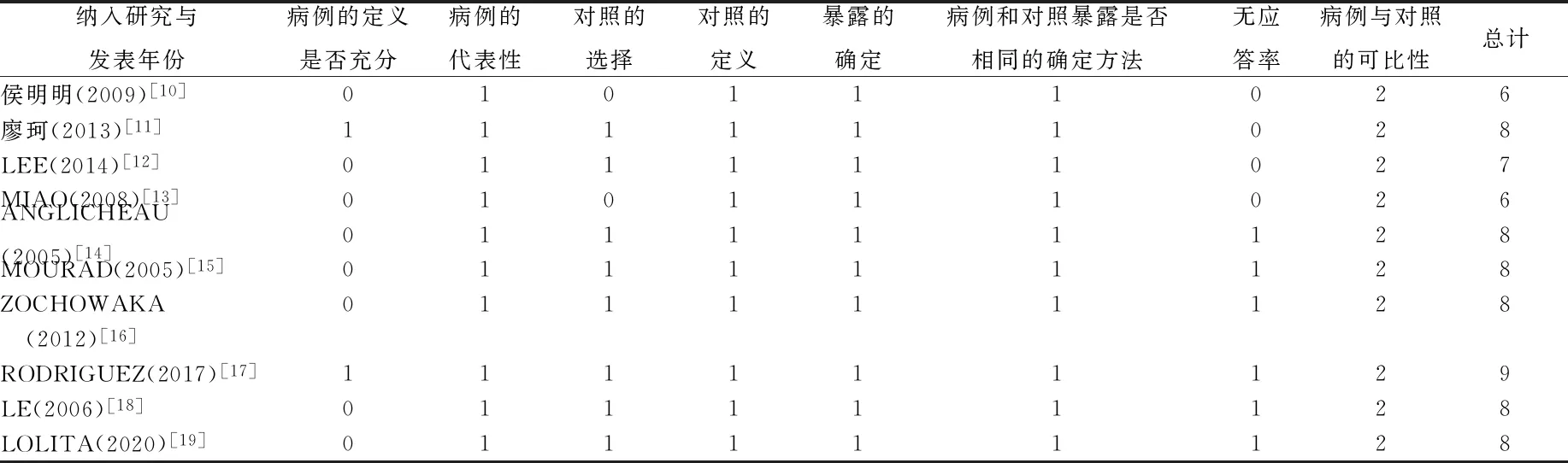
表2 纳入研究的质量评价Tab.2 Quality evaluation results of included studie
2.3Meta分析结果
2.3.1CYP3A5基因多态性与SRL C/D的关系 本研究在以上数据库中检索所有CYP3A5相关基因多态性与SRL C/D的相关性,检索结果显示,该基因中研究位点主要为CYP3A5*3。本次检索发现8篇有关CYP3A5*3位点与肾移植患者SRL浓度相关性的研究,但其中有4项研究将患者分为CYP3A5表达组(*1/*1+*1/*3)与不表达组(*3/*3),没有各基因型的研究结果;且另有2项研究中*1/*1患者频次为零;而其余2篇为根据各基因型表达的结果,后两者结果可根据计算合并转换为隐性遗传模型(*1/*1+*1/*3 vs *3/*3)结果。因此CYP3A5基因多态性中仅对*3突变型中隐性遗传模型进行Meta分析。
纳入的9篇文献中有一篇文献[19]原始数据中仅一例患者携带CYP3A5*1基因型,因此实际纳入Meta分析的文献为8篇。CYP3A5*1型携带者患者其SRL C/D普遍低于CYP3A5*3/*3型患者(P=0.07),然而差异无统计学意义,Meta分析森林图如图2所示。

图2 CYP3A5*1携带型与 *3/*3型对SRL C/D影响的Meta分析森林图Fig.2 Forest plot of meta-analysis for the effects of CYP3A5 *1/*1+*1/*3 type and *3/*3 type on C/D ratio of SRL
本次纳入的8项研究间存在异质性(I2=74%),当考察异质性来源时发现,该异质性可能来源于侯明明等[10]的研究,剔除该研究后发现异质性(I2=39%)降低且结果较为稳健,此时携带*1型患者的血药浓度明显低于*3/*3纯合子型患者,差异有统计学意义(P<0.000 01),Meta分析森林图如图3所示。未剔除侯明明等[10]研究时异质性较高,故通过考察单项研究对总合并效应量的影响进行敏感性分析,结果如表3所示。敏感性分析发现对异质性影响较大的研究为侯明明等[10]的研究。对于隐性模型而言,难以转换为其他遗传模型,且考虑CYP3A5*3基因多态性部分基因型病例数较少,则不进行其他遗传模型的Meta分析。

表3 CYP3A5基因多态性与SRL C/D Meta的敏感性分析Tab.3 Sensitivity analysis of CYP3A5 gene polymorphism and SRL C/D meta

图3 CYP3A5*1携带型与 *3/*3型对SRL C/D影响的Meta分析森林图(剔除侯明明) Fig.3 Forest plot of meta-analysis for the effects of CYP3A5 *1/*1+*1/*3 type and *3/*3 type on C/D ratio of SRL (Excluding Hou Mingming's research)
CYP3A5基因多态性亚组分析。阅读纳入文献全文时发现CYP3A5*3基因多态性在不同人群中对SRL C/D的相关性不一致[12,15-16],因此根据研究人群的不同,将8项研究分为中国人群组与高加索人群组,进行亚组Meta分析。在中国人群亚组中,CYP3A5 *1携带型患者较*3/*3纯合子型具有较低的SRL浓度[MD=-39.13,95%CI(-89.17,10.91),P=0.13],差异无统计学意义;但将侯明明等[10]的研究剔除后同样发现异质性降低,且在该遗传模型下两者SRL血药浓度的差异有统计学意义[MD=-63.13,95%CI(-99.59,-26.67),P=0.000 7],Meta分析森林图如图4所示。

图4 CYP3A5*1携带型与 *3/*3型对SRL C/D影响的亚组Meta分析森林图(a.包含侯明明;b.剔除侯明明)Fig.4 Forest plot of subgroup meta analysis for the effects of CYP3A5 *1/*1+*1/*3 type and *3/*3 type on C/D ratio of SRL (a.Including Hou Mingming's research;b.Excluding Hou Mingming's research)
而对于高加索人群而言隐性模型下两者SRL C/D的差异不具有统计学意义[MD=-16.21,95%CI(-54.02,21.61),P=0.40],Meta分析森林图如图5所示。

图5 CYP3A5*1携带型与 *3/*3型对SRL C/D影响的亚组Meta分析森林图(高加索人)Fig.5 Forest plot of subgroup meta-analysis for the effects of CYP3A5 *1/*1+*1/*3 type and *3/*3 type on C/D ratio of SRL (Caucasian)
2.3.2MDR1基因多态性与SRL C/D的关系 (1)MDR1 G2677T/A基因多态性与SRL C/D的关系。目前仅三项研究[12,14-15]报道了MDR1 G2677T/A基因多态性与SRL C/D的关系,根据不同遗传模型的选择对MDR1 G2677T/A基因多态性与SRL C/D的关系进行Meta分析,分别为GGvs.GA+GT、GGvs.TT+TA+AA和GA+GTvs.TT+TA+AA,均显示MDR1 G2677T/A基因多态性与SRL C/D无相关性。Meta分析结果如表4所示。

表4 MDR1 G2677T/A基因多态性对SRL C/D影响的Meta分析 Tab.4 Meta-analysis of the effects of MDR1 G2677T/A gene polymorphism on C/D ratio of SRL
(2)MDR1 C1236T 基因多态性与SRL C/D的关系。同MDR1 G2677 T/A,目前仅3项研究[12,14-15]报道了MDR1 C1236T基因多态性与SRL C/D的关系,根据不同遗传模型的选择对MDR1 C1236T基因多态性与SRL C/D的关系进行Meta分析,分别为CCvs.CT、CCvs.TT、CTvs.TT、CCvs.CT+TT、TTvs.CT+CC、CC+TTvs.CT。以上6种遗传模型的Meta分析结果均显示MDR1 C1236T 基因多态性与SRL C/D无相关性。Meta分析结果如表5所示。

表5 MDR1 C1236T基因多态性对SRL C/D影响的Meta分析 Tab.5 Meta-analysis of the effects of MDR1 C1236T gene polymorphism on C/D ratio of SRL
(3)MDR1 C3435T 基因多态性与 SRL C/D的关系。较MDR1 G2677T/A 与MDR1 C1236T 而言,MDR1 C3435T基因多态性与SRL C/D的相关性研究较多,目前有7项研究[10-15,17]对其进行报道。对于MDR1 C3435T基因多态性,也根据不同遗传模型进行Meta分析,分别为CCvs.TT、CCvs.CT、TTvs.CT、CT+CCvs.TT、CT+TTvs.CC、CC+TTvs.CT。以上6种遗传模型的Meta分析结果均显示MDR1 C3435T 基因多态性与SRL C/D无相关性。Meta分析结果如表6所示。

表6 MDR1 C3435T基因多态性对SRL C/D影响的Meta分析 Tab.6 Meta-analysis of the effects of MDR1 C3435T gene polymorphism on C/D ratio of SRL
2.3.3发表偏倚评估 用Revman5.4.1软件绘制CYP3A5*3和MDR1 C3435T基因多态性对肾移植受者SRL C/D影响的漏斗图,结果漏斗图形状基本对称,呈倒漏斗状,见图6。

图6 发表偏倚的漏斗图(a:CYP3A5*3;b:MDR1 C3435T)Fig.6 Funnel diagram of publication bias.(a:CYP3A5*3;b: MDR1 C3435T)
2.4系统评价结果
2.4.1CYP3A4基因多态性与SRL的C/D值的关系 此次检索结果显示,关于研究SRL与CYP3A4基因多态性的研究较少,最终仅纳入4篇研究,如表1所示;且分散于多个SNP,难以进行Meta分析,则仅行描述性评价。其中涉及CYP3A4*1B的研究仅2项,且研究结论相反,ZOCHOWSKA等[16]研究表明CYP3A4*1B多态性与SRL谷浓度无相关性,而ANGLICHEAU等[14]的研究则表明,CYP3A4*1B基因携带者需增加SRL剂量以达到所需浓度范围(P<0.02),两项研究均为以高加索人群为研究群体的结果。涉及CYP3A4*18的研究仅1项[10],该研究表明在42例SRL、FK506四联免疫抑制方案中,CYP3A4*18基因多态性与患者SRL的C/D值无相关性。涉及CYP3A4 rs2242480的研究仅1项[19],研究表明服用SRL 1年后,该基因多态性与SRL谷浓度相关。
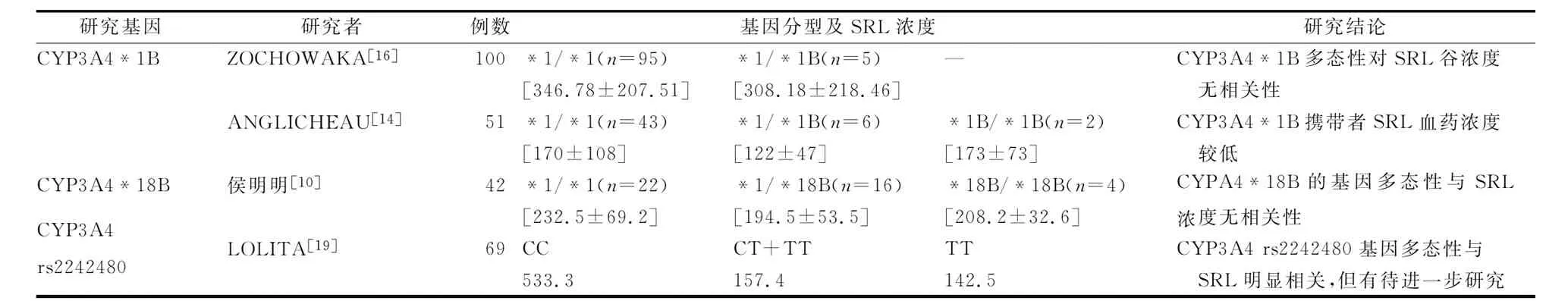
表7 CYP3A4基因多态性纳入研究的基本信息Tab.7 Basic information of CYP3A4 gene polymorphism in included studies
3 讨论
SRL免疫抑制效果较好[20],目前已广泛用于移植术后抗排异反应的治疗[21]。SRL是CYP3A4和CYP3A5代谢的底物与P-gp的外排底物,可因此导致SRL的个体差异[22],且初始剂量难以根据TDM提供给药意见。因此探究影响SRL浓度的药物基因,以期通过药物基因检测结果指导初始剂量的制定。近年来研究主要在CYP3A5和MDR1基因的多态性上,主要位点包括CYP3A5*3、MDR1 C1236T、MDR1 C3435T和MDR1 G2677T/A,其余则涉及CYP3A4常见功能位点。
本次系统评价结果显示,关于CYP3A4与SRL C/D相关性的研究较少,且同一位点的研究结果存在争议,结合我国CYP3A4常见突变位点相应的突变频率都较小,因此不推荐SRL服药前常规检测CYP3A4基因多态性。关于CYP3A5与SRL C/D相关性的Meta分析表明*1携带者较*3/*3纯合子型肾移植受者需要更高的初始给药剂量以达到与*3/*3型患者相同的治疗药物浓度范围,尤其是对于中国人群而言。该结果与丁晴等[23]的研究结果相同,本研究纳入了近期的相关研究,进一步阐述了高危患者可在服用SRL前进行CYP3A5*3基因多态性的测定,以指导初始剂量,减少不良反应的发生。虽然有研究表明携带MDR1 3435CT/TT基因型的肾移植受者,其SRL血药浓度比携带CC型患者高约1倍[24]。且SHAO等[25]的Meta分析还表明MDR1 C1236T和MDR1 G2677T/A基因多态性与SRL浓度相关。但本研究结果显示,所纳入的MDR1 C3435T、MDR1 C1236T和MDR1 G2677T/A基因的多态性与患者SRL C/D都无相关性,对比前者所纳入文献后发现,前者纳入了本研究剔除的一项相关研究,考虑差异由此文章引起。综合分析考察,对于MDR1基因多态性指导SRL初始剂量制定的建议有待进一步的研究,暂不推荐常规检测。目前除了研究常见的药物代谢和转运体基因与SRL相关性外,还有关于IL-10基因多态性的研究,已有研究表明IL-10-1082 GG基因型的肾移植受者SRL的浓度比IL-10-1082AG/AA型患者高约24%[24]。
综上所述,建议CYP3A5 *1携带者提高给药剂量以达到相同的有效治疗范围;由于仍缺乏相关研究,暂不建议常规检测MDR1和CYP3A4基因多态性,以指导SRL用药。鉴于本文只涉及国内外公开发表的文章,仅纳入相关研究10项,且所涉及样本量总量较少,仍需要更高质量的临床研究,以明确CYP3A4、MDR1基因多态性与SRL C/D的关系,为SRL的合理用药提供可靠依据。
