基于RNA-seq技术挖掘鹌鹑羽色自别雌雄相关基因
2022-03-28王乾昆张小辉庞有志祁艳霞白俊艳户运奇赵毅威苑志文
王乾昆,张小辉,2,庞有志,2,*,祁艳霞,2,雷 莹,2,白俊艳,2,户运奇,赵毅威,苑志文,王 涛
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.洛阳市动物遗传育种重点实验室,河南 洛阳 471003)
在鸟类生产应用和选育新品种中,羽色可作为重要的经济性状发挥其作用。从某种程度上来说,新品系纯度与性状遗传稳定性可以根据羽毛的颜色来判断。在性别决定中,动物的伴性遗传比较常见,尤其是在鸟类中,这种现象更加明显,一般雄性羽色颜色更加鲜艳。鸟类同一物种不同颜色会在选择栖息地和避免被捕食风险中起到作用。传统生产中对于禽类性别鉴定一直采用翻肛技术,翻肛会引起雏鸡应激反应,操作不当会撕伤雏鸡。Yang等采用基于紫外成像的雏鸡羽毛自动性别鉴定,雌雄雏鸡性别分离的正确率分别为93%和94%,该方法简便、准确、节约成本。鸡快羽和慢羽属于伴性遗传,快羽公鸡与慢羽母鸡杂交后代中公鸡全为慢羽,母鸡全为快羽,这可以用于初生雏鸡的性别鉴定,取代了生产中广泛使用的翻肛技术,是目前国内外养鸡业普遍采用的技术措施。研究羽色遗传对于物种保护、合理开发畜禽遗传资源与开展实验动物研究等方面具有重要意义。
鸟类的羽色类型主要取决于黑色素的含量和分布,黑色素合成的关键是酪氨酸酶氧化酪氨酸。作为羽色形成的基本物质,黑色素可分为真黑素和褐黑素,2种黑色素类型之间的相互转化影响羽色的形成。国内关于鹌鹑羽色的研究大多集中在探索遗传规律与生产应用方面,对鹌鹑羽色自别雌雄分子机制的研究较少。北京白羽公鹑与栗羽母鹑的杂交后代(F)能够根据羽色自别雌雄,即F中栗羽全部为公鹑,白羽全部为母鹑。因此,本研究对北京白羽鹌鹑(BF)和栗羽鹌鹑(LF)杂交后代(F)胚胎期的皮肤组织进行RNA-seq分析,筛选与羽色相关的差异表达基因,分析候选基因与鹌鹑性别之间的关系,为后续鹌鹑羽色自别雌雄方面的分子研究提供参考依据。
1 材料与方法
1.1 材料
选择3只北京白羽公鹌鹑与3只朝鲜栗羽母鹌鹑配对后单笼饲养,收集每对鹌鹑的种蛋,标记后分区孵化。在孵化的第10天取出胚胎,利用分子生物学方法进行性别鉴定,每对鹌鹑的F代中选择1个公鹑和1个母鹑,将胚胎取出放在干净的锡箔纸上,用剪刀和镊子采集鹌鹑翅膀下方的皮肤组织,标记后放于液氮中,用于后续的RNA-seq分析。方法同上,采集不同胚胎期的皮肤组织,标记后储存于液氮中,用于后续qRT-PCR验证试验。
1.2 RNA提取与转录组测序
将储存在液氮中的皮肤组织迅速取出,利用Trizol(Takara公司)法提取6个样品的总RNA,并用Nano Drop2000检测总RNA的质量和浓度,1.2%琼脂糖凝胶电泳检测其完整性。反转录为cDNA后,构建cDNA文库并进行高通量测序,此项工作由上海欧易生物医学科技有限公司完成。采用Trimmomatic软件对原始数据进行质量预处理,去除带接头序列、含N序列与低质量序列,得到高质量clean reads。利用hisat2将clean reads与鹌鹑参考基因组(GCA_001577835.2)进行比对,获取在参考基因组或基因上的位置信息,以及测序样本特有的序列特征信息,用于后续分析。RNA-seq原始数据已提交到NCBI数据库(NCBI登录号:PRJNA756792)。
1.3 差异表达基因的筛选
利用DESeq2软件对各个样本基因的counts数量进行标准化处理,计算差异倍数,并采用负二项分布检验的方式对reads数进行差异显著性检验,最终根据差异倍数与差异显著性检验结果来筛选差异基因(<0.05且|logFC|>1)。
利用ClusterProfiler软件,将差异基因与GO数据库进行比对,获得差异基因GO功能注释信息;以<0.05作为显著性富集的阈值,利用KEGG数据库对差异基因进行比对,得到差异基因显著性富集的pathway注释信息。
1.4 候选基因的qRT-PCR验证
通过对差异基因进行筛选,得到了7个与羽色表型相关的基因,分别是1、174、、、452、1和。以4为内参基因,利用qRT-PCR方法检测羽色相关差异表达基因在白羽和栗羽鹌鹑F代胚胎不同发育时间的表达情况。参考NCBI数据库中日本鹌鹑同源序列信息,用Primer5.0设计引物(表1),送往武汉奥科鼎盛生物科技有限公司合成。

表1 实时荧光定量PCR引物信息Table 1 Primer information of real-time fluorescent quantitative PCR
参考Takara SYBRPremix Ex TaqTMⅡ试剂盒说明书,qRT-PCR反应体系为20 μL:cDNA模板1 μL,上下游引物(10 μmol·L)各0.75 μL,SYBRPremix ExTMII(2×)10 μL,ddHO 7.5 μL;反应条件为:95 ℃预变性3 min;95 ℃变性30 s,退火30 s(根据各引物退火温度设定),72 ℃延伸20 s,40个循环;延伸阶段收集信号;熔解曲线从65 ℃到95 ℃,每5 s升高0.5 ℃。
1.5 数据处理
基因的相对表达量采用2法计算,运用SPSS20.0软件进行检验分析,用Graphpad prism 8.0软件作图。
2 结果与分析
2.1 转录组测序结果
原始Reads数量为291.07 M,过滤后得到的clean reads数量为279.72 M,过滤后得到的总碱基数量为38.94 G,6个样品测序所得数据库的Q30均在90%以上,GC含量平均值为49.7%。比对结果显示:6个所测样品至少89%的reads比对到参考基因组上,其中,比对在参考基因组上有单一位点的reads在87%左右,比对在参考基因组上有多个位点的reads均低于3%,reads比对率低可能与参考基因组组装质量有关(表2)。

表2 测序数据质量预处理结果与基因组比对率Table 2 Reference of sequencing data quality pretreatment and statistical results of genome comparison rate
2.2 基因表达水平
通过箱线图可以展示不同样本基因表达水平的分布情况,由图1可知,各个平行样品之间的重复性比较好。

图1 基因表达水平箱线图Fig.1 Box plot of gene expression level
2.3 差异表达基因分析
共筛选出来91个差异表达基因,相较于北京白羽鹌鹑,栗羽鹌鹑皮肤中上调基因有69个,下调基因有22个(图2)。得到了7个与羽色表型相关的基因,分别是1、174、、、452、1和。
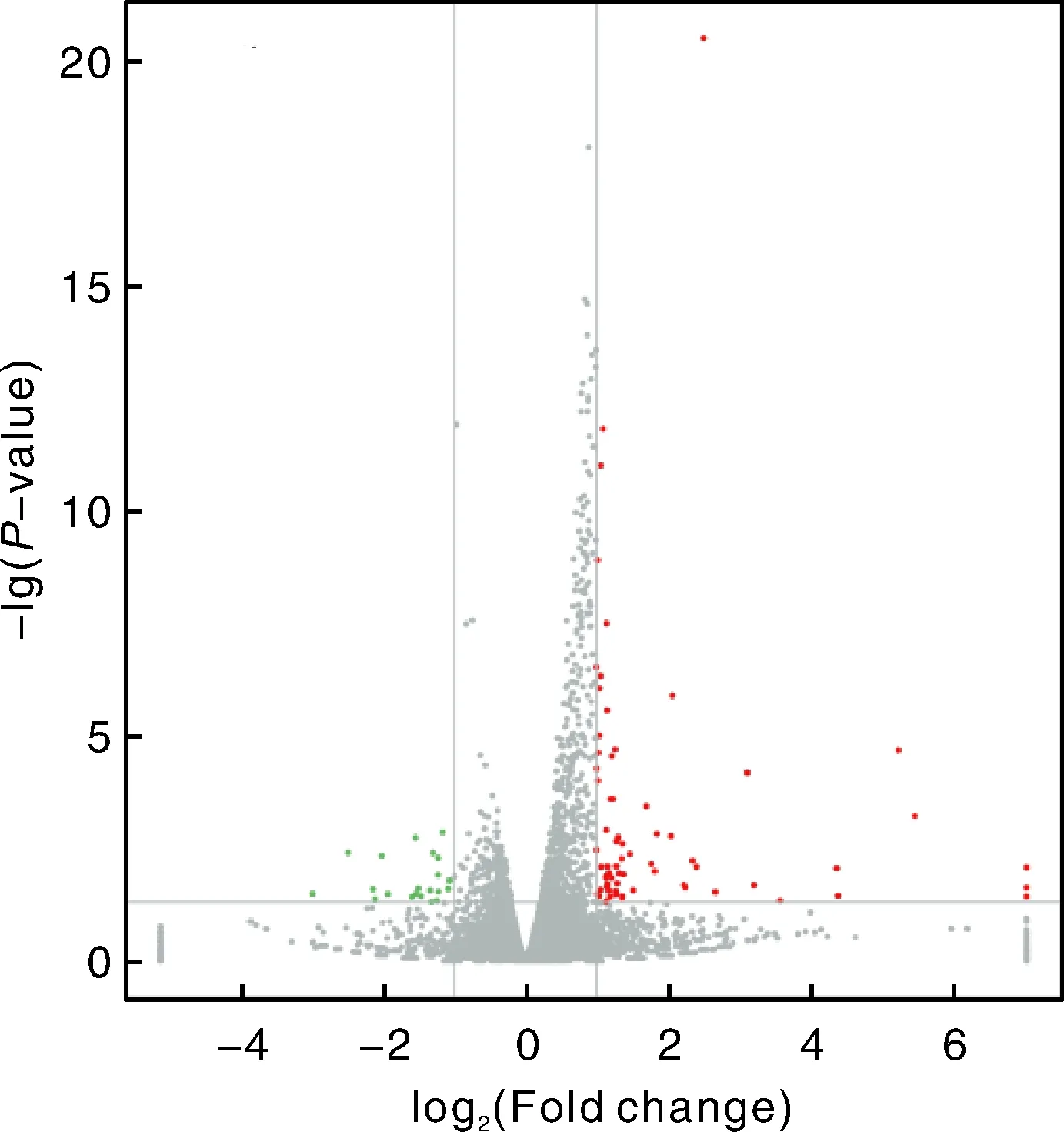
灰色为非显著差异表达的基因,红色表示显著上调基因,绿色表示显著下调基因。Gray represented genes with no significant difference,red indicated up-regulation genes,and green indicated down-regulated genes.图2 基因表达火山图Fig.2 Volcanic maps of gene expression
2.4 差异基因GO和KEGG富集分析
GO分析结果表明,有13 841个基因注释到GO数据库中,其中包含78个差异表达基因。利用GO数据库对差异表达基因进行生物过程(biological process)、细胞组成(cellular component)、分子功能(molecular Function)注释,共有64个分类条目显著富集,生物学过程注释到23个条目,细胞组分注释到20个条目,分子功能注释到21个条目(图3)。

图3 差异表达基因GO水平分布图Fig.3 Map of GO levels of differentially expressed genes
KEGG富集结果显示,有22个差异基因富集到38条通路中。为了进一步探讨得到的候选基因的功能及其所参与的代谢过程,对测序得到的全部差异基因在KEGG Level2水平进行重新富集分析发现,25个上调基因分布在16条通路中,9个下调基因在6条通路聚集(图4)。KEGG富集分析得到了3条与羽色合成相关的通路,分别为黑色素通路(melanogenesis)、酪氨酸代谢通路(tyrosine metabolism)和MAPK信号通路(MAPK signaling pathway)(表3)。这3条通路中有1、和KIT 3个差异表达基因。其他候选基因的富集通路差异不显著。

横轴是注释到各 Level2 通路的上调(下调)差异表达基因和所有注释到KEGG通路的上调(下调)差异表达基因总数的比值(%),纵轴表示 Level2 Pathway 的名称,柱子右边数字代表注释到该 Level2 Pathway 的上调(下调)差异表达基因数量。红色表示显著上调基因,绿色表示显著下调基因。Horizontal axis was the ratio (%)of the total number of up-regulated (down-regulated)differentially expressed genes annotated to each Level2 pathway and all up-regulated (down-regulated)genes annotated to the KEGG pathway,vertical axis represented the name of Level2 pathway,and the number on the right side of the column represented the number of up-regulated (down-regulated)differentially expressed genes annotated to the Level2 pathway.Red indicated up-regulation genes and green indicated down-regulated genes.图4 差异表达基因KEGG Level2 水平分布图Fig.4 KEGG Level2 distribution map ofdifferentially expressed gene

表3 差异表达基因显著富集的KEGG通路Table 3 KEGG pathway for differentially expressed genes
2.5 qRT-PCR验证
选取7个与羽色表型相关的差异表达基因,分别是1、174、、、452、1和进行qRT-PCR验证,研究其在栗羽鹌鹑和北京白羽鹌鹑相同发育时期的表达水平,结果如图5所示。1、174、、、452、1和基因在栗羽鹌鹑各个时期的表达量均显著高于北京白羽鹌鹑,说明候选基因在鹌鹑羽色形成与黑色素合成过程中起到重要作用,由此推断所选候选基因可能与鹌鹑羽色自别雌雄有关。qRT-PCR和RNA-seq筛选出来的基因表达结果一致,验证了RNA-seq的准确性。

*和**分别表示在P<0.05 和P<0.01 水平差异显著。* and ** meant significant differences at the levels of P<0.05 and P<0.01,respectively.图5 白羽鹌鹑和栗羽朝鲜鹌鹑不同发育阶段胚胎中候选基因相对表达水平Fig.5 Relative expression levels of candidate genes in embryos of white feather and maroon feather Korean quails at different developmental stages
3 讨论
黑色素主要在黑色素细胞的黑色素小体中合成,需要经过一系列复杂的信号通路共同调节,其中,酪氨酸、酪氨酸酶、氧元素是黑色素形成过程中最关键的3种物质。本研究中,KEGG富集分析得到多条与羽色合成相关信号通路,如黑色素通路、酪氨酸代谢通路和MAPK信号通路。黑色素通路中发现3个与羽色相关的差异基因,1、和,且都是上调基因。酪氨酸代谢通路中,酪氨酸酶(TYR)、酪氨酸酶相关蛋白1(TRP-1)和酪氨酸酶相关蛋白2(TRP-2)是合成黑色素的关键因素,在黑色素生成通路的下游起关键作用。在黑色素小体成熟阶段,TYR、TRP-1、TRP-2选择性转运至黑色素小体,调控黑色素的合成。黄海艳等研究表明,MAPK信号通路在黑色素的合成中起重要作用。当脂联素和AICAR激活MAPK信号通路时,激活的MAPK信号通路可选择性地调控下游基因,导致CAMP反应结合蛋白(CREB)磷酸化,引起上调。基因是黑色素合成关键酶(酪氨酸酶)的直接上游基因,主要调控TYR、TRP-1和TRP-2的活性,进而影响黑色素的合成。3条KEGG通路中都有黑色素合成相关差异表达基因富集,说明信号通路中某些基因的表达可能促进了鹌鹑羽色的形成。
鹌鹑羽色变异丰富,是研究基因型和表型关系不可多得的遗传材料。鹌鹑的羽色遗传很复杂,通过杂交实验等方法已经发现30多个与鹌鹑羽色有关的基因座,不同羽色的鹌鹑突变体都是由野生型羽色鹌鹑不断突变累积形成的。本研究得到7个与羽色有关的候选基因,分别为、、452、1、1、174和。基因是酪氨酸酶家族的重要成员之一,在皮肤、羽毛和视网膜颜色的表达中起重要作用。本研究表明,基因在栗羽鹌鹑中表达水平较高,这与朱鹮繁殖时期皮肤中基因上调的研究结果一致。Sultana等研究也表明,基因位点的改变与鸭的羽毛着色有很大关联。基因在北京白羽鹌鹑中几乎不表达,使黑色素细胞无法合成真黑色素,导致出现白色羽毛表型。基因通过维持GPR143的稳定性参与黑色素的生成。Xi等发现,基因mRNA表达发生变化会导致鸭羽毛产生差异。Yao等研究表明,基因在浅色绵羊体内表达量偏低,这与基因在北京白羽鹌鹑中表达量低相一致。可能是北京白羽鹌鹑皮肤中mRNA的翻译过程受到抑制,无法正常合成相应蛋白。452基因主要是色素细胞中表达的转运蛋白,其多态性与色素沉着变化有关。在本研究中,452基因在北京白羽鹌鹑中表达下调,这与浣熊犬毛色研究结果一致。452基因在鹌鹑皮肤中如何调控,有哪些基因与非编码RNA参与了这一过程还有待进一步研究。1基因是参与黑色素生物合成的酶之一,它与酪氨酸酶具有高度的序列同源性。Li等通过基因定位和基因捕获发现,1的突变与鸡的巧克力色有关,1突变导致5,6-二羟基吲哚无法转化为真黑素。Weng等研究发现,1基因在五花黄鸡中表达量低,这与1基因在北京白羽鹌鹑中低表达相一致。1的表达与黑色素细胞中黑色素的含量呈正相关。本研究表明,1基因在栗羽鹌鹑各个时期的表达量均显著高于北京白羽鹌鹑;Xu等发现,1通过影响黑色素细胞中黑色素的含量,导致五指山猪(黑背白腹)同一个体的毛色发生变化,由此推断1基因在毛色形成过程中可能发挥着重要作用。174基因在毛色方面的研究鲜有报道,有研究发现,174与罗德岛鸡的耳垂颜色有关,RNA-seq和qRT-PCR结果均表明,174基因在栗羽鹌鹑不同发育时期表达量均上调,且差异极显著,这为后续研究其在毛色方面的作用机制提供了参考。是调节黑色素生成、控制黑色素细胞增殖和凋亡的关键基因,的突变或缺失会导致哺乳动物的毛发和皮肤颜色改变,羊驼中经典的灰色表型是外显子3(c.376G>A)突变的结果;在本研究中,基因在白羽鹌鹑中低表达。基因不表达或较少表达会使酪氨酸激酶受体减少,间接影响黑色素的生成过程,导致鹌鹑白色羽毛表型的形成。
综上所述,7个候选基因均参与了黑色素的合成或运输,且在鹌鹑羽色形成过程中起到重要作用。
4 结论
本试验通过高通量测序技术,对白羽鹌鹑和栗羽朝鲜鹌鹑的皮肤组织进行了RNA-seq分析,筛选得到与羽色性状形成相关的7个差异表达基因,获得了候选基因的功能、分类与代谢途径,进一步验证了黑色素合成通路与酪氨酸代谢通路在鹌鹑羽色形成过程中发挥了重要作用,可为今后开展鹌鹑羽色性状相关基因、自别雌雄的研究与分子调控机制提供参考依据。
