布鲁氏菌核糖体L7/L12蛋白的原核表达及对鼠源树突状细胞的作用
2022-03-28张广林高云艳李玲霞尚佑军曹小安赵兴绪
张广林,徐 龙,高云艳,李玲霞,尚佑军,张 勇,曹小安,*,赵兴绪,*
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730000)
布鲁氏菌是寄生于细胞内能感染人和动物的革兰氏阴性小杆菌,由布鲁氏菌引起的布鲁氏菌病是一种严重危害人类健康和畜牧业发展的人畜共患传染病,尤其在发展中国家发生率较高。近年来,布鲁氏菌病在我国大范围内呈现上升趋势,家畜感染后主要引起的流产或不孕,人感染后出现波状热、关节肿胀、疼痛等。布鲁氏菌在细胞中有较强的复制能力和特异性,它可以逃避宿主的先天和适应性免疫反应,据报道,布鲁氏菌入侵机体后产生的许多蛋白能够引起机体的一系列免疫反应,其中L7/L12蛋白是公认的T细胞免疫的优势抗原,而且编码L7/L12蛋白的基因在各种间相对保守。因此,加强对核糖体蛋白L7/12的基础研究尤为重要。树突状细胞(dendritic cells,DCs)是机体免疫系统中重要的抗原递呈细胞,没有分化成熟的DCs主要发挥获取和处理加工抗原并将其递呈到T细胞引发免疫应答。成熟DCs(mature DCs,mDCs)高表达CD80、CD86、CD40等共刺激分子,主要发挥刺激活化T细胞并引发相应的免疫反应。活化后的DCs分泌白细胞介素12(interleukin-12,IL-12)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等细胞因子在先天性和适应性免疫应答中起重要作用。本试验将重组的核糖体蛋白L7/L12作用于体外分离诱导的小鼠骨髓树突状细胞,通过DCs表面标志物、细胞因子的检测来判断是否促进DCs细胞的分化和成熟,探讨该蛋白对小鼠骨髓来源DCs成熟、功能的影响以及能否增强免疫功能。
1 材料与方法
1.1 材料及试剂
pET30a载体,大肠埃希菌感受态DH5α、BL21(DE3)菌株,质粒小提试剂盒,DNA纯化试剂盒,限制性内切酶HⅠ、Ⅰ,T4 DNA Ligase,过硫酸铵,抗生素,还原性谷胱甘肽等。
1.2 引物设计
以NCBI发布的布鲁氏菌编码L7/L12蛋白的基因序列为母板设计引物,将设计好的基因引物送至生工公司进行合成。引物序列为L7/L12-F,5′-ATGGCTGATCTCGCAAAGATCG-3′;L7/L12-R,5′-CTTGAGTTCAACCTTGGCGCC-3′。引物为冻干粉,使用灭菌的超纯水溶解并稀释至10 μmol·L,-20 ℃备用。
1.3 扩增L7/L12目的基因
将布鲁氏菌S2疫苗株置于100 ℃的水浴锅中煮沸15 min灭活后提取布鲁氏菌的全基因组,并以此为模板扩增编码L7/L12蛋白的基因,PCR扩增结束后,经1.2%琼脂糖凝胶电泳并回收L7/L12基因条带。
1.4 表达载体的构建及鉴定
用HⅠ和Ⅰ双酶切L7/L12基因和pET-30a载体并用胶回收试剂盒回收酶切产物,用T4快连酶室温连接L7/L12基因与pET-30a载体15 min。连接结束后经热激法转入DH5α中,将感受态细胞置于摇床中复苏40 min后涂在含有Kan抗性的LB平板上,倒置于37 ℃培养箱中培养。10~14 h后选取单个菌落加入含Kan抗性的LB液体培养基中过夜摇菌,并以菌液为模板进行PCR扩增验证,PCR扩增阳性的菌液提取质粒并在37 ℃条件下进行双酶切鉴定,将鉴定正确的质粒送至擎科公司测序鉴定。
1.5 重组蛋白的表达
经测序结果与L7/L12序列比对后,将正确的质粒转入BL21中培养10~14 h。次日选单个菌落加入含Kan抗性的LB液体培养基中摇菌6~8 h。然后分别吸取2 mL菌液转接于200 mL含Kan抗性的液体LB中扩菌培养,直到菌液值达到0.4~0.8时,分别加0.25、0.5、1 mmol·L的IPTG,之后分别设置摇床工作的条件为16 ℃ 12 h、28 ℃ 12 h、37 ℃ 5 h。待诱导结束后收集菌液,在4 ℃、9 000×的条件下离心25 min,用0.01 mol·L的PBS清洗管底沉淀,重复此操作以完全清洗掉菌体上所带的培养基。用Lysis equilibration buffer(LE Buffer)悬起菌体后超声破碎,设置破碎仪工作2 s、暂停5 s,超声至菌液清亮、透明为宜,约需要1.5 h。破碎结束后以上述同等条件离心,分别用40 μL上清与沉淀混匀在5×SDS-PAGE蛋白缓冲液中并煮沸10 min,上样10 μL至 SDS-PAGE蛋白凝胶,设置电泳仪的工作电压为120 V,约工作90 min。电泳结束后用考马斯亮蓝染色液对蛋白胶室温染色2~4 h,再用套装脱色液脱色7~8 h,分析重组蛋白质L7/12的表达水平。
1.6 重组蛋白的纯化、浓缩
用LE Buffer平衡His-Tag Ni柱3~4次,将各个诱导条件下的可溶性重组蛋白加入Ni柱,重复挂柱3次以确保可溶性蛋白与Ni柱充分结合。分别用LE Buffer、50、70、85、100、160、250、300 mmol·L咪唑进行洗脱。LE Buffer、50、70、85、100 mmol·L咪唑清洗4个柱体积并收集最后流出的2 mL液体,160、250、300 mmol·L咪唑清洗并回收1个柱体积的清洗液,平衡、挂柱和清洗均采取每分钟约20滴的流速。分别取流穿液、LE Buffer和各个浓度的咪唑清洗液,用1.5节的条件进行电泳分析重组蛋白的纯化条件和纯化后的纯度。
将纯化后的重组蛋白转入经EDTA-Na和EDTA煮沸处理过的透析袋中,将透析袋放置于0.01 mmol·L的PBS溶液中进行透析,PBS的体积约是重组蛋白体积的100倍,每隔12 h换1次透析液,透析2~3 d。透析完成后将其置于PEG8000中进行浓缩,使透析袋表面完全被PEG8000所包裹已有效地吸出重组蛋白中的水分。
1.7 布鲁氏菌核L7/12重组蛋白的 Western-blot分析
取浓缩后的重组蛋白采用1.5节的处理方法和电泳条件煮沸处理并进行电泳,电泳结束后用半干转膜仪转膜,在电压为15 V的条件下约需要40 min,结束后将PVDF膜置于1×case封闭液中过夜封闭,次日弃封闭液用TBST清洗3~4次,每次清洗约15 min,用抗His标签的辣根过氧化物酶抗体室温孵育2 h。孵育结束后用TBST清洗3~4次,洗掉未完全反应的抗体,之后用ECL显色液室温孵育1 min后显色曝光。
1.8 小鼠髓源树突状细胞的体外诱导培养及刺激
在BALB/c雌性小鼠的后肢股中分取髓源树突状细胞的前体,用细胞计数器计量细胞数在10个以上铺板。在含有青链霉素抗性的1640培养基中加入集落刺激因子rmGM-CSF、rmIL-4和胎牛血清配制成完全培养基,将骨髓细胞诱导培养为未成熟DCs。第6天用枪轻轻吹打细胞板底部,清洗半贴壁的细胞将其离心浓缩后转移至新的6孔板,取2 mL用PE-CD11C分子抗体检测DCs细胞的活性。培养至第7天后用LPS、L7/L12刺激DCs细胞,调整L7/L12蛋白终浓度为100 μg·mL和LPS终浓度为100 ng·mL。未处理的DCs为阴性对照组,用LPS刺激作为阳性对照,刺激结束后收取细胞样品和细胞上清,分别用于后期实验。用含有5%胎牛血清的PBS悬浮细胞沉淀,经抗体染色后用流式细胞仪检测DCs表面分子,实验分两组:第一组PE-CD11C、APC-CD40、FITC-MHC-Ⅱ三染;第二组PE-CD11C、APC-CD80、FITC-CD86三染,同时设置空白对照和同型对照,抗体4 ℃避光孵育0.5 h,孵育结束后用PBS洗掉未完全反应残留的抗体,用 FACSC alibur流式细胞仪进行检测,利用流式结果来分析DCs表面分子的相对表达量。
1.9 炎症反应的细胞因子的检测
用Trizol法提取各组细胞的总RNA,测定浓度后用Qiagen Omniscript RT Kit反转录为 cDNA。以反转录所得的cDNA为模板,依照QuantiNovaSYBRGreen PCR Kit说明书配各体系和设置扩增条件,利用Ct值计算各个炎症因子的相对表达量,并进行差异性分析。
2 结果与分析
2.1 L7/L12表达载体的构建
PCR扩增获得编码L7/L12蛋白的DNA片段,约为375 bp共编码125个氨基酸,大小与预期相符(图1)。将该片段与pET30a载体酶切、连接后转入克隆载体DH5α感受态细胞,培养12 h后挑取单克隆进行摇菌,12 h后进行菌液PCR验证 (图2)。用PCR验证为阳性的菌液提质粒并进行双酶切 (图3),将酶切鉴定合适的质粒送至西安擎科公司进行测序鉴定。最后将阳性克隆转入表达载体大肠埃希菌 BL21(DE3)感受态细胞。

M,标准DNA分子量;1~5,PCR扩增样品。M,DNA Marker;1-5,Product of PCR amplification.图1 L7/L12基因表达片段PCR扩增的电泳Fig.1 Electrophoresis of expression fragment of L7/L12 gene by PCR amplification

M,标准DNA分子量;1~3,单克隆菌液PCR扩增;4,阴性对照。M,DNA Marker;1-3,PCR amplification of monoclonal bacteria solution;4,Negative control.图2 克隆载体菌液PCR鉴定Fig.2 Identification of clonal vector bacteria by PCR electrophoresis

M,标准DNA分子量;1,双酶切重组pET30a-L7/L12质粒。M,DNA Marker;1,Recombinant PET30A-L7/L12 plasmid double enzyme digestion.图3 重组pET30a-L7/L12质粒双酶切鉴定Fig.3 Identification of recombinant plasmid pET30a-L7/L12 by double enzyme digestion
2.2 重组蛋白L7/L12的最佳诱导条件的筛选
分别取破碎前的菌体和破碎后的沉淀与上清采用1.5节中的条件进行电泳,脱色结束后可见重组蛋白存在于上清中,大小约为18 ku(图4)。分别在16、28、37 ℃的条件下用 0.25、0.5、1 mmol·LIPTG进行最佳表达条件的筛选,确定在16 ℃过夜诱导时,L7/L12蛋白表达量最大(图5)。

M,标准蛋白质分子量;1,破碎前菌体;2,破碎后沉淀;3,破碎后上清。M,Standard protein marker;1,Whole bacterial protein;2,Lytic precipitation;3,Lytic supernatant.图4 重组蛋白L7/L12诱导表达结果电泳Fig.4 Induced expression of recombinant protein L7/L12
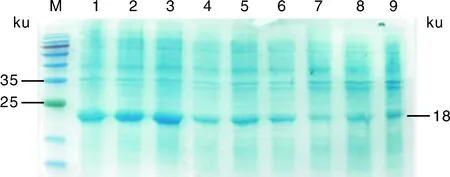
M,标准蛋白质分子量;1~3,16 ℃条件下IPTG浓度分别为0.25、0.5、1 mmol·L-1;4~6,28 ℃条件下IPTG浓度分别为0.25、0.5、1 mmol·L-1;7~9,37 ℃条件下IPTG 浓度分别为0.25、0.5、1 mmol·L-1。M,Standard protein marker;1-3,At 16 ℃,0.25,0.5,1 mmol·L-1 IPTG respectively;4-6,At 28 ℃,0.25,0.5,1 mmol·L-1 IPTG respectively;7-9,At 37 ℃,0.25,0.5,1 mmol·L-1 IPTG respectively.图5 L7/L12蛋白最佳诱导表达条件筛选电泳Fig.5 Selection of optimal inducible expression conditions of L7/L12 protein
2.3 重组蛋白的纯化
SDS-PAGE电泳检测流穿液和各个浓度梯度的咪唑洗脱液,结果显示,流穿液中不含目的蛋白,说明目的蛋白与Ni柱完全结合,100 mmol·L咪唑LE Buffer中含有较多的杂蛋白,但160 mmol·L咪唑LE Buffer中几乎没有杂蛋白的存在,筛选出了100 mmol·L咪唑LE Buffer可以洗净杂蛋白。最后用300 mmol·L的咪唑LE Buffer洗脱目的蛋白(图6)。将纯化后的蛋白转入透析袋中用0.01 mol·L的PBS透析3 d,用PEG8000浓缩重组蛋白后,经BCA试剂盒测定其浓度为1.196 5 mg·L。

M,标准蛋白质分子量;1,L7/L12流穿液;2,LE Buffer 清洗液;3,含50 mmol·L-1咪唑LE Buffer清洗结果;4,含70 mmol·L-1咪唑LE Buffer清洗结果;5,含85 mmol·L-1咪唑LE Buffer清洗结果;6,含100 mmol·L-1咪唑LE Buffer清洗结果;7,含160 mmol·L-1咪唑LE Buffer清洗结果;8,含250 mmol·L-1咪唑LE Buffer清洗结果;9,含300 mmol·L-1咪唑LE Buffer清洗结果。M,Standard protein marker;1,L7/L12 flow-through solution;2,LE Buffer cleaning solution;3,LE Buffer containing 50 mmol·L-1 imidazole cleaning results;4,LE Buffer containing 70 mmol·L-1 imidazole cleaning results;5,LE Buffer 85 mmol·L-1 imidazole cleaning results;6,LE Buffer containing 100 mmol·L-1 imidazole cleaning results;7,LE Buffer containing 160 mmol·L-1 imidazoler cleaning results;8,LE Buffe containing 250 mmol·L-1 imidazole cleaning results;9,LE Buffer containing 300 mmol·L-1 imidazole cleaning results.图6 L7/L12蛋白纯化电泳检测Fig.6 L7/L12 protein purification by electrophoresis
2.4 重组蛋白免疫原性
重组蛋白经SDS-PAGE电泳后转移至PVDF膜上进行免疫印迹反应检测,其结果显示约18 ku处存在特异性条带(图7)。
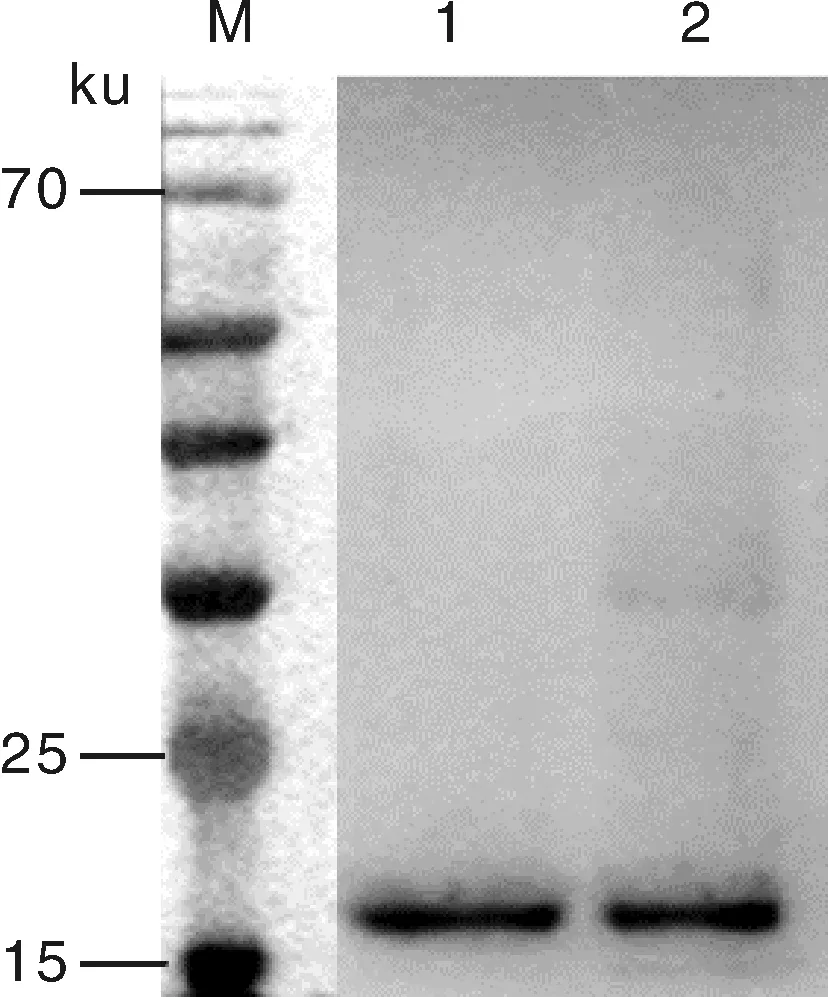
M,标准蛋白质分子量;1~2,L7/L12 蛋白。M,Standard protein marker;1-2,Protein L7/L12.图7 基于Western blot的L7/L12蛋白鉴定Fig.7 Identification of L7/L12 protein by Western blot
2.5 BM-DCs体外诱导培养及纯度检测
用倒置显微镜观察六孔板中培养的DCs形态,刚分离的DCs细胞呈点状漂浮在培养基内,培养24 h后,细胞体积较小呈圆形,有部分贴壁,第2天可观察到有少量聚集在一起,第5 天细胞体积明显变大群落较多,多数细胞呈不规则圆形且边缘分化出树根样突起,培养至第7天,大部分DCs细胞脱离群落,悬浮在培养基中(图8)。
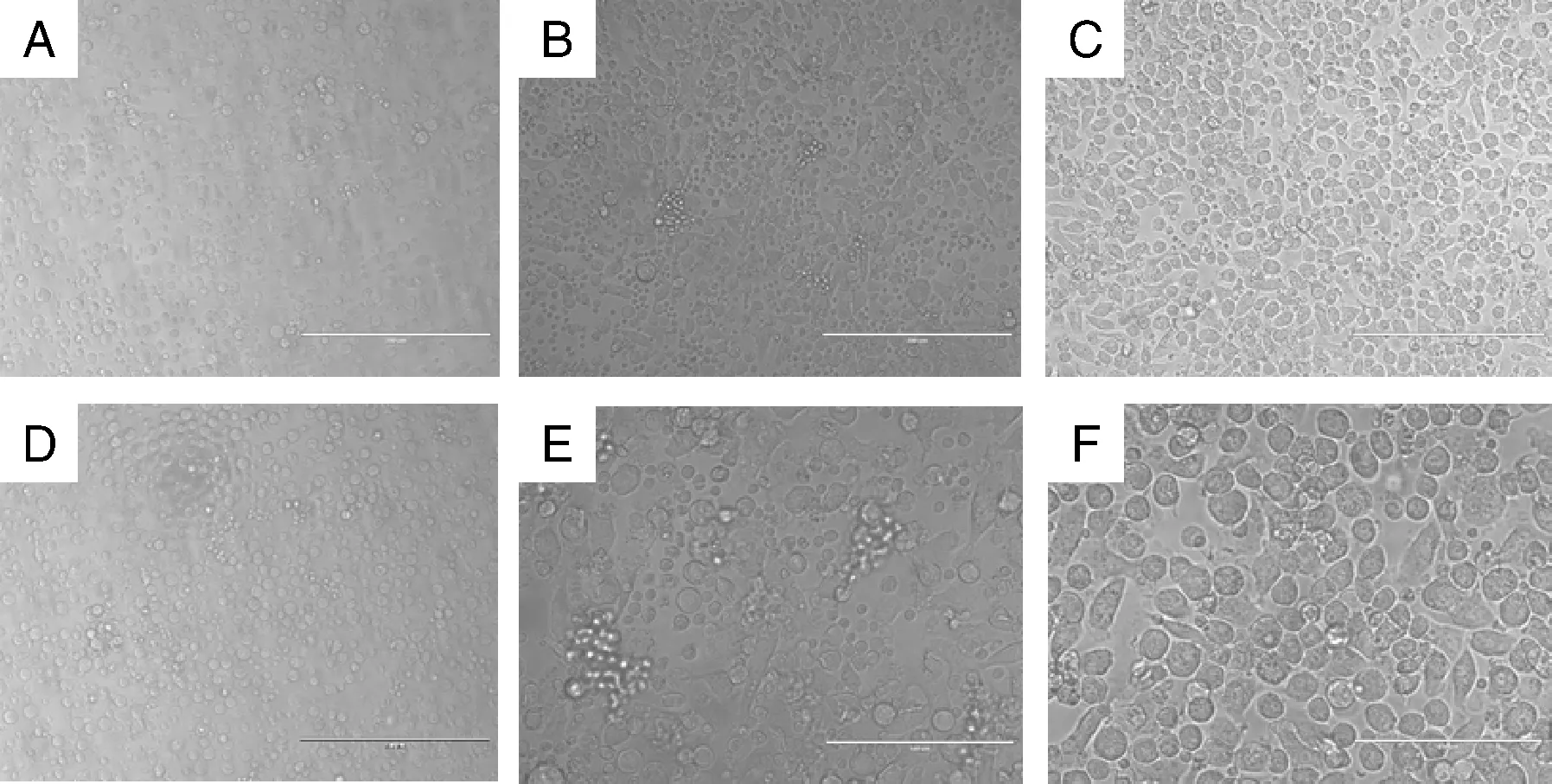
A,诱导培养第2天(×200);B,诱导培养第3天(×200);C,诱导培养第5天(×200);D,诱导培养第5天(×400);E,诱导培养第7天(×200);F,诱导培养第7天(×400)。A,Induction culturing day 2 (×200);B,Induction culturing day 3 (×200);C,Induction culturing day 5 (×200);D,Induction culturing day 5 (×400);E,Induction culturing day 7 (×200);F,Induction culturing day 7 (×400).图8 小鼠髓源树突状细胞体外诱导培养Fig.8 Mouse myeloid dendritic cells cultured in vitro
第6天将悬浮于培养基中的细胞浓缩至新的六孔板中,并取2 mL用PE-CD11C抗体染色后用流式细胞仪检测DCs活性,结果显示:浓缩后的DCs活性可达到50%以上(图9)。
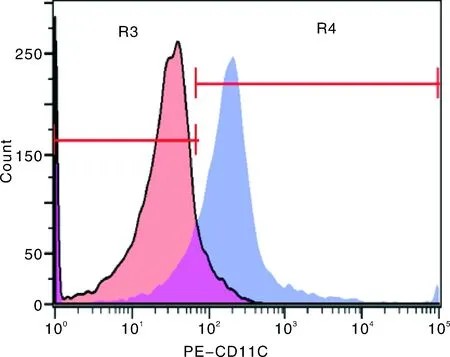
图9 DCs活性检测Fig.9 Activity detection of dendritic cells
2.6 布鲁氏菌核蛋白L7/L12对DCs成熟及细胞因子表达
经rmGM-CSF、rmIL-4诱导培养至第7天,分别用终浓度为100 ng·mL的LPS和100 μg·mL的L7/L12蛋白刺激 BM-DCs 24 h后,用流式分析DCs的表面分子(图10)。与未刺激的阴性对照组(DC组)相比,阳性对照组(LPS组)的CD80、CD40、CD86等分子表达均相对增加,其中CD40和MHC-Ⅱ分子的表达增加比较明显,经L7/L12蛋白刺激的实验组的CD40、CD80、CD86和MHC-Ⅱ分子的表达量也相对增加,但是CD86和CD80的表达量增加不明显。实验组与阳性对照组相比较也均增加,其中CD40和MHC-Ⅱ分子均高表达(图11)。

图10 处理前后DCs表面共刺激分子的变化Fig.10 Changes of co-stimulating molecules on DCs surface

DC,未处理的DCs细胞(空白对照);LPS,脂多糖(阳性对照);L7/L12,L7/L12重组蛋白(实验组);***,P<0.01。下同。DC,Untreated DCs cells;LPS,Lipopolysaccharide(positive control);L7/L12,L7/L12 recombinant protein (experimental group);***,P<0.01.The same as below.图11 DC细胞表面共刺激分子的表达差异Fig.11 Difference in expression of costimulatory molecules on the surface of DC cells
2.7 布鲁氏菌核蛋白L7/L12对 DCs炎性因子分泌的影响
利用qPCR扩增的Ct值计算出实验组和对照组的相对表达量,利用SPASS5.0进行差异性分析,结果显示,qPCR检测DCs炎性细胞因子的mRNA水平,与空白对照组(DC组)相比较,阳性对照(LPS组)和实验组(L7/L12蛋白组)的IL-1β、IL-12、TNF等分子极显著升高(<0.01),其中IL-12的mRNA的表达量在阳性对照组和实验组之间没有明显的差别,实验组中TNF的mRNA的表达量明显高于阳性对照组,但是IL-1β的mRNA的表达量却与此相反,LPS组的表达量高于L7/L12蛋白组(图12)。

IL-12,白介素12;TNF,肿瘤坏死因子;IL-1β,白介素1β。IL-12,Interleukin12;TNF,Tumor necrosis factor;IL-1β,Interleukin 1β..图12 L7/L12蛋白和LPS处理后DCs炎性因子的表达Fig.12 Changes of expression of inflammatory factors in DCs treated with L7/L12 protein and LPS
3 讨论
布鲁氏菌的L7/12核蛋白属于该菌的优势抗原,能够诱导机体产生特异性免疫应答。Oliveira等证明重组形式的 L7/L12 蛋白可以诱导T细胞的活化,刺激Th1淋巴辅助细胞释放IFN-γ,并证明用L7/L12 蛋白制作的疫苗对牛布鲁氏菌感染起保护作用。Kurar等证实经L7/L12核酸疫苗免疫的小鼠对猪布鲁氏菌的抵抗力有明显的提高。最近还证实L7/L12核糖体蛋白能引发机体的迟缓型变态反应。树突状细胞是初始免疫应答抗原提呈能力最强的细胞,发挥加工处理抗原功能的树突状细胞是没有分化成熟的DCs,外来抗原经APC摄入、蛋白酶溶解处理后部分抗原肽片段与MHC Ⅱ分子结合,通过淋巴、血液循环迁移至淋巴器官激发T细胞,可激发相应CD4T细胞的增殖。受到抗原刺激的树突状细胞会分化、成熟,相应地MHC分子、表面共刺激因子、黏附分子的表达显著升高,成熟的DCs细胞为效应性T细胞的生物学信号,但摄取加工抗原的能力显著降低。CD86和CD80是为T细胞的增殖分化提供必要的共刺激信号,可活化并促进T淋巴细胞的增殖分化,增强机体的免疫效应,在特异性细胞免疫应答中发挥着至关重要的作用。与阴性对照组相比,经LPS和L7/L12刺激后DCs表面共刺激分子CD80、CD86、CD40上调,说明该蛋白和LPS一样有着刺激DCs细胞活化、成熟的作用,还表明在L7/L12蛋白的作用下DCs对T淋巴细胞的活化充当着第二信号分子。而MHC Ⅱ类分子显著升高,表明该蛋白促进DCs细胞表达MHC II分子来结合外源性抗原肽,将抗原递呈给T细胞,从而发生细胞免疫应答。成熟的 DCs 可分泌 IL-12、IL-10等细胞因子,细胞因子的种类决定后续免疫应答的类型。qRT-PCR结果显示,炎性因子IL-12显著升高,表明树突状细胞经L7/L12蛋白刺激后分泌的IL-12诱发TH1辅助细胞发生免疫反应,与Oliveira等的结果相一致。炎性因子TNF-β、IL-1β高表达,表明被刺激活化的DCs能将抗原提呈给T淋巴细胞,使T淋巴细胞活化并分泌TNF-β,进而刺激产生IL-1β,同时刺激B淋巴细胞增值分化,促进抗体的生成,从而发挥炎症反应。
综上所述,本实验表达的L7/L12蛋白能够刺激树突状细胞分化、成熟,促进DCs递呈抗原至初始T淋巴细胞,刺激T淋巴细胞活化分泌TNF-β、IL-1β并且促使T细胞向Th1细胞分化,证明L7/L12蛋白在炎症反应过程中发挥着重要作用。
