β-葡聚糖酶降解黑木耳多糖工艺研究
2022-03-27吴迪王旭升于特曹慧馨赵竞吴琼
吴迪,王旭升,于特,曹慧馨,赵竞,吴琼*
(1.长春大学 食品科学与工程学院,吉林 长春 130022;2.长春市十一高中,吉林 长春 130000)
黑木耳(Auricularia auricula)又称为黑菜、桑耳,木耳科木耳属真菌[1],是一种具有价值的食用菌[2],其中的黑木耳多糖具有抗肿瘤、抗凝血、抗氧化、降血脂、降血糖等多种生物活性[3]。但天然的黑木耳多糖分子量大、形成的溶液黏度较大[4-5],不利于黑木耳多糖的进一步开发及利用,因此,将高分子量的黑木耳多糖降解成低分子量且溶解黏度小的酶解多糖[6],对黑木耳多糖的应用具有重要意义。研究表明,酶解后多糖的生物活性会得到明显的提高[7],多糖酶解主要是通过改变多糖的分子结构、分子质量、溶解度及取代基的种类、数量以实现其理化性质的改变、生物活性的增强等效果[8-9]。
黑木耳多糖主要由水溶性β-D-葡聚糖、水不溶性β-D-葡聚糖和2种酸性杂多糖构成[10-11],且两种β-D-葡聚糖都是由β-1,3-糖苷键连接而成。β-葡聚糖酶(β-glucanase) 是可降解 β-1,3-糖苷键、β-1,4-糖苷键的水解酶,可使多糖改性增溶[12-13],基于此,本试验将β-葡聚糖酶作为外源酶酶解黑木耳多糖,并通过调节加酶量、酶解pH值、酶解时间和酶解温度进行试验,降低黑木耳多糖的分子量[14],得到最佳降解效果。
1 材料与方法
1.1 材料与试剂
黑木耳:市售;氢氧化钠、柠檬酸:北京化工厂;3-5二硝基水杨酸:国药集团化学试剂有限公司;β-葡聚糖酶(20 000 U/g):河南万邦实业有限公司;溴化钾:天津科密欧化学试剂有限公司。
1.2 仪器与设备
高效液相色谱仪(SPD-20A):岛津仪器(苏州)有限公司;红外光谱仪(NICOLET iS5):赛默飞世尔科技有限公司;集热式恒温加热磁力搅拌器(DF-101S):巩义市予华仪器有限责任公司;医用离心机(3K15):曦玛离心机有限公司。
1.3 试验方法
1.3.1 黑木耳多糖的提取
称取黑木耳粉末40 g,采用水提醇沉法对黑木耳多糖进行提取[15-16],以料液比 1∶10(g/mL)加入 80%的乙醇溶液,70℃下浸提2次,每次2 h,将滤渣60℃烘干,以料液比1∶30(g/mL)称取滤渣并加入蒸馏水,90℃下浸提2次,每次4 h,3 500 r/min离心20 min得上清液,旋转蒸发至原体积的1/4,所得的浓缩溶液即为黑木耳粗多糖。向浓缩溶液中加入三氯乙酸,4℃冰箱中静置24 h,4 000 r/min离心20 min得黑木耳多糖[17],加入4倍体积的无水乙醇,将其放入4℃冰箱中静置24 h,8 000 r/min离心20 min,所得沉淀冻干,得黑木耳多糖[18]。
1.3.2 黑木耳多糖的降解
取100 mL 10 mg/mL黑木耳多糖溶液,通过添加柠檬酸或 NaOH 调节酶解 pH 值 4.4、4.8、5.2、5.6、6.0,按加酶量 300、500、700 、900、1 100 U/g分别添加至配制好的多糖溶液中,在酶解温度 10、20、30、40、50℃,酶解时间 1.0、1.5、2.0、2.5、3.0 h 下,测定筛选最佳反应条件。
在最佳工艺条件下制备黑木耳酶解多糖,通过添加柠檬酸或NaOH将黑木耳多糖溶液的pH值调至5.2,按加酶量700 U/g加入β-葡聚糖酶,置于30℃恒温振荡水槽中反应2 h,反应后沸水浴10 min灭活β-葡聚糖酶,6 000 r/min离心5 min,加入4倍体积无水乙醇,将其放入4℃冰箱中静置24 h,8 000 r/min离心20 min,所得沉淀冻干,得黑木耳酶解多糖。
1.3.3 还原糖生成量测定
量取0.5 mL离心后的上清液放入试管中,加入1.5 mL二硝基水杨酸试剂,沸水浴5 min,加蒸馏水定容至10 mL。于540 nm处测定吸光度,3次平行试验,通过下式计算还原糖生成量。

1.3.4 溶解率的测定
取酶解前后的黑木耳多糖10 mg于EP管中,充分溶解,在8 000 r/min离心10 min,除去上清液,在50℃下烘至完全干燥,称重,通过下式计算溶解率。

1.3.5 多糖的结构分析
1.3.5.1 分子量测定
将样品配制成5 mg/mL的溶液,0.22 μm微孔滤膜过滤后取20 μL溶液进样。根据标准曲线计算样品分子量。采用高效液相色谱对酶解前后黑木耳多糖的分子量进行测定,分子量标准曲线如图1所示。

图1 分子量测定标准曲线Fig.1 Standard curve for molecular weight determination
以RID-10A示差折射检测器,不锈钢色谱柱7.8 mm×300 mm,柱温为35℃,流动相为超纯水,流速为0.5 mL/min,分子量标准曲线的绘制以保留时间为横坐标,以标准葡聚糖的分子量对数(lgMw)为纵坐标,得标准曲线 y=-0.191 4x+0.951 8,R2=0.995 4。
1.3.5.2 红外光谱测定
在相对干燥环境下,取1 mg样品与0.18 g溴化钾混合研磨均匀,压片,在波段400 cm-1~4 000 cm-1处进行红外光谱扫描[19],检测样品中是否存在多糖的特征吸收峰。
1.3.5.3 紫外-可见光谱分析
用去离子水配制浓度为0.3 mg/mL的β-葡聚糖酶解黑木耳多糖溶液,以去离子水作为空白对照,在200 nm~800 nm内进行紫外全波段扫描,检测样品中是否具有核酸和蛋白质的特征吸收峰。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 加酶量对还原糖生成量的影响
加酶量对还原糖生成量的影响如图2所示。

图2 加酶量对黑木耳多糖降解效率的影响Fig.2 Effect of enzyme dosage on the degradation efficiency of Auricularia auricula polysaccharide
还原糖生成量随加酶量增加先增大后减小,这是由于当加酶量大于一定值后,底物被充分利用,还原糖生成量不再增多,如果继续增加β-葡聚糖酶的量会导致酶之间出现相互附着的情况,降低了酶与底物之间的作用效果,导致酶不能更好地分解黑木耳多糖,因此,在以还原糖的生成量为参考指标时,最适加酶量在300 U/g~700 U/g。
2.1.2 酶解pH值对还原糖生成量的影响
酶解pH值对还原糖生成量的影响如图3所示。
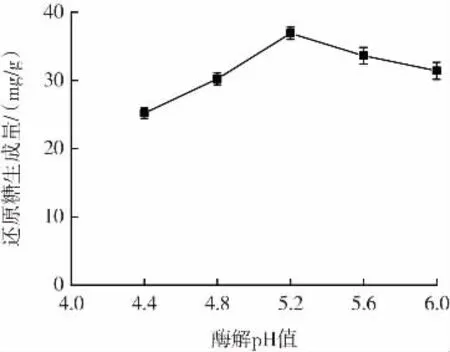
图3 酶解pH值对黑木耳多糖降解效率的影响Fig.3 Effect of pH value on the degradation efficiency of Auricularia auricula polysaccharide
还原糖生成量会根据pH值的不同而变化,pH值过高或过低时还原糖生成量都较低,这是由于在多糖溶液中pH值大于或小于β-葡聚糖酶的最适pH值时,酶的活性被抑制,导致β-葡聚糖酶对黑木耳多糖分子的催化作用变弱,因此影响了β-葡聚糖对黑木耳多糖的降解效率。因此,酶解最适pH值在4.8~5.6。
2.1.3 酶解时间对还原糖生成量的影响
酶解时间对还原糖生成量的影响如图4所示。
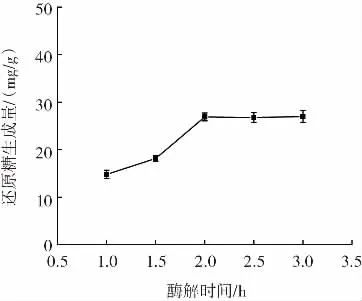
图4 酶解时间对黑木耳多糖降解效率的影响Fig.4 Effect of enzymolysis time on the degradation efficiency of Auricularia auricula polysaccharide
还原糖生成量随着酶解时间的增加先增大后趋于平缓,这是因为随着酶解时间的延长,底物的多糖溶液在β-葡聚糖酶的作用下不断减少,在2 h后底物被完全利用,曲线开始呈现平滑趋势,因此,确定最佳酶解时间在2 h~3 h。
2.1.4 酶解温度对还原糖生成量的影响
酶解温度对还原糖生成量的影响如图5所示。
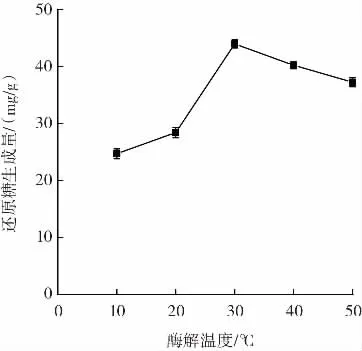
图5 酶解温度对黑木耳多糖降解效率的影响Fig.5 Effect of enzymolysis temperature on the degradation efficiency of Auricularia auricula polysaccharide
还原糖的生成量随着温度的升高,先上升后下降,这是由于在30℃之前,随着温度的升高,黑木耳多糖分子以及β-葡聚糖酶分子之间的运动速度加快,相互接触的机会增大[20],使得反应速率加快,因此曲线呈快速上升的趋势,在30℃时达到最大值;当反应温度大于30℃时,β-葡聚糖酶由于吸收了过多热量,自身化学键不稳定[21],发生断裂,最终导致酶活性降低甚至丧失,黑木耳多糖的降解效率也随之降低,因此,最适酶解温度在25℃~35℃。
2.2 正交试验
以单因素试验结果为依据,设计以加酶量、酶解pH值、酶解时间、酶解温度的正交试验。各因素水平设置如表1所示。
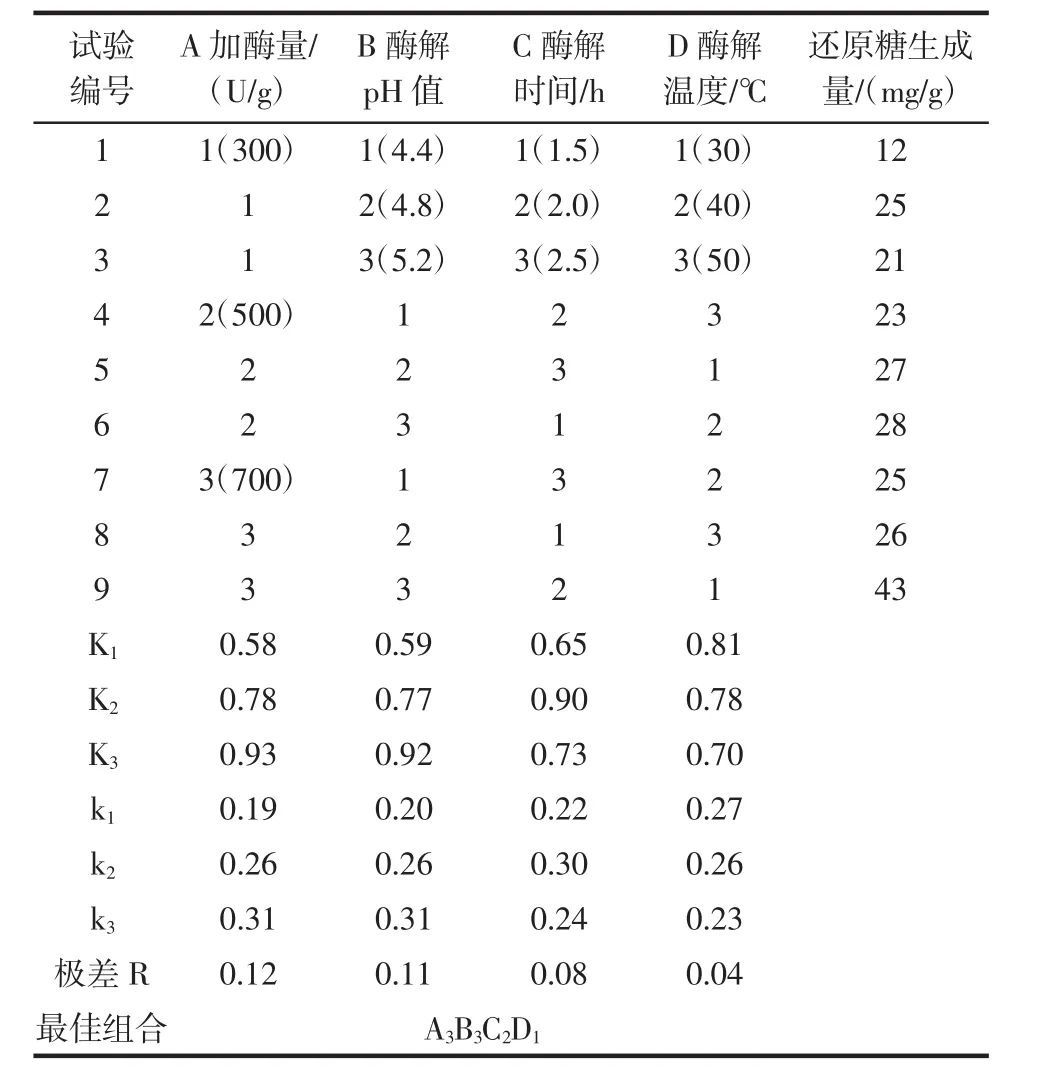
表1 正交试验设计Table 1 Orthogonal experimental design
极差分析结果表明,对β-葡聚糖酶活力影响的主次顺序:加酶量>酶解pH值>酶解时间>酶解温度,最佳酶解条件为加酶量700 U/g,酶解pH值5.2,酶解时间2h,酶解温度30℃,即最优参数组合为A3B3C2D1。通过验证试验,在最佳条件下,还原糖生成量为42.64 mg/g,证实正交试验结果可信。
2.3 溶解率
酶解前后黑木耳多糖干物质重分别为0.026 6、0.0243g,酶解前后黑木耳多糖的溶解率分别为37.96%、41.56%,酶解前后黑木耳多糖溶解率提高了3.6%。
2.4 分子量分析
酶解前后黑木耳多糖分子量图谱如图6所示。
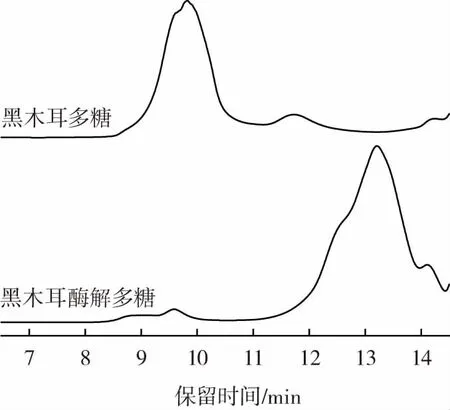
图6 酶解前后黑木耳多糖分子量图谱Fig.6 Molecular weight map of Auricularia auricula polysaccharide before and after enzymolysis
由图6可知,采用凝胶色谱法测定各标准样品的保留时间与分子量之间的关系,由图6可知,黑木耳多糖及其酶解多糖的保留时间分别是9.823、13.209 min,由标准曲线得出其分子量分别为131 300、3 388 Da,分析结果表明,酶解后黑木耳多糖保留时间延后,酶解前后分子量降低了127 912 Da,说明酶解对多糖分子量的降低具有很好的作用。
2.5 红外光谱分析
红外光谱扫描结果如图7所示。

图7 酶解多糖的红外光谱图Fig.7 Infrared spectrum of enzymolysis polysaccharide
由图7可知,黑木耳酶解多糖在3 404、2 929、1 729、1 622、1 375、1 250、1 038 cm-1的附近存在吸收峰,在3 404 cm-1处的强吸收是-OH的伸缩振动峰,在2 929 cm-1处的峰是CH3和-CH2-中C-H键的伸缩振动峰[22],1 375 cm-1处的吸收峰为C-H键的变角振动,其与C-H的伸缩振动构成了糖环的吸收[23],1 729 cm-1处的吸收峰表明多糖中含有糖醛酸,1 622 cm-1处的吸收峰是分子内氢键的特征峰[24],在1 250 cm-1处的振动是由于O-H的拉伸和振动造成的,可以推断,黑木耳酶解多糖具有多糖的特征吸收峰[25]。
2.6 紫外-可见光谱分析结果
紫外光谱扫描结果如图8所示。
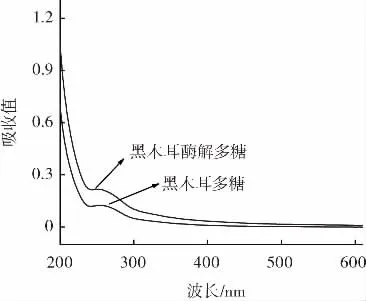
图8 酶解前后黑木耳多糖的紫外全波段扫描图Fig.8 UV scanning of Auricularia auricula polysaccharide before and after enzymolysis
由图8可知,最大吸收峰比较集中,黑木耳多糖的成分较为单一,吸收峰主要在250 mm~280 nm,说明酶解前后的黑木耳多糖可能含有少量的蛋白质或核酸等成分[26-27]。
3 结论
本研究以水提醇沉法提取黑木耳多糖,并用β-葡聚糖酶酶解,得酶解最佳条件,即在加酶量700 U/g、酶解pH值5.2、酶解时间2 h、酶解温度30℃的条件下,得到的还原糖生成量为42.64 mg/g,并对酶解前后样品的溶解率、分子量、红外光谱以及紫外全光谱进行测定,对黑木耳多糖酶解前后的结构进行表征,酶解前后黑木耳多糖的溶解率分别37.96%、41.56%,酶解后溶解率提高了3.6%,说明酶解使黑木耳多糖的溶解率得到提高;酶解前后的黑木耳多糖分子量分别为131 300、3 388 Da,酶解后分子量降低了127 912 Da,表明酶解有效降低了黑木耳多糖的分子量;通过FTIR分析发现,酶解前后黑木耳多糖的主要吸收峰没有变化,说明酶解对黑木耳多糖的主要结构没有影响。研究表明,将黑木耳多糖从高分子量降低成低分子量,可以提高其生物活性,并且低分子多糖更易被人体吸收,因此,本项研究对黑木耳多糖降解工艺的研究具有一定的推动作用。
