板栗壳黄酮提取工艺优化及其组成分析
2022-03-27张家音李浩楠雷嗣超赵泓涛黄雪薇杨芳
张家音,李浩楠,雷嗣超,赵泓涛,黄雪薇,杨芳
(武汉工程大学 环境生态与生物工程学院,湖北 武汉 430205)
板栗(Castanea mollissima Blume)为双子叶植物,在我国分布很广[1],尤其在低山丘陵的缓坡和河滩地段较为多见。目前,板栗加工主要以果仁为主,其加工副产物板栗壳通常是被丢弃或者焚烧,这样既破坏环境,又浪费资源。已有研究表明,板栗壳中含有酚类[2]、香豆素、有机酸[3]、多糖[4]、黄酮[5]、植物甾醇和鞣质[6]等多种生理活性成分,具有降血脂[7]、抗氧化[8-9]、抑菌[10]、营养保健[11]抗肿瘤活性[12]等功能。
研究表明,板栗壳黄酮含量丰富,约占6%左右[13],具有重要的利用价值,目前,实验室常用热水提取法、有机溶剂提取法、碱提法、酶辅助提取法、微波辅助提法、超声波辅助提法以及超临界流体萃取法[14]等方法提取黄酮。热水提取法只可提取黄酮苷类,且提取物在放置过程中容易变质;而用碱提法提取,其提取过程易受杂质影响,从而影响黄酮得率;另外,酶辅助提取法操作相对来说比较复杂;微波、超声波辅助提取法和超临界流体萃取法所需的实验设备费用较高。所以,综合考虑黄酮得率、纯度以及设备条件等因素,本试验采用醇提取法作为黄酮的提取方法[15-16]对板栗加工废弃物中活性成分黄酮的提取工艺进行优化,为进一步研究板栗壳黄酮的组成及功能活性奠定了基础,同时有效地避免了资源的浪费。在单因素试验基础上,经过响应面分析法得到板栗壳黄酮的最佳提取工艺,并采用超高效液相色谱-电喷雾电离-串联质谱(ultra performance liquid chromatography-electrospray ionization-tandem mass spectrometry,UPLC-ESI-MS/MS)技术,对最优条件下提取的板栗壳黄酮类物质的组成进行分析,以期提高板栗壳黄酮的提取得率,并为板栗壳黄酮功能因子开发提供参考依据。
1 材料与方法
1.1 材料与试剂
板栗(产自山东临沂沂蒙山):市售;芦丁标准品(纯度98%)、亚硝酸钠(分析纯)、硝酸铝九水合物(分析纯)、乙腈(色谱纯)、乙酸(色谱纯)、滤膜(0.22 μm):上海麦克林生化科技有限公司;氢氧化钠(分析纯):郑州派尼化学试剂厂;无水乙醇(色谱纯)、甲醇(色谱纯):默克公司。
1.2 仪器与设备
FW80型高速万能粉碎机:天津市泰斯特仪器有限公司;PL-203分析天平:梅特勒托利多仪器(上海)公司;标准检验筛(20目、60目):浙江上虞市五四纱筛厂;RE-2000A旋转蒸发器:上海亚荣生化仪器厂;LGJ-10真空冷冻干燥机:北京松源华兴科技发展有限公司;THZ-100恒温培养摇床:上海一恒科学仪器有限公司;DZKW-D-2电热恒温水浴锅:北京永光明医疗仪器有限公司;SHZ-D3循环水式多用真空泵:河南省予华仪器有限责任公司;UV-1800紫外-可见分光光度计:上海翱艺仪器有限公司;XHF-DY高速分散器:宁波新芝生物科技股份有限公司;Ultimate 3000型超高效液相色谱仪:美国Dionex公司;QTRAP 6500型液相色谱质谱联用仪、Water ACQUITY UPLC HSS T3 C18型色谱柱:赛默飞世尔科技有限公司。
1.3 方法
1.3.1 板栗壳黄酮的提取工艺
将板栗壳去杂后用水洗净,自然干燥至表面无水分之后放入55℃烘干箱中烘干,烘干后粉碎并过20目筛,重复粉碎直至板栗壳的大小为20目。
参考王敏等[17]、苏云霞等[18]的研究思路和提取方法,并加以改动。将水提取液改为乙醇-水的混合提取液,恒温水浴提取改为恒温培养摇床提取,真空浓缩改为旋转蒸发器浓缩,具体工艺如下:准确称取10.00 g板栗壳粉于150 mL的锥形瓶中,加入试验设定的相应体积分数的乙醇溶液后,于一定提取温度的恒温培养摇床中振荡提取一定时间,冷却后进行真空抽滤并在40℃条件下旋转蒸发浓缩,冷冻干燥浓缩液后得到黄酮粗提物(冻干粉)。
1.3.2 板栗壳黄酮的测定
1.3.2.1 芦丁标准曲线的绘制
参考黄雪薇等[19]的方法,以乙醇溶液为提取剂,配制浓度梯度为 0、0.05、0.10、0.15、0.20、0.25、0.30、0.35 mg/mL标准品溶液。在510 nm处测定吸光度并绘制芦丁标准曲线,得到回归方程为Y=11.54X-0.093 1,R2=0.999 4。
1.3.2.2 总黄酮得率的测定
根据1.3.2.1中的回归方程,按照公式(1)计算板栗壳总黄酮得率。

式中:c为代入芦丁标准曲线后得到的板栗壳黄酮提取物的质量浓度,mg/mL;V为待测样体积,mL;M为板栗壳粉的质量,g;n为稀释倍数。
1.3.3 单因素试验
除变量外固定其他工艺条件[乙醇体积分数、液料比、提取时间及提取温度为 70%、15∶1(mL/g)、90 min及55℃]不变的情况下,分别考察乙醇体积分数(40%、50%、60%、70%、80%)、液料比 [10∶1、15∶1、20∶1、25∶1、30∶1(mL/g)]、提取时间(60、70、80、90、100 min)、提取温度(50、55、60、65、70℃)对板栗壳总黄酮得率的影响。
1.3.4 响应面试验设计
以单因素试验为基础,以乙醇体积分数(%)、液料比(mL/g)、提取时间(min)和提取温度(℃)这4个对板栗壳总黄酮得率影响较大的因素为自变量,以板栗壳总黄酮得率为响应值,进行Box-Behnken试验设计,通过响应面的结果分析得到优化的黄酮提取参数。试验因素及水平见表1。

表1 试验因素及水平Table 1 Test factors and levels
1.3.5 组成分析
1.3.5.1 样品的制备
称取1.3.1中的板栗壳黄酮粗提冻干粉0.1 g,并用70%甲醇水溶液定容至100 mL,离心后取上清,过0.22 μm 滤膜,备用。
1.3.5.2 色谱条件
色谱条件:Water ACQUITY UPLC HSS T3 C18型色谱柱(2.1 mm×100 mm,1.8 μm);流动相 A 为水和0.04%的乙酸,流动相B为乙腈和0.04%的乙酸;柱温30 ℃;进样量 2 μL;流速 0.40 mL/min;洗脱程序为 0~11.0 min(5%A),11.0 min~12.0 min(5%A),12.0 min~12.1 min(5%~95%A),12.1 min~15.0 min(95%A)。
1.3.5.3 质谱条件
线性离子阱(linear ion trap,LIT)和三重四极杆(triple quadrupole,QQQ)扫描是在Q TRAP 6500三重四极杆-线性离子阱复合质谱系统上获得,该系统配备了电喷雾电离(electrospray ionization,ESI)涡轮增压离子喷雾接口,测试模式为正离子模式。ESI源操作参数:电喷雾电离,温度为500℃,喷雾电压为5 500 V,离子源气Ⅰ、离子源气Ⅱ和气帘气分别为55、60、25 psi(1 psi=6.895 kPa)。仪器调优和质量校准分别在QQQ和LIT模式下,在10 μmol/L和100 μmol/L聚丙二醇溶液中进行。试验使用的碰撞气体(氮气)设置为5 psi,进行多反应监测(multiple reaction monitoring,MRM)试验得到QQQ扫描。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对板栗壳总黄酮得率的影响
乙醇体积分数对板栗壳总黄酮得率的影响见图1。
由图1可以看出,当乙醇体积分数为40%~70%时,随着乙醇体积分数的增大,板栗壳总黄酮得率逐渐上升。当乙醇体积分数达到70%时,乙醇和水的比例达到最佳,总黄酮得率达到最大;当乙醇体积分数大于70%时,板栗壳总黄酮得率降低,可能是由于其他不同结构的醇溶性(如黄酮苷元)和水溶性(如二氢黄酮及二氢黄酮醇)杂质溶出[20],这些物质与板栗壳中待提取的黄酮竞争导致板栗壳总黄酮得率降低。所以选择乙醇体积分数60%~80%作为响应面试验的考察范围。

图1 乙醇体积分数对板栗壳总黄酮得率的影响Fig.1 Effect of ethanol concentration on yield of flavonoid from chestnut shell
2.1.2 液料比对板栗壳总黄酮得率的影响
液料比对板栗壳总黄酮得率的影响见图2。

图2 液料比对板栗壳总黄酮得率的影响Fig.2 Effect of liquid-solid ratio on yield of flavonoid from chestnut shell
由图 2 可以看出,液料比在 10∶1(mL/g)~15∶1(mL/g)范围内,随液料比增大,总黄酮得率大幅度升高,可能是因为适当的液料比加快了黄酮类物质的溶解[21];当液料比在15∶1(mL/g)时总黄酮得率达最高;但液料比继续增加时,因为提取液过多,而黄酮含量几乎不变,整体出现总黄酮得率降低趋势,且在工业上液料比过高存在不易浓缩、溶剂消耗量大的问题。所以将液料比定在 10∶1(mL/g)~20∶1(mL/g)作为响应面的考察范围。
2.1.3 提取时间对板栗壳总黄酮得率的影响
提取时间对板栗壳总黄酮得率的影响见图3。
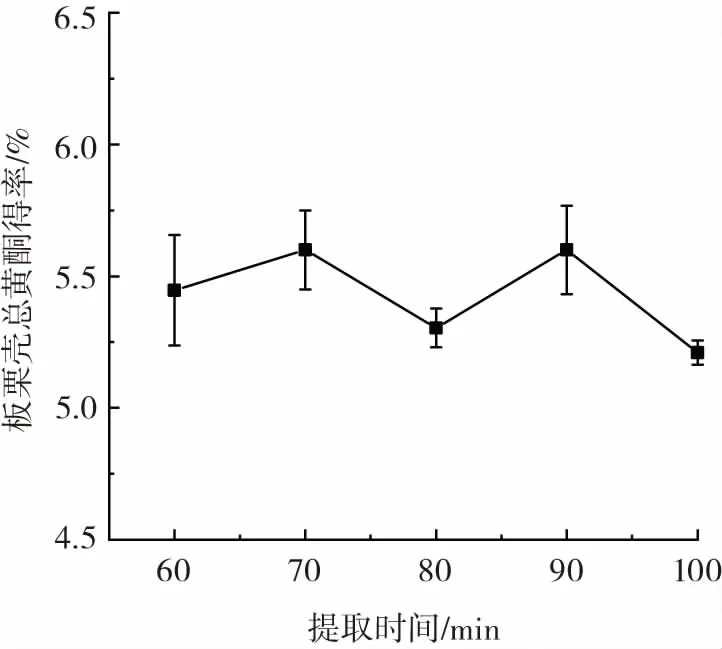
图3 提取时间对板栗壳总黄酮得率的影响Fig.3 Effect of extraction time on yield of flavonoid from chestnut shell
由图3可以看出,提取时间的增加使得板栗壳总黄酮得率呈波动变化,两个峰值分别出现在70 min和90 min处。总体上来说,在60 min~100 min内,黄酮提取率在5.2%~5.6%之间变化,差别并不明显,并且在平行试验间存在一定的差别。而随着提取时间的增长,其他能够溶于乙醇和水的杂质也逐渐溶出,从而抑制了板栗壳黄酮类物质的溶出,同时考虑到黄酮类物质存在着水解的现象,有的黄酮水解只需要数分钟,有的则需很长时间,且在工业上提取时间越长经济支出越高,因此在相同总黄酮得率的情况下,提取时间不宜过长。因此,将提取时间60 min~80 min作为响应面试验的考察范围。
2.1.4 提取温度对板栗壳总黄酮得率的影响
提取温度对板栗壳总黄酮得率的影响见图4。

图4 提取温度对板栗壳总黄酮得率的影响Fig.4 Effect of extraction temperature on yield of flavonoid from chestnut shell
由图4可以看出,提取温度为50℃~65℃时,总黄酮得率整体呈上升趋势。原因可能是提取温度升高分子的扩散运动加快,进而加速了黄酮类物质的溶出[22]。65℃时总黄酮得率达到最高,而提取温度超过65℃时,过高温度,加快其他醇溶性物质的溶出,干扰黄酮在乙醇溶液中的溶出或者是因为温度过高破坏了黄酮类物质的稳定性[23],从而导致总黄酮得率的降低。故选择提取温度60℃~70℃作为响应面试验的考察范围。
2.2 响应面法优化板栗壳总黄酮的提取工艺
2.2.1 响应面试验设计及结果
Box-Behnken试验设计及结果如表2所示。

表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experimental
经回归拟合分析,得到的回归方程:R=6.08-0.5258A+0.139 2B-0.037 5C+0.074 2D-0.345 0AB-0.035 0AC-0.052 5AD+0.042 5BC+0.060 0BD+0.150 0CD-1.02A2-0.440 6B2-0.288 1C2-0.203 1D2。
方差分析结果如表3所示。

表3 方差分析结果Table 3 Results of analysis variance
各因素对黄酮提取率的影响可以通过F值判定,F值越大,其影响越强;P值为该模型与试验各个考察因素的显著程度。表3中模型的F值为14.30,且失拟项P>0.05,差异不显著,具有统计学意义,相关系数R2=0.934 6,表明此方程可以充分的拟合数据,因此板栗壳黄酮提取的最佳工艺条件可以由该模型进行分析。表3中乙醇体积分数A影响极显著(P<0.001),其余一次项B、C、D影响均不显著(P>0.05);在交互因素中AB的影响为显著(P<0.05);在二次项中A2、B2影响极显著(P<0.001),C2影响是高度显著(P<0.01),D2影响显著(P<0.05)。4个影响因素按影响效果大小排列:乙醇体积分数>液料比>提取时间>提取温度。
2.2.2 响应面各因素间的交互分析
响应面图是试验中各因素交互作用的响应值得到的3D曲面图,试验的响应值及各因素之间的影响作用可由图分析。从等高线图和3D图中可以直观地看出两因素对总黄酮得率影响的交互程度,等高线图为椭圆表示相互作用显著,圆形则表示不显著;3D曲面图的爬坡越陡表示两个因素的相互作用越显著,反之则不显著。用Design-Expert 11软件处理得到板栗壳黄酮类物质提取的等高线和3D响应面见图5~图10。

图5 乙醇体积分数与液料比的交互作用Fig.5 Interaction between ethanol concentration and liquid-solid ratio

图6 乙醇体积分数与提取温度的交互作用Fig.6 Interaction between ethanol concentration and extraction temperature
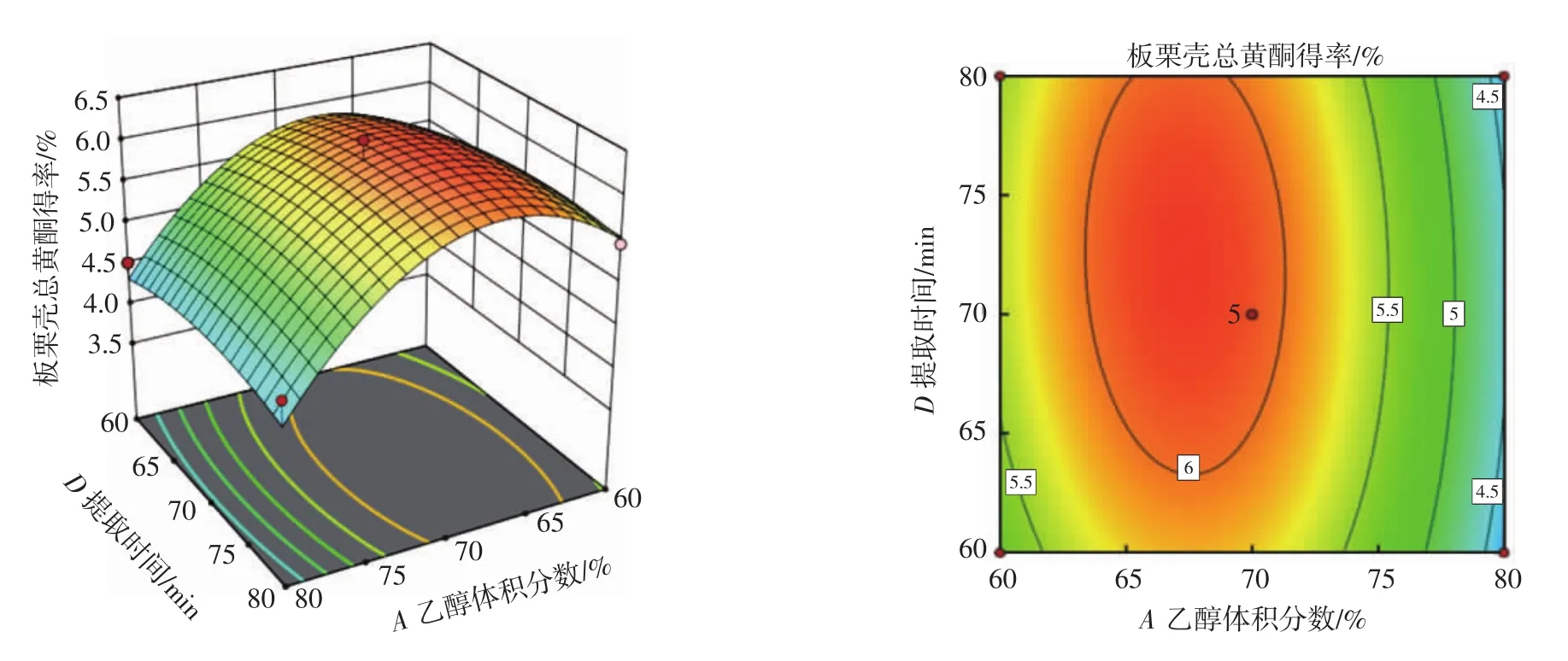
图7 乙醇体积分数与提取时间的交互作用Fig.7 Interaction between ethanol concentration and extraction time
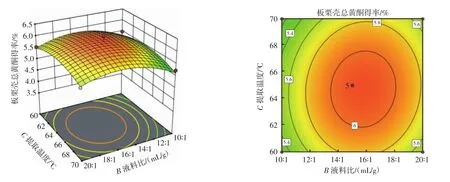
图8 液料比与提取温度的交互作用Fig.8 Interaction between liquid-solid ratio and extraction temperature

图9 液料比与提取时间的交互作用Fig.9 Interaction between liquid-solid ratio and extraction time

图10 提取时间与提取温度的交互作用Fig.10 Interaction between extraction time and temperature
从图5可以看出,乙醇体积分数和液料比这两个因素交互形成的响应面凸出陡峭且等高线图为椭圆形,说明这两个考察因素间的相互作用能够显著影响板栗壳总黄酮的得率,这符合表3的结果。从图6可以看出,当乙醇体积分数固定为一定值时,板栗壳总黄酮得率开始时随着提取温度的升高而增大,到达一定值时,其得率随着提取温度的升高而减小。当提取温度固定为一定值时,板栗壳总黄酮得率随着乙醇体积分数的增大呈现先增大后减小的趋势,但是总体变化趋势较小。从图7可以看出,当乙醇体积分数固定为一定值时,板栗壳总黄酮得率开始时随着提取时间的升高而增大,到达一定值时,其得率随着提取时间的升高而减小。当提取时间固定为一定值时,板栗壳总黄酮得率随着乙醇体积分数的增大呈现先增大后减小的趋势,但是总体变化趋势较为平缓。结合图8~图10和表3,响应面图凸出不明显且等高线图趋于圆形,说明各组两因素的相互作用不能够显著影响板栗壳总黄酮的得率。
2.2.3 最优工艺验证
通过Design-Expert 11软件拟合的结果得到了板栗壳总黄酮得率的最大理论值为6.27%。经计算得出该条件下提取板栗壳黄酮的最佳工艺条件为乙醇体积分数 66.86%,液料比 17.08∶1(mL/g),提取温度65.12℃,提取时间71.98 min。由于实际的操作限制,调整乙醇体积分数、液料比、提取温度以及提取时间分别为 70%、17∶1(mL/g)、65 ℃以及 70 min,在此提取工艺条件下,重复试验5次,得到板栗壳总黄酮得率的平均值为6.14%,接近理论值,说明采用响应面优化分析所得的模型具有可靠性。
2.3 组成分析
板栗壳黄酮组成分析结果见表4(按照含量从高到低排列)。

表4 板栗壳黄酮组成Table 4 Composition of flavonoids from chestnut shell
本试验采用UPLC-ESI-MS/MS技术对板栗壳黄酮的组成进行分析,在正离子模式下,黄酮类化合物的分离度和离子化的效果都较好,共鉴别出37种纯度较高的黄酮。其中6,7,8-三羟基-5-甲氧基黄酮含量最高,其次为香叶木素。
3 结论
本研究以乙醇溶液为提取剂,经过响应面优化得到板栗壳黄酮提取最佳工艺参数:乙醇体积分数70%,液料比 17∶1(mL/g),提取温度 65 ℃,提取时间70 min,此时,总黄酮得率达到6.14%。影响板栗壳总黄酮得率的因素按从大到小排列:乙醇体积分数>液料比>提取时间>提取温度。采用UPLC-ESI-MS/MS技术分析板栗壳中黄酮类化合物共有37种,其中6,7,8-三羟基-5-甲氧基黄酮的含量最高,其次为香叶木素。
