镉暴露条件下玉米生长及根系构型分级特征研究
2022-03-26魏畅焦秋娟柳海涛张静静申凤敏姜瑛张雪海孙娈姿杨芳刘振
魏畅,焦秋娟,柳海涛*,张静静,申凤敏,姜瑛*,张雪海,孙娈姿,杨芳,刘振
(1. 河南农业大学资源与环境学院,河南 郑州 450002;2. 河南农业大学农学院,省部共建小麦玉米作物学国家重点实验室,河南 郑州 450002;3. 西北农林科技大学草业与草原学院,陕西 咸阳 712100;4. 吉林农业大学资源与环境学院,吉林 长春 130118;5. 山东省黄河三角洲生态环境重点实验室,滨州学院,山东 滨州 256603)
近年来,随着工矿业的不断发展,人类赖以生存的土壤不断受到影响,土壤重金属污染问题越来越严重。根据环境保护部和国土资源部于2014 年发布的《全国土壤污染状况调查公报》,全国土壤总的点位超标率为16.1%,受到污染的耕地点位超标率为19.4%[1]。镉(cadmium,Cd)作为主要污染物之一,可通过大气沉降、畜禽粪便、化肥不合理施用以及污水灌溉等途径进入土壤,通过食物链最终进入人的体内,影响人类健康,诱发多种疾病[2]。
玉米(Zea mays)是须根系植物,根系发达,具有生物量大、生长周期短、易管理等特点,不仅可以作为重要的粮食、经济、饲料作物,也可以用于重金属污染的治理与修复。因此,研究玉米对重金属的耐性、吸收积累特征等对保障粮食和饲料安全、挖掘玉米用于污染土壤修复的潜力具有重要意义。陈建军等[3]通过田间试验,比较了25个玉米品种对Cd 胁迫(质量分数为50 mg·kg-1)的响应,大部分品种生物量和产量有所下降。研究表明,不同玉米品种富集和转运Cd 的能力存在明显的差异,其中高积累品种可作为修复植物用于土壤重金属污染治理,而低积累品种可作为保障粮食和饲料安全的品种加以推广[4],其中在酸性土壤条件下(Cd 质量分数为1.29 mg·kg-1),Cd 在玉米植株中的分布规律为根>叶>茎,茎叶Cd 含量与根部Cd 含量呈正相关,说明玉米根系作为一种屏障,一定程度上可以阻止Cd 的迁移[5],这与袁林等[6]在Cd 质量分数为10.47 mg·kg-1的土壤中发现玉米不同器官的Cd 积累特征一致,但是玉米茎的Cd 含量与根部Cd 含量呈负相关。
根系作为最早接触Cd 的器官,Cd 胁迫可影响根系的生物量、解剖结构、形成和发育状态,导致根系变黑并弯曲,其形态的变化可直观反映出根系功能的变化,并和Cd 吸收积累有直接关系[7-9]。曲丹阳等[10]研究发现,与对照相比,在Cd 胁迫浓度为80 mg·L-1时,两个玉米品种(郑单958 和东农253)根系的生物量积累均受到明显抑制,根系形态受到显著影响,根系总长、根表面积、根体积、平均直径和根尖数显著减小。何俊瑜等[11]比较了不同Cd浓度对水稻(Oryza sativa)根系形态及分级特征变化的影响,发现当Cd 浓度>5 μmol·L-1时,随Cd 浓度的升高,水稻的总根长、根表面积和根体积受到不同程度的抑制,其中Cd 对直径≤1.5 mm 根系的根长、根表面积和根体积影响较大。目前关于Cd 对玉米幼苗毒害的研究较多,但Cd 胁迫下玉米根系构型分级变化特征及其与玉米生长和Cd 吸收积累特征的关系尚未见报道。
本试验旨在结合玉米地上和地下部,深入探究不同Cd 胁迫浓度对玉米幼苗根系构型及分级特征、生长及光合作用的影响,丰富玉米对Cd 胁迫的响应机制,为将玉米应用于修复重金属Cd 污染土壤和培育低镉玉米品种提供理论基础与试验支撑。
1 材料与方法
1.1 供试材料
供试玉米品种为郑单958,购于河南秋乐种业科技股份有限公司;营养液使用Hoagland 营养液[12];Cd 源选用CdCl2·2.5H2O。
1.2 试验设置
试验于2020 年7 月在温室进行,选取大小均一的玉米种子,用5%的H2O2消毒15 min,用去离子水反复清洗干净,并泡于育苗盒中12 h,之后于25 ℃黑暗条件催芽72 h 后转入温室。温室设置昼夜条件为16 h/8 h,温度为25 ℃。待玉米生长至一叶一心时,选取长势一致的幼苗移栽到装有Hoagland 营养液的塑料盆中(2 L),每盆9 棵玉米,每2 d 换一次营养液。共设置7 个Cd 浓度,分别为0、5、10、25、50、100、200 μmol·L-1,分别命名为Cd0、Cd5、Cd10、Cd25、Cd50、Cd100和Cd200,各处理设置3 盆重复,施加处理5 d 后采样。
1.3 测定指标与方法
1.3.1 玉米地上地下部生物量 用干净的剪刀将玉米的地上部和地下部分离,用去离子水冲洗干净后擦干表面水分,测得株高、主根长、茎鲜重和根鲜重。地下部于20 mmol·L-1的EDTA-Na2溶液中浸泡15 min,用去离子水重新洗干净,和地上部一同于105 ℃杀青30 min 后,70 ℃累计烘干48 h 至恒重,称得干重。

1.3.2 玉米根系构型指标 各处理选取3 个完整的根系,用根系扫描仪(V700 PHOTO,Epson,日本)和图像分析软件(WinRHIZO™2003b,加拿大)测定玉米幼苗根系构型与分级,测得参数:总根长(total root length,RL)、根表面积(root surface area,SA)、根体积(root volume,RV)、根平均直径(root average diameter,RD)、分枝数(root forks,RF)和根尖数(root tips,RT)。
1.3.3 根系构型分级 以0.5 mm 为度量按照根的直径大小对总根长、根表面积和根体积进行区间等级定义:Ⅰ级:0~0.5 mm(RD 0~0.5 mm)、Ⅱ级:0.5~1.0 mm(RD 0.5~1.0 mm)、Ⅲ级:1.0~1.5 mm(RD 1.0~1.5 mm)、Ⅳ级:1.5~2.0 mm、Ⅴ级:2.0~2.5 mm、Ⅵ级:2.5~3.0 mm、Ⅶ级:3.0~3.5 mm、Ⅷ级:3.5~4.0 mm、Ⅸ级:4.0~4.5 mm、Ⅹ级:>4.5 mm[8](RD>1.5 mm 为Ⅳ到Ⅹ级总和)。
1.3.4 玉米地上地下部Cd 含量 各处理的地上部和地下部分别称取0.2 g 干样放置于清洁的50 mL 三角瓶中,加入10 mL 混酸(HNO3∶HClO4=3∶1),于电热板上消解至澄清透明,赶酸后定容至25 mL 容量瓶中,用原子吸收火焰分光光度法(ZEEnit700,Analytik jena)测定溶液中Cd 离子浓度。
玉米幼苗对Cd 的吸收速率特征采用米氏方程(Michaelis-Menten)计算:

式中:V为植物对Cd 的吸收速率;Vmax为植物对Cd 的最大吸收速率;T为底物浓度;Km为米氏常数;α 表示为植物对Cd 的吸收能力。
动力学参数通过GraphPad Prism 8 拟合得到。
1.3.5 玉米叶片光合参数和叶绿素含量 使用便携式光合测定仪(Li-6400,LICOR 公司,美国)于采样1 d 前测定玉米幼苗顶部第1 片完全展开叶的光合速率(photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)和蒸腾速率(transpiration,Tr)。
采用酒精浸提法测定叶绿素含量。剪碎0.3 g 新鲜的玉米叶片浸泡入25 mL,95%的乙醇中,置于25 ℃黑暗环境,待叶片浸泡至褪色,利用紫外可见分光光度计(L5,上海仪电分析仪器有限公司),以95%的乙醇为空白,在470、649、665 nm 处测得波长,通过计算得出叶绿素a(chlorophyll a,Chl a)、叶绿素b(chlorophyll b,Chl b)、类胡萝卜素(carotenoid)、总叶绿素含量(total chlorophyll,TChl)以及叶绿素a/叶绿素b(Chl a/Chl b)。计算公式为:
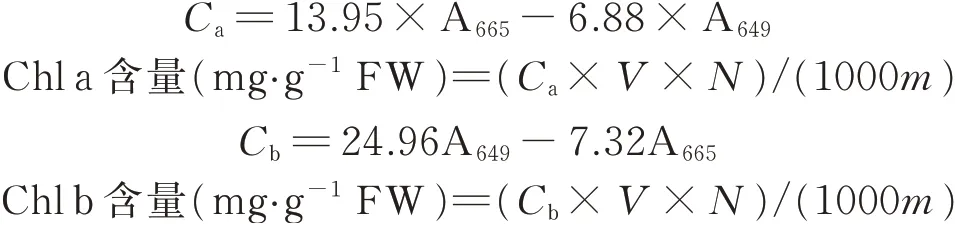
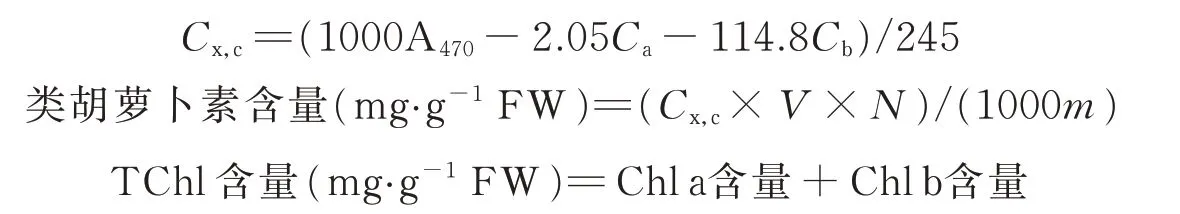
式中:C为色素含量(mg·L-1);V为提取液体积(mL);N为稀释倍数;m为样品质量(g)。
其他条件相同,在每100 mL复原奶中分别添加黄精浸提液0.3%,0.4%,0.5%,0.6%,0.7%,按照1.3.1的工艺流程制作黄精酸奶,考查不同黄精浸提液添加量对黄精酸奶品质的影响,确定黄精浸提液的最佳添加量。
1.4 数据处理
使用Microsoft Excel、SPSS 25 和Metsbo Analyst 进行数据处理和统计分析,通过最小显著差异法(LSD)进行单因素方差分析(one-way ANOVA),确定各处理间差异的显著性(P<0.05),采用Pearson 法进行指标间的相关性分析,采用Origin 2018 和Microsoft Visio 绘图。
2 结果与分析
2.1 不同浓度Cd 胁迫对玉米幼苗生长的影响
Cd 对玉米幼苗的生长发育具有明显的抑制作用(图1),且抑制作用随Cd 胁迫浓度的升高而进一步增强,高浓度的Cd 处理导致玉米根系结构异常,生长发育受阻,叶片发黄。根和茎的耐受指数随Cd 浓度的升高持续下降(表1),且外源Cd 严重抑制玉米幼苗干物质的积累。与对照Cd0相比,随着Cd 胁迫浓度的持续升高,玉米幼苗的株高、地上部鲜重和干重分别显著下降5.60%~52.80%、22.91%~80.86%和19.21%~69.83%(P<0.05);主根长、地下部鲜重和干重各减少14.55%~42.96%、14.23%~51.90%及15.30%~43.91%。根冠比随Cd 胁迫浓度的升高显著增加(P<0.05)。

表1 不同浓度Cd 处理对玉米幼苗生长及耐受指数的影响Table 1 Effect of different Cd treatment on the growth and tolerance index of maize seedlings(mean±SD)

图1 不同浓度Cd 处理对玉米幼苗生长表型的影响Fig.1 Effect of different concentrations of Cd treatment on growth phenotype of maize seedlings
2.2 不同浓度Cd 胁迫对玉米幼苗根系构型分级的影响
Cd 显著抑制了玉米幼苗根系的发育,玉米幼苗的总根长(RL)、根表面积(SA)、根体积(RV)、分枝数(RF)和根尖数(RT)随Cd 胁迫浓度的升高均显著下降(表2),与Cd0相比分别下降39.22%~81.51%、30.09%~70.47%、19.89%~53.09%、51.88%~84.62%和46.50%~81.60%(P<0.05)。但根平均直径(RD)随Cd 胁迫浓度的升高有不同程度的提升,相对于Cd0提高11.58%~59.06%。Cd 对RL、SA 和RV 的影响随根直径大小的不同而异,随着Cd 胁迫浓度的升高,Ⅰ(RD 0~0.5 mm)、Ⅱ(RD 0.5~1.0 mm)和Ⅲ级(RD 1.0~1.5 mm)径级区间的变化趋势一致,均明显受到抑制;在Ⅳ级及以上(RD>1.5 mm)径级区间内均不受Cd 的影响,各处理间无显著性差异(P>0.05),且占比较小。

表2 不同浓度Cd 处理对玉米根系结构和根系分级的影响Table 2 Influence of Cd treatments with different concentrations on root structure and root classification of maize(mean±SD)
在7 个处理下,RD 0~0.5 mm 径级区间的RL 和SA 以及RD 0.5~1.0 mm 径级区间的RV 占据总根系的较大比例;与Cd0相比,随着Cd 胁迫浓度的升高RD 0~0.5 mm 径级区间的RL 和SA 的占比分别降低2.41%~24.07%和6.14%~33.62%,RD 0.5~1.0 mm 径级区间的RV 占比于Cd5处达到最大,相比于其他处理高出10.91%~73.79%(图2)。

图2 不同浓度Cd 处理下玉米幼苗根长、根表面积以及根体积在不同径级区间所占百分比Fig. 2 Maize seedling root length,root surface area and percentage of root volume in different root diameters under different Cd treatments
2.3 不同Cd 浓度胁迫对玉米地上地下部Cd 浓度、含量及转运系数的影响
地上部和地下部的Cd 浓度均随Cd 胁迫浓度的升高显著增加,其中地下部的Cd 浓度明显高于地上部(图3)。地上部、地下部以及整株Cd 含量随Cd 处理浓度的增加在整体上显示出上升的趋势。与Cd0相比,Cd200处理下地上部和地下部的Cd 浓度提高了5.90 和2.49 倍,地上部和地下部的Cd 含量分别是正常生长条件下的2.20 和1.65 倍。外源Cd 浓度达到50 μmol·L-1时转运系数的显著提高会进一步造成地上部Cd 的积累。随外源Cd 胁迫浓度的变化,地上部与地下部Cd 浓度的变化趋势符合米氏方程特征(表3),拟合曲线的R2分别为0.9469 和0.9417。随Cd 胁迫浓度的升高,地上部和地下部对Cd 的吸收显著增加,且地下部的吸收量高于地上部,地下部的Vmax(植物对Cd 的最大吸收速率)和α(植物对Cd 的吸收能力)高于地上部,分别高出了33.40%和795.08%。

表3 玉米幼苗对营养液中不同浓度Cd 吸收的Michaelis-Menten 方程常数Table 3 Michaelis-Menten equation constants of Cd uptake by maize seedlings at different concentrations in growth medium

图3 不同浓度Cd 处理对玉米幼苗组织内Cd 浓度、Cd 含量以及转运系数的影响Fig. 3 Effects of different concentrations of Cd treatment on Cd concentration,Cd accumulation and Cd translocation factors of maize seedling tissue
2.4 不同浓度Cd 胁迫对玉米幼苗光合系统的影响
0~50 μmol·L-1Cd 胁迫浓度对玉米的光合速率(Pn)并无显著影响。气孔导度(Gs)和蒸腾速率(Tr)在Cd 暴露下受到显著的抑制,随Cd 胁迫浓度的提高抑制作用显著增强(P<0.05),且变化趋势相似。在Cd200处 理 下,Pn、Gs和Tr相 对 于Cd0分 别 下 降 了31.50%、66.67%和66.84%(图4)。

图4 不同浓度Cd 处理对玉米幼苗光合参数和叶绿素含量的影响Fig.4 Effects of different concentrations of Cd treatment on photosynthetic parameters and chlorophyll content of maize seedling
叶绿素在植物利用光能方面起着重要作用,可表征植物进行光合作用的能力[13]。与对照组Cd0相比,Chl a、Chl b、类胡萝卜素以及TChl 均随Cd 胁迫浓度的升高整体上呈降低趋势,分别下降15.69%~51.08%、18.10%~47.62%、19.15%~44.68%以及16.51%~50.23%(P<0.05)。Chl a 与Chl b 的比值在Cd25处达到了最大值,与Cd0相比升高6.92%,并随Cd 浓度的进一步升高Chl a/Chl b 呈现出明显下降的趋势,表明在50~200 μmol·L-1Cd 胁迫下,Chl a 相比于Chl b 对重金属Cd 的胁迫更为敏感。
2.5 不同浓度Cd 处理下玉米幼苗各指标之间的主成分分析、热图分析、相关矩阵以及随机森林

图5 不同浓度Cd 处理玉米幼苗各指标变化的主成分分析Fig.5 Principal component analysis of the changes of each index of maize seedlings induced by Cd at different concentrations
相关性分析结果表明,玉米幼苗的地下部Cd 浓度与主根长、地下部鲜重及干重呈极显著负相关(P<0.01),相关系数分别为-0.72、-0.81 和-0.76;地下部Cd 浓度与RL、SA、RV、RF、RT 以及RD 0~0.5 mm、RD 0.5~1.0 mm、RD 1.0~1.5 mm 径级区间的RL,SA 和RV 呈显著负相关(P<0.05)。地下部Cd 浓度与地上部Cd 浓度密切相关,相关系数达到0.94。地上部Cd 浓度与株高、地上部鲜重及干重呈极显著负相关(P<0.01),相关系数分别为-0.95、-0.92 和-0.91;地上部Cd 浓度与Chl a、Chl b、TChl、Chl a/Chl b、Pn、Gs和Tr呈显著负相关(P<0.05)。另外,地下部和地上部Cd 浓度与根冠比的相关系数为0.84 和0.77,均为极显著正相关关系(P<0.01)(图6)。
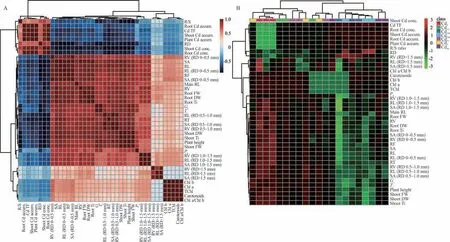
图6 不同浓度Cd 处理玉米幼苗各指标变化的相关性分析(A)和热图(B)Fig. 6 Correlation analysis(A)and thermography(B)of the changes of each index of maize seedlings induced by Cd at different concentrations
随机森林图(图7)表明,对于地下部,营养液中的Cd 首先对地下部Cd 浓度、RD 1.0~1.5 mm 以及RD 0.5~1.0 mm 径级区间的RL 和RT、RD 0.5~1.0 mm 径级区间的SA、转运系数和RD 0.5~1.0 mm 径级区间的RV 依次具有较大的影响;对于地上部,Cd 依次对株高、Cd 含量、地上部鲜重、Cd 浓度、Gs、植株Cd 累积总量、茎耐受指数和地上部干重有重要影响。

图7 不同浓度Cd 处理玉米幼苗各指标变化的随机森林分析Fig.7 Random forest analyze of the changes of each index of maize seedlings induced by Cd at different concentrations
3 讨论
3.1 玉米生长对Cd 胁迫的响应
玉米作为重要的粮食、经济、饲料和修复作物,研究玉米Cd 积累特征对于玉米安全种植、畜牧业的安全生产、土壤修复及人类健康具有重要的理论和实践意义。
Cd 是一种植物非必需的有毒元素,植物苗期对Cd 胁迫尤其敏感,Cd 进入到细胞内导致活性氧含量升高,对细胞膜造成氧化损伤,阻碍矿质元素和水分的吸收运输,扰乱植物体内活性氧和元素平衡稳态,破坏代谢过程中有关酶的结构,最终造成植物生长发育异常[14]。在本试验中,随着Cd 胁迫的加剧,Cd 在玉米体内积累到一定程度,导致玉米的主根长、株高及生物量均显著降低,根系形态发生变化,叶片失绿,出现明显的中毒现象(图1)。同时,玉米对Cd 的耐受指数也逐渐减低,相关性分析表明玉米幼苗地上部和地下部的耐受指数与Cd 浓度呈极显著负相关(P<0.01)。杨超光等[15]在玉米上也发现了类似的现象。
多项研究表明Cd 胁迫会损伤光合器官,抑制光合作用,阻碍叶绿素合成,从而导致玉米地上部生物量积累和生长发育受到显著影响。本研究结果显示,玉米Pn在0~50 μmol·L-1Cd 浓度之间没有显著差异(P>0.05),当Cd 浓度超过100 μmol·L-1时,Pn急剧下降。此结果说明在一定浓度的Cd 胁迫下,玉米通过调节非酶促化学物质含量和抗氧化酶活性、调控Cd 离子在细胞内的再分配等防御措施增强自身抵御Cd 毒害的能力。汪洪等[16]在玉米幼苗的研究中发现,Cd 胁迫可导致光合速率的下降,以及部分抗氧化酶活性随Cd 处理浓度的提高明显提升。Wu 等[17]发现Cd 胁迫条件下,抗氧化酶活性升高,谷胱甘肽(AsA~GSH)循环增强,从而降低丙二醛、活性氧含量,减轻Cd 造成的氧化损伤,增强玉米防御能力。而高浓度的Cd 会造成细胞和代谢过程相关酶结构不可逆性的破坏,进而抑制玉米正常生长发育。本试验中,Gs和Tr也出现类似现象。气孔由保卫细胞组成,是CO2从大气进入植物和植物蒸腾失水的主要通道,能够持续地感知来自环境的信息,包括根部的远距离信号,外界刺激下产生的活性氧可造成保卫细胞的氧化损伤,进而影响植物Pn和Tr[18]。本试验中0~50 μmol·L-1Cd 胁迫下Pn没有受到明显的抑制,而Gs显著降低,与Shi 等[8]在蓖麻子(Ricinus communis)的研究中发现的现象相似;刘大林等[19]发现两种狼尾草(Pennisetum americanum)在5 mg·kg-1Cd 胁迫下净光合速率未显著下降,气孔导度均显著降低(Cd浓度梯度:0、5、25、50、75、100 mg·kg-1),和田野等[20]在30 mg·kg-1Cd 胁迫下黑麦草(Lolium perenne)的研究中发现的现象类似(Cd 浓度梯度:0、30、90、100 mg·kg-1);而钱雷晓等[21]的研究发现在0~5 mg·kg-1的Cd 胁迫范围内,两种小白菜(Brassica campestris)的净光合速率无明显变化,气孔导度出现显著上升的现象;推测本试验中0~50 μmol·L-1Cd 胁迫下,玉米的部分抗逆机制在一定程度上缓解了Cd 对玉米幼苗Pn的抑制作用,气孔限制因素可能是在100~200 μmol·L-1Cd 胁迫下导致Pn降低的诱因之一。
叶绿体作为光合系统中重要的细胞器,是光合作用发生的场所,具有磷脂双分子层膜结构。Cd 可诱导大量活性氧的生成,对脂质造成损伤,表现为脂质过氧化作用增强,膜稳定性降低[22-23],对叶绿体中类囊体的形成具有负面作用[24],损害叶绿体结构[25]。Cd 还可取代叶绿素或酶中的钙离子等必需金属元素,破坏其功能,影响光合色素水平[23-26]。在本研究中,Gs和Tr与Chl a、Chl b 和TChl 呈显著正相关(P<0.05);Chl a、Chl b、TChl、Pn、Gs和Tr与株高、根长、地上部和地下部生物量呈极显著正相关(P<0.01),与根冠比呈显著负相关(P<0.05);Cd 胁迫下玉米光合色素的含量均明显下降,与王玉萍等[13]、李继伟等[27]和王芳等[25]发现的Cd 可减少玉米光合色素含量的现象一致。试验中发现随Cd 胁迫程度的提高,Chl a/Chl b 表现出先升高后降低的趋势,说明在不同程度Cd 胁迫下,Cd 对Chl a 和Chl b 的影响有所不同,这些现象与张金彪等[28]在草莓(Fragaria ananassa)中发现的现象一致;Vaculík 等[24]通过水培试验对玉米进行Cd 胁迫(5 μmol·L-1),胁迫10 d 后发现Chl a/Chl b 显著低于对照组;而刘建新等[29]在裸燕麦(Avena nuda)中发现随Cd 处理浓度(0~50 mg·kg-1)的上升,Chl a/Chl b 显著提高。
玉米地上部分Cd 含量与RL、SA、RV、RT 呈显著负相关(P<0.05)。这一点与于子昊等[30]的结果相似。李希铭等[31]发现紫花苜蓿(Medicago sativa)细根Cd 含量高于粗根,且与地上部Cd 含量呈显著正相关,结果说明细根是植物吸收Cd 的主要器官。在本试验中,地上部Cd 浓度与RD 0~1.5 mm 径级区间的RL、SA 和RV 呈显著负相关(P<0.05)。根系吸收的Cd 通过共质体和原生质体途径到达木质部,经过长距离运输,运输到地上部分,对地上部分造成Cd 毒害,影响地上部分生物量的积累。根冠比的大小反映了植物地下与地上部分的相关性,还可反映环境胁迫对地下与地上部分的影响程度,根冠比增大有利于植物吸收水分和养分。本试验结果发现玉米根冠比随着Cd 浓度的升高而升高,说明玉米在受到胁迫时增加了光合产物向根系的分配,这种现象是植物生长应对土壤逆境的普遍策略。王玉萍等[13]和王芳等[25]的试验中玉米根冠比随Cd 胁迫的增加出现先升高后降低的现象,并均在50 mg·L-1Cd 胁迫时达到最大值,本试验结果部分与此不一致的原因可能与品种差异和生长环境差异有关。
3.2 Cd 胁迫下玉米根系形态响应
根系是植物吸收水分和矿质元素的重要营养器官。根系作为首先接触土壤有毒物质和最早感知土壤逆境胁迫的器官,其形态的变化可以直观反映根对外界环境的适应能力。植物还可通过改变根系结构从而提高获取水分和养分的能力,应对逆境胁迫。本试验结果显示,随着Cd 胁迫的加剧,玉米根系的RL、SA、RV、RT 和RF 均显著下降,且均与地下部Cd 浓度呈极显著负相关(P<0.01);RD 显著上升,与地下部Cd 浓度呈极显著正相关(P<0.01)。于子昊等[30]比较了12 个玉米品种根系与地下部Cd 含量的关系,发现地下部Cd 含量与根尖数和分枝数呈显著负相关(P<0.05)。Cd 进入到根细胞内,破坏细胞结构,阻碍根系细胞分裂和伸长,导致根系生长缓慢;Cd 还会干扰植物根系对营养元素的吸收,导致地上部生物量下降[32]。RD 0~0.5 mm、RD 0.5~1.0 mm 和RD 1.0~1.5 mm 径级区间的RL、SA 和RV 随着Cd 胁迫程度的升高显著降低,而RD>1.5 mm 径级区间的RL、SA和RV 不受Cd 胁迫程度的影响,结果说明玉米细根相对粗根受Cd 的影响较大,表明不同径级的根系在响应Cd 胁迫方面具有不同的形态可塑性和功能差异性。何俊瑜等[11]比较了不同浓度Cd 对两种水稻幼苗根系形态特征的影响,发现随外源Cd 胁迫浓度的升高,对两种水稻在0~0.5 mm、0.5~1.0 mm 和1.0~1.5 mm 径级区间内的根系长度、根系表面积和根系体积具有较大的抑制作用。肖亚涛等[33]发现Cd 低积累小麦(Triticum aestivum)品种洛优9909 和Cd 高积累小麦品种新麦9817 粗根和细根根系形态在响应Cd 胁迫时具有明显的品种和浓度差异性。Yu 等[34]比较了18 种草本植物根系形态的变化与Cd 积累的关系,发现根系形态存在明显的种间差异,其中较细和较长的根可能会导致植物具有较高的Cd 转运能力,而较粗的根系能保留更多的Cd,以减少Cd 从根系向地上部的转运,本试验结果与此存在一定的差异。Guo 等[35]探究了八宝景天(Hylotelephium spectabile)对2 和5 mg·L-1Cd 胁迫的响应,结果显示Cd 胁迫对根系特征和不同径级区间的根长和根表面积无显著抑制作用。本研究结果中Cd 对1.5 mm 以上径级区间的RL、SA 和RV 没有影响,可能是物种和培养方式不同导致的结果差异。总的来说,玉米根系在响应土壤环境变化时具有较强的可塑性,其构型的变化可作为直观反映土壤胁迫程度的指标,又因其与Cd 吸收密切相关,深入辨析根系响应Cd 胁迫机制对于培育农用Cd 低积累品种,和污染修复用Cd 高积累品种具有重要意义。
4 结论
随着Cd 胁迫程度的增加,地下部的Cd 浓度与含量均显著增加,玉米根系受到胁迫后构型发生改变,变得更短更粗,并显著减少了根的分枝数、根尖数和根表面积,其中较细的根系(RD 0~1.5 mm)受影响更大。相关性分析表明玉米幼苗的Cd 浓度不仅与根系指标中的总根长、根表面积、根体积、分枝数、根尖数、RD 0~0.5 mm、RD 0.5~1.0 mm、RD 1.0~1.5 mm 径级区间的根长、根表面积和根体积呈显著负相关,还与光合指标中的总叶绿素、类胡萝卜素和光合参数呈显著负相关,其中玉米幼苗的Cd 浓度与转运系数呈显著正相关,进一步说明Cd 从地下部向地上部的转运显著增加,地上部高浓度Cd 的积累使得玉米叶片的通气性变差,光合效率变低,光合色素含量下降,生物量积累受阻,从而使玉米生长受阻,耐受性变差。
