高寒草地小型土壤节肢动物群落特征及其对草地退化的指示作用
2022-03-26周磊魏雪王长庭吴鹏飞
周磊,魏雪,王长庭,吴鹏飞
(西南民族大学青藏高原研究院,四川 成都 610041)
自20 世纪初,国外有关研究人员提出通过诊断土壤有机质[1]和调查植被盖度、地上生物量等指标[2-3]来判定草地退化程度。国内也有学者根据放牧过程中草地植物和土壤的变化提出草地退化等级标准[4-5]。由于这一退化等级指标易于调查,在退化草地理论研究和实践应用上发挥着重要作用[6]。此后,国家标准《GB19377-2003:天然草地退化、沙化、盐泽化的分级指标》和地区标准《内蒙古天然草地退化标准》《DB51T 1978-2015:川西北高寒草甸草地放牧退化分级》等陆续制定,进一步完善了草地退化等级标准,不仅包含植物群落特征、组成结构和指示植物等必须监测指标,还包括地表特征和土壤理化性质等辅助监测指标。
目前,现有的草地退化等级标准仍然存在一些不足之处。首先,在草地退化等级判定中没有明确植物群落和土壤因子各指标的相对重要性[7]。其次,植物群落对环境变化的响应具有一定的滞后性[8-9],尤其是高寒草地(甸)上的优势植物主要为多年生草本,对环境变化响应的滞后性比一年生草本更加突出。再次,在草地生态系统中,由于植物群落受到食草动物的啃食、践踏等影响表现出一些退化特征,但土壤肥力可能尚未退化[10]。因此,植物群落的变化并不一定反映草地生态系统的客观真实状况。
另一方面,土壤理化性质各指标往往仅能反映自身变化,很少具有综合性,也不能反映生物状况,且对环境变化的响应有很大不确定性[11]。因此,土壤理化性质无法及时准确地反映草地退化的生物学状况。草地退化是一个复杂的过程,仅从植物群落和土壤理化性质的变化[12]来判定退化程度还不够完善,需要使用更具敏感性和可综合反映植物群落和土壤理化性质变化的新指标。
由于土壤动物群落对土壤理化性质[13-14]、植物群落[13]以及气候因子[15]的变化均具有敏感性,在高寒草地退化过程中,植物群落[16]及土壤养分[17]的变化,降低了土壤动物群落组成种类结构的复杂性[18]以及土壤昆虫群落的密度及多样性[19-20],且草地的中度退化能够增加大型土壤动物群落多样性[21],降低小型表栖节肢动物多样性[22]。此外,由于土壤小型节肢动物及线虫具有繁殖速度快、世代周期短[23]等特性,可对土壤及植物群落等环境变化做出快速响应,且其分布广泛、鉴定相对简单等,常被用作环境指示生物[24]。目前虽然对高寒草地退化与土壤动物群落多样性之间的关系开展了一些研究[25-27],但是关于土壤动物群落的哪些指标或哪些组成类群能够对高寒草地的退化起指示作用还不清楚。
本研究以川西北不同退化程度下高寒草地小型土壤节肢动物群落为对象,旨在查明高寒草地退化过程中小型土壤节肢动物群落的变化趋势,以及小型土壤动物群落与植物群落和土壤理化性质间的关系,筛选能够指示高寒草地退化状况的土壤动物群落指标或指示类群,完善现有的草地退化标准指标体系,为高寒草地的生态监测与保护提供技术支撑。
1 材料与方法
1.1 研究区概况
研究区位于川西北地区的阿坝州和甘孜州,地理坐标为102°08′-103°39′E,32°56′-34°19′N,平均海拔为3000~4000 m。其为青藏高原东南边缘部分,气候属大陆性高原气候,日温差大,霜冻期长,四季变化不明显。大部分地区年均温0~6 ℃,极端最低温为-38.9 ℃,10 ℃以上活动积温1000~1500 ℃,年降水量400~500 mm。植被类型主要为亚高山草甸和沼泽草甸植物,包括小嵩草(Kobresia pygmaea)、莎草(Cyperus rotundus)、鹅绒委陵菜(Potentilla ansrina)、草玉梅(Anemone rivularis)、垂穗披碱草(Elymus nutans)、葛缕子(Carum carvi)、草地早熟禾(Poa pratensis)。土壤类型主要为亚高山草甸土,成土母质以中生代三叠系的板岩、砂岩、白云岩、泥灰岩的坡积残积物和全新统第四系的冲积、洪积、堆积物为主。
1.2 研究方法
1.2.1 样地设置 对各样方内的植被类型、高度、盖度以及土壤性质等进行调查,根据《GB19377-2003:天然草地退化、沙化、盐泽化的分级指标》和《DB51T 1978-2015:川西北高寒草甸草地放牧退化分级》等标准,在阿坝州的若尔盖县、阿坝县和壤塘县及甘孜州的色达县、石渠县境内,选取未退化草地(non-degraded grassland,NDG)、轻度退化草地(lightly degraded grassland,LDG)、中度退化草地(moderately degraded grassland,MDG)和重度退化草地(severely degraded grassland,SDG)4 种类型高寒草地调查样点。其中,未退化草地6 个、轻度退化草地12 个、中度退化草地9 个、重度退化草地10 个,共选取37 个样点(图1)。各样点间隔在2 km 以上。在每个样点设置1 个100 m×100 m 大样方,并在大样方内按对角线法设置3 个1 m×1 m 的小样方,间隔为20 m。
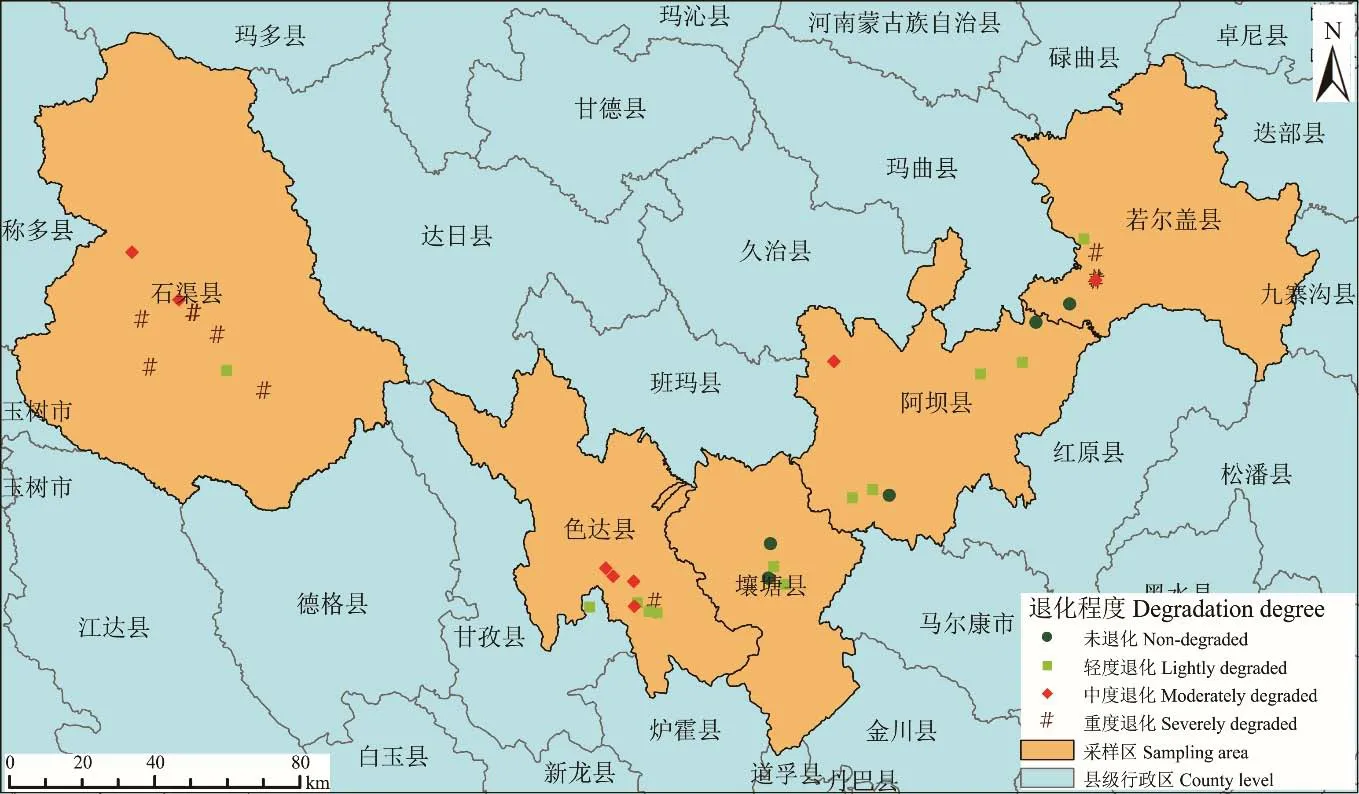
图1 川西北采样点分布Fig.1 Distribution of sampling points in Northwest Sichuan
1.2.2 野外样品采集 2019 年7 月和2020 年7 月,首先对每个1 m×1 m 的小样方内的植物群落组成、高度、盖度等进行调查。用刈割法采集样方内地上植物,带回实验室,置于75 ℃烘箱内烘干至恒重,计算地上生物量。
然后用直径3 cm 的土钻按5 点法采集0~20 cm 混合土样,置于有标记的自封袋内,共取得土壤样品(6+12+9+10)样点×3 小样方=111 份,用于分离小型土壤节肢动物。
用容积为200 cm3的环刀(70 mm×52 mm)测定土壤含水量和容重。此外,每个小样方内另取0~20 cm 的混合土样一份,用于土壤理化性质的测定。
1.2.3 室内鉴定与分析 实验室内用干漏斗法(tullgren 法)分离小型土壤节肢动物。温度控制在38 ℃左右,分离时间为48 h。根据《中国土壤动物检索图鉴》[28]、《昆虫分类检索》[29]、《农业螨类学》[30]等文献,在体式镜(Olympus SZX16,日本东京)和光学显微镜(Olympus BX53,日本东京)下对收集到的小型土壤节肢动物进行鉴定。一般鉴定到属,少数鉴定到科,并统计各类群的个体数量。
采用电位法测定土壤pH 值;采用水合热重铬酸钾氧化-容量法测定土壤有机碳(soil organic carbon,SOC)含量;采用硫酸钾-硫酸铜-硒粉消煮,定氮仪自动分析法测定土壤全氮(total nitrogen,TN)含量;采用硫酸-高氯酸消煮-钼锑抗比色法测定土壤全磷(total phosphorus,TP)含量;采用烘干称重法测定土壤水分(water content,WC)含量[31]。
1.3 数据分析与处理
多度划分:个体数占总数10%以上者为优势类群,1%~10%为常见类群,1%以下为稀有类群。
采用Shannon-Wiener 多样性指数(H′),Simpson 优势度指数(C)和丰富度指数来分析小型土壤节肢动物群落多样性。丰富度指数以小型节肢动物的类群数(S)表示。
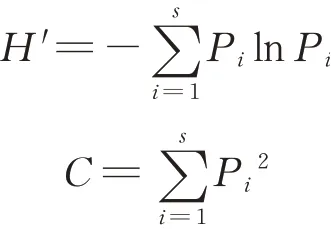
式中:Pi为第i类群的百分比。
对服从正态分布的数据,采用单因素方差分析(one-way ANOVA)对不同退化程度草地间的土壤动物群落多样性进行差异显著性分析。若差异显著则用Tukey HSD 法(方差齐性)和Tamhane’s T2(M)法(方差不齐)进行多重比较分析。对于不服从正态分布的数据进行lg(x+1)转换,如果仍不服从正态分布,则用Kruskal-Wallis Test(H)法进行非参数检验,多重比较方法为所有成对比较。
利用主成分分析法(principal component analysis,PCA)对不同退化阶段高寒草地间的小型土壤节肢动物群落进行排序,分析小型土壤节肢动物群落组成结构的差异性。把每个采样点的3 次取样求平均值,作为该退化阶段的1 个重复,分析过程中对其个体密度进行lg(x+1)转换。
先用降趋对应分析(detrended correspondence analysis,DCA)对样方及小型土壤节肢动物群落进行排序,由于第1、2 排序轴长度均大于4,因此选用典范对应分析(canonical correspondence analysis,CCA)对不同退化程度高寒草地小型土壤节肢动物群落与环境因子的关系进行排序。此外,采用相关分析检验植物群落、土壤环境与土壤动物群落及主要类群的关系。
采用IBM SPSS 20.0、Canoco for Windows 5.0 和R 3.5.3 软件进行数据分析。
2 结果与分析
2.1 不同退化程度草地植物群落特征与土壤理化性质
植物种类数、高度和地上生物量随退化加重呈下降趋势(表1),均为重度退化草地显著低于其他3 种草地(P<0.01)。未退化草地植物群落盖度显著高于其他3 种草地(P<0.01),轻度和中度退化草地群落盖度显著高于重度退化草地(P<0.01)。
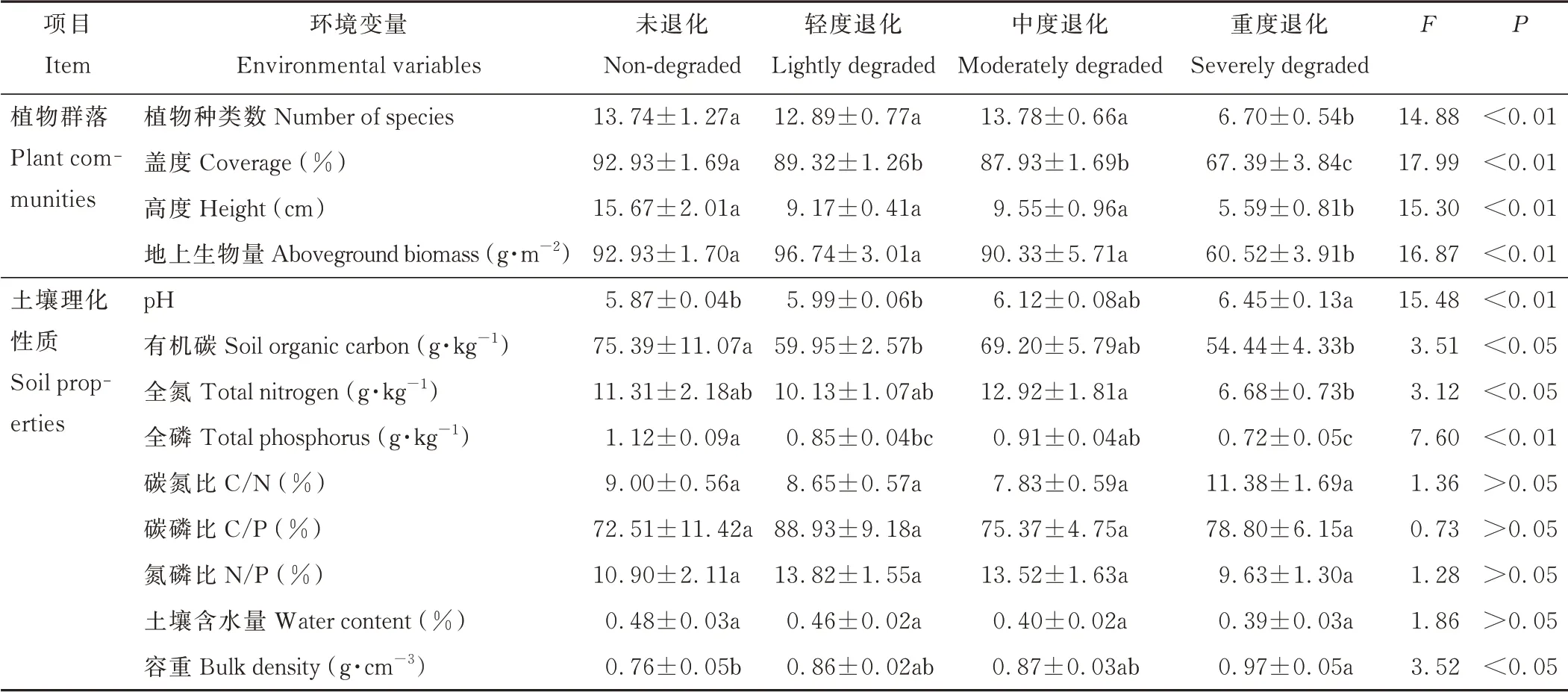
表1 不同退化程度高寒草地的基本情况Table 1 Characteristics of plant communities and soil properties in different degradation stages
土壤pH 和容重随退化加重逐渐升高,均为重度退化草地显著高于未退化和轻度退化草地(P<0.01 或0.05)。中度退化草地全氮含量最高,且显著高于重度退化草地(P<0.05)。未退化草地全磷含量显著高于轻度和重度退化草地(P<0.01)。
2.2 小型土壤节肢动物群落组成
本研究共采集小型土壤节肢动物3 纲17 目104 科165 类。在属层次上,符属(Folsomia)为优势类群,占总捕获量的10.62%;常见类群包含等节属(Isotoma)、奇属(Xenylla)、盖头甲螨属(Tectocepheus)、大翼甲螨属(Galumna)等20 类,占总捕获量的43.98%;稀有类群包含近缺属(Paranurophorus)、隐属(Cryptopygus)等106 类,占总捕获量的31.50%。在目层次上,优势类群有甲螨亚目(Oribatida)、长角目(Entomobryomorph)和原目(Poduromorpha),分别占总捕获量的31.59%、29.20%和14.60%。在纲层次上,跳虫(Collembola)和螨类(Mites)为优势类群,分别占总体的45.93%和45.22%。
2.3 小型土壤节肢动物群落组成结构差异
不同退化程度草地之间小型土壤节肢动物群落组成结构存在差异。在属层次上,轻度和中度退化草地的优势类群均为符属,分别占12.40%和15.51%;未退化和重度退化草地没有优势类群。在目层次上,未退化和轻度、中度、重度退化草地中,甲螨亚目分别占60.13%、28.94%、21.12% 和33.65%,原目分别占5.06%、16.80%、14.71%和17.54%,长角目分别占5.06%、29.46%、42.78%和22.75%。纲层次上,各退化程度草地的螨类分别占70.89%、46.51%、30.75%和49.29%,跳虫分别占10.13%、49.10%、59.09%、43.60%,昆虫纲(Insecta)依次占18.99%、4.39%、10.16%和7.11%。
小型土壤节肢动物群落排序分析结果表明,各退化草地间的小型土壤节肢动物群落组成结构差异不明显(图2)。此外,同一退化程度草地的不同采样点之间群落组成结构也存在较大的差异。在PC1 轴上影响群落结构的主要类群是符属和大翼甲螨属,PC2 轴上影响群落的主要类群是等节属和尖眼蕈蚊科(Sciaridae)。
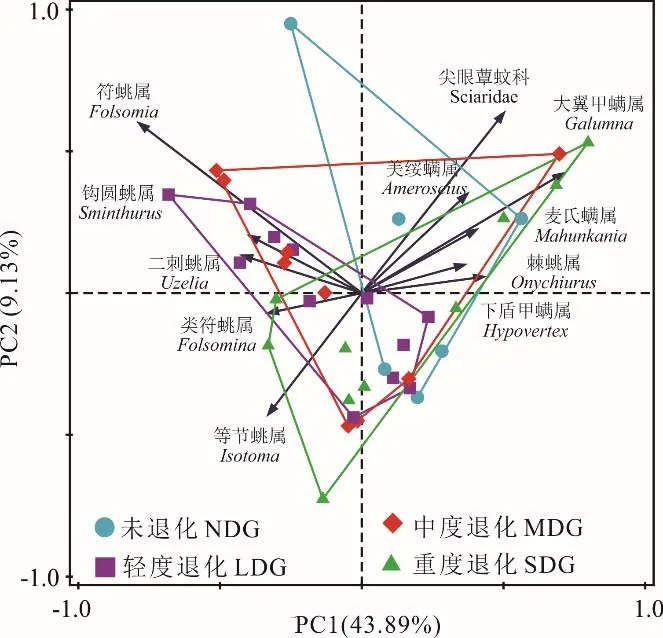
图2 不同退化程度草地间小型土壤动物群落结构差异Fig. 2 Community structure of soil microarthropod in different degraded grasslands
2.4 小型土壤节肢动物群落密度及多样性动态
未退化草地到重度退化草地,小型土壤节肢动物个体密度、类群数和Shannon-Wiener 指数均先上升后下降(图3)。4 种退化程度草地间的小型土壤节肢动物群落密度及多样性存在显著差异,且重度退化草地显著低于轻度和中度退化草地(P<0.01);而Simpson 优势度指数则先下降后上升,且重度退化草地显著高于轻度退化草地(P<0.01)。
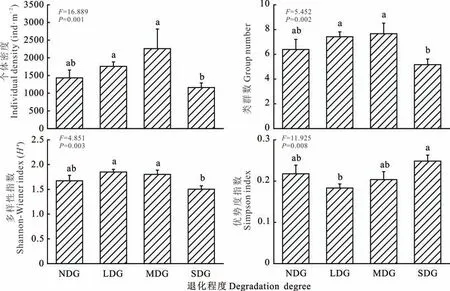
图3 不同退化程度草地间小型土壤节肢动物群落密度及多样性Fig.3 Density and diversity index of soil microarthropod communities in different degraded grasslands(mean±SE)
2.5 不同退化程度草地小型土壤节肢动物主要类群动态
在纲层次上,随退化程度的加重,跳虫个体密度及个体百分比均先上升后下降,轻度和中度退化草地的跳虫个体密度显著高于未退化草地(P<0.01),但仅轻度退化草地的个体百分比显著高于未退化草地(P<0.05)(图4)。螨类的个体密度随退化加重显著下降(P<0.05),个体百分比在各个退化程度之间无显著差异(P>0.05)。
在目层次上,甲螨亚目的个体密度及个体百分比随退化程度增加均呈下降趋势,其中未退化草地的个体密度显著高于重度退化(P<0.05),而个体百分比则显著高于其他3 个退化梯度(P<0.05)(图4)。长角目的个体密度呈先上升后下降的趋势,中度退化草地显著高于未退化草地(P<0.05),而个体百分比呈持续增加趋势(P>0.05);原目的个体密度和个体百分比在不同退化程度草地间均无显著差异(P>0.05)。
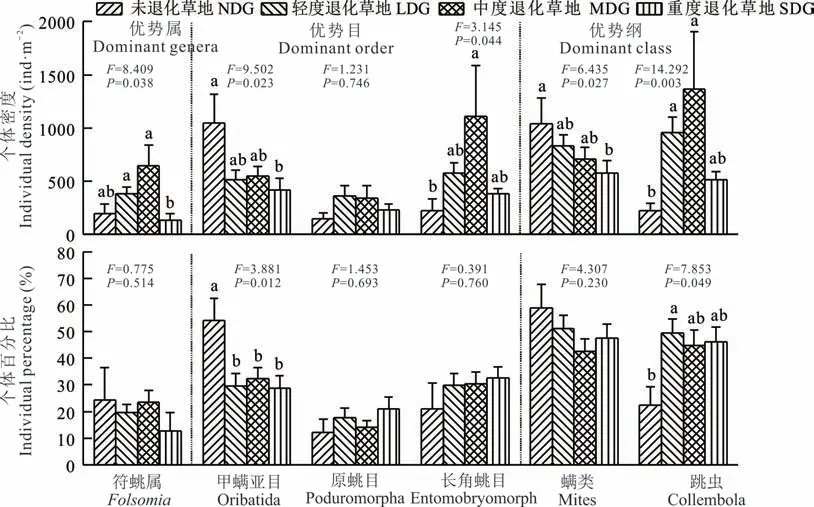
图4 优势类群的个体密度及百分比动态Fig.4 The dynamics in individual density and percentage of the dominant groups(mean±SE)
2.6 小型土壤节肢动物与环境因子的关系
典范对应分析(CCA)结果表明(图5),第1、2 排序轴对小型土壤节肢动物和环境因子关系的解释率分别为15.78%和13.22%;第1 排序轴(F=0.2,P=0.044)和所有排序轴(F=1.2,P=0.004)解释的信息量均具有显著性。第1 排序轴与土壤有机碳含量(SOC)显著正相关(P<0.05),且土壤有机碳含量对小型土壤节肢动物个体数分布的贡献率为16.7%;第2 排序轴与全磷(TP)含量显著正相关(P<0.05),且全磷含量对小型土壤节肢动物个体数分布的贡献率为12.6%。
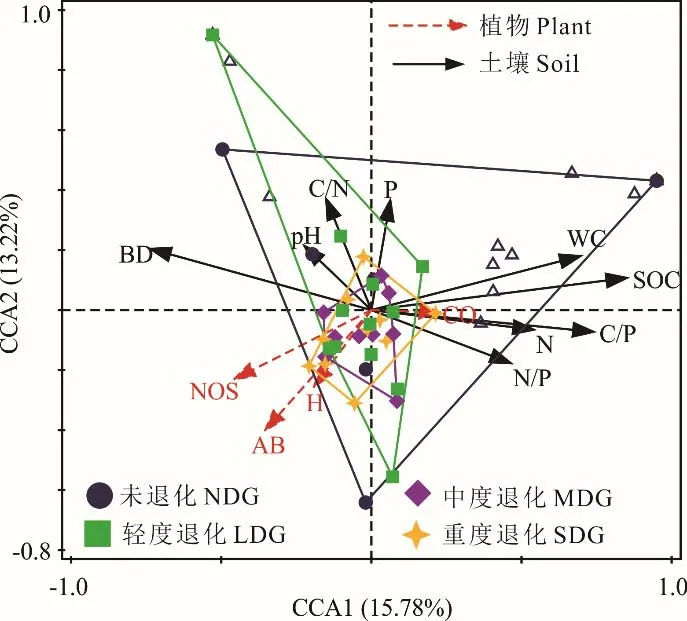
图5 小型土壤节肢动物群落与环境因子的典范对应分析Fig. 5 Canonical correspondence analysis on soil microarthropod communities and environment factors
小型土壤节肢动物群落各参数与环境因子的相关分析结果表明(图6),个体密度与土壤有机碳含量和植物群落高度显著正相关(P<0.05);类群数与土壤有机碳含量、土壤含水量和植物物种数显著正相关(P<0.001 或0.05);Shannon-Wiener 多样性指数与土壤有机碳含量、土壤全氮含量、土壤含水量、植被盖度和植物物种数显著正相关(P<0.001 或0.05),与土壤pH 和土壤碳氮比显著负相关(P<0.05);优势度指数与土壤pH和土壤碳氮比显著正相关(P<0.01 或0.05),与土壤有机碳含量、土壤含水量和植被盖度显著负相关(P<0.001 或0.01 或0.05)。从相关系数的大小及影响指标的多少来看,土壤有机碳和土壤含水量是影响小型土壤节肢动物的主要因子。
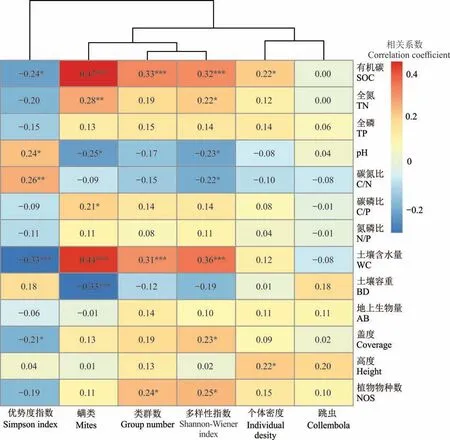
图6 小型土壤节肢动物与土壤环境因子间的相关性分析Fig.6 Correlation analysis on the relationships between soil microarthropods and soil environmental factors
3 讨论
3.1 川西北高寒草地小型土壤节肢动物群落特征
川西北高寒草地的小型土壤节肢动物群落的优势类群为甲螨亚目、原目和长角目,与宁夏荒漠草原小型土壤节肢动物群落组成差异较大[32],后者的优势类群为前气门亚目、半翅目幼虫;但其与松嫩草原[33]、新疆喀纳斯草原[34]、吉林羊草(Leymus chinensis)草原[35]的小型土壤节肢动物群落相似,这些地区小型土壤节肢动物群落均以甲螨亚目和跳虫类为优势类群。由此可知,川西北高寒草地小型土壤节肢动物群落的优势类群与我国北方草原有一定的相同之处。
此外,川西北高寒草地小型土壤节肢动物群落在多样性上也与其他地区不同。本研究共调查到小型土壤节肢动物3 纲17 目104 科。松嫩草原的小型土壤节肢动物有5 纲20 目30 科[33]、宁夏荒漠草原为3 纲8 目18 科[32]、内蒙古草原为3 纲11 目29 科[36]。由此可知,川西北高寒草地小型土壤节肢动物群落在多样性上与其他地区有较大差异,也体现了青藏高原地区土壤动物区系组成具有一定的独特性。
3.2 草地退化对小型土壤节肢动物群落组成和多样性的影响
随着川西北高寒草地的退化,小型土壤节肢动物群落组成结构发生变化,且重度退化草地的群落密度及多样性指数均显著低于轻度和中度退化草地。研究显示土壤动物群落与植物群落之间有密切联系[37],如植物群落能为土壤动物提供充足的食物来源和适宜的栖息环境[38]。因此,植物群落的差异能够影响土壤动物群落多样性[39-40]。本研究中重度退化草地的植物种类数、地上生物量、高度及盖度明显低于其他退化草地(表1),而植物群落高度、盖度和物种数与小型土壤节肢动物的密度及多样性等存在一定的正相关关系(图6)。其他研究还发现草地植物群落组成种类[26,41]的减少可以降低土壤动物的数量。
其他研究还表明小型土壤节肢动物群落的密度、多样性受到土壤理化性质的影响[42-43]。在川西北高寒草地退化过程中,土壤有机碳、全氮呈波动性下降(P<0.05)(表1)。而土壤有机碳和全氮与小型土壤节肢动物个体密度、类群数和Shannon-Wiener 多样性指数呈显著正相关(P<0.001 或0.05)。因此土壤有机碳和全氮含量的下降可能导致小型土壤节肢动物群落个体密度和多样性的降低。其原因可能是土壤有机碳含量的增加会提高高寒草地植物多样性,而植物多样性的增加可以为土壤动物提供丰富多样的食物资源,进而增加小型土壤节肢动物的个体密度及多样性[44-45]。其他研究也发现土壤养分减少可导致土壤动物群落密度降低[13]。此外,pH 与土壤动物群落Shannon-Wiener 多样性指数呈显著负相关,与优势度指数呈显著正相关。在森林生态系统中的研究也发现了土壤动物群落与pH 存在相同的关系[46]。其原因可能是大多数土壤动物更适宜在中性和微酸条件下生存[47]。
土壤湿度是影响土壤动物分布的重要因素之一[48]。本研究也发现土壤含水量是影响小型土壤节肢动物群落的重要因素之一(图6)。在川西北高寒草地中,土壤含水量随退化程度加重而显著降低(表1),且与土壤动物群落类群数和Shannon-Wiener 多样性指数以及螨类个体数呈显著正相关(图6),表明在高寒草地退化过程中土壤水分下降对小型土壤节肢动物群落多样性及优势类群起限制作用。此外,本研究还发现小型土壤节肢动物的密度及多样性主要受土壤理化性质的影响,受植物群落变化影响相对较弱。因此,高寒草地退化过程中土壤理化性质的变化是导致小型土壤节肢动物群落密度及多样性降低的主要原因。
3.3 草地退化对小型土壤节肢动物主要类群的影响
3.4 土壤动物群落特征对草地退化的指示作用
由于土壤动物种类繁多,取食行为及生活史策略多种多样,常被用作反映土壤养分和环境扰动的指示生物[57]。本研究发现,螨类密度、植物群落特征和土壤理化性质均随高寒草地退化加重呈下降趋势(表1),且螨类密度与土壤有机碳含量、含水量和容重等多个因子显著相关(图6),表明螨类数量与土壤环境密切相关,能够在一定程度上反映土壤环境的变化。而土壤有机碳含量、含水量和容重等受植物群落物种多样性、植被盖度和地上生物量的影响[58]。其他研究发现螨类还受到植物群落的高度、盖度和群落组成[59]等影响。因此,土壤螨类数量的变化能够直接及间接地反映高寒草地土壤和植物群落等多个环境因子的变化,具有一定的综合性。此外,研究还发现多种土壤动物类群对环境扰动的响应早于土壤理化性质和植物群落[60-61],具有一定的预警作用。
螨类密度在各退化阶段的范围(图4)分别为:未退化草地833.33~1037.04 ind·m-2及以上、轻度退化草地709.88~833.33 ind·m-2、中度退化草地577.78~709.88 ind·m-2和重度退化草地577.78 ind·m-2以下。所以螨类密度随着高寒草地退化加重呈持续下降。且螨类是土壤中数量最丰富的小型节肢动物类群[62]。有研究发现螨类的种类和数量随化肥的施用而减少[63],在草地退化恢复过程中土壤螨类个体密度显著提高[64],这也表明螨类对草地环境的变化具有敏感性。相对于现有的草地退化标准而言,利用土壤动物作为草地退化指示生物具有综合性、及时性、易操作性等多项优点。因此,可以通过监测螨类数量变化动态来反映高寒草地生态系统的退化状况,以及利用螨类个体数量评估不同区域高寒草地的退化程度,丰富现有草地退化的评价方法。
4 结论
川西北高寒草地小型土壤节肢动物群落组成结构和多样性具有独特性,退化对小型土壤节肢动物群落的密度、丰富度、Shannon-Wiener 多样性和Simpson 指数均有显著影响。不同退化阶段间小型土壤节肢动物群落结构和优势类群存在差异。高寒草地退化使螨类的个体密度逐步降低,而中度退化可增加跳虫的个体密度。土壤理化性质的变化是导致小型土壤节肢动物群落密度及多样性降低的主要原因,植物群落的影响较弱。土壤动物群落特征变化可作为一种草地退化分级指标,来评价草地状况。
