菲并咪唑-荧光素衍生物比色pH荧光探针的构建及其响应机制
2022-03-25王贵莹阚伟赵冰丁爽姜晓彤杜佳慧王丽艳
王贵莹,阚伟,2*,赵冰,2,丁爽,姜晓彤,杜佳慧,王丽艳,2
(1.齐齐哈尔大学化学与化学工程学院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔大学黑龙江省表面活性剂与工业助剂重点实验室,黑龙江 齐齐哈尔 161006)
pH值在生物体内扮演重要的角色,稳态pH对于生命体维持正常的生命活动具有重要意义。细胞功能障碍、恶性肿瘤、心肺疾病、阿尔茨海默病等多种恶性疾病与生命体pH值的变化具有密切的联系[1-4]。监测生命体的pH值变化对于人体生命健康以及医学研究具有重要意义。传统的pH检测采用玻璃电极法[5]、弱酸弱碱分布法[6]、核磁共振法[7]和原子吸收法[8]等,这些方法大多存在灵敏度低、选择性差、操作复杂和成本高等缺点。近年来,荧光光谱法因其高灵敏度和低成本等优点,在pH值检测过程中被人们广泛关注[9-11],同时设计合成了大量的具有不同结构特征的pH荧光探针[12-15],其中部分荧光探针在细胞凋亡监控[16]、荧光-光声成像[17]、生物成像[18]、废水监测等方面成功应用。然而,目前文献报道的pH荧光探针存在探针的水溶性差、pH值响应的范围窄和响应时间长等缺点,在一定程度上限制了探针的广泛应用。因此,设计和开发水溶性好、宽分布响应和响应灵敏的pH探针对研究者们仍然是一个挑战。


图1 探针PIF-1和PIF-2的合成
1 实 验
1.1 试剂与仪器
9,10-菲醌、对硝基苯甲醛、荧光素和雷尼镍,AR,上海阿拉丁试剂有限公司;乙酸铵、苯胺、水合肼 (N2H4·H2O,纯度50%),AR,伊诺凯化学试剂公司;4-羟乙基哌嗪乙磺酸、冰乙酸、乙酸乙酯、石油醚、N,N-二甲基甲酰胺,AR,天津市富宇精细化工有限公司;其他溶剂和无机盐均为市售分析纯试剂,使用前未处理。
Spectrum GX型傅里叶变换红外光谱仪,美国珀金埃尔默公司;UV-Vis TU-1901型双光束紫外-可见分光光度计,北京普析通用仪器公司;AVANCE-600核磁共振波谱仪,德国Bruker公司;LS-55型荧光分光光度计,美国Perkin Elmer公司;M-60熔点仪,瑞士BUCHI公司;FlashSmart CHNS/O元素分析仪,德国ThermoFisher公司。
1.2 合成及表征
1.2.1 中间体的合成
4-[(1-苯基-1H-菲并[9,10-d]咪唑)-2-基]苯胺(1)、4-[(1H-菲并[9,10-d]咪唑)-2-基]苯胺(2)和荧光素单醛(3)按照文献[19-20]方法合成。
1.2.2 探针的PIF-1和PIF-2合成
将0.77 g(2.0 mmol)化合物1、0.72 g(2.0 mmol)荧光素单醛(3)和20 mL冰醋酸依次加入三口瓶中,室温搅拌。反应过程中采用TLC(V(石油醚)∶V(乙酸乙酯)=6∶4) 跟踪反应进程,6 h后反应结束。将混合物倒入100 mL质量分数为10%的氢氧化钠水溶液中,充分搅拌,有暗黄色固体析出,抽滤,滤饼经水洗后干燥。用乙酸乙酯重结晶得到黄色固体PIF-1,产率:95%, 熔点:184~188 ℃。IR(KBr),σ/ cm-1: 3 434, 3 062, 1 760,1 636, 1 605, 1 554, 13 59, 1 202;1H NMR(600 MHz, DMSO-d6),δ:14.70(s, 1H), 10.20(s, 1H), 9.53(s, 1H), 8.93(d,J=7.50 Hz, 1H), 8.88(d,J=78.20 Hz, 1H), 8.72(d,J=77.50 Hz, 1H), 8.01(d,J=78.50 Hz, 1H), 7.81~7.67(m, 12H), 7.58~7.54(m, 3H), 7.34(t,J=77.80 Hz, 1H), 7.30(d,J=77.20 Hz, 1H), 7.08(d,J=77.20 Hz,1H), 6.98(s, 1H), 6.76(s, 1H), 6.69(s, 1H), 6.63~6.57(m, 2H);13C NMR(150 MHz, DMSO-d6),δ:169.1, 164.1, 160.0, 158.6, 152.6, 151.7, 151.4, 150.3, 147.3, 138.7, 137.1, 136.3, 133.8, 131.0, 130.9, 130.7, 130.6, 130.2, 129.6, 129.6, 129.4, 129.1, 128.5, 128.2, 128.0, 127.1, 127.1, 126.5, 126.4, 126.3, 125.7, 125.2, 125.0, 124.5, 124.1, 122.9, 122.5, 122.4, 122.0, 120.7, 114.2, 113.7, 109.8, 109.0, 107.1, 103.4;元素分析(C48H29N3O5计算值),%: C 79.36(79.22), H 4.08(4.02), N 5.61(5.77)。
探针PIF-2采用化合物2和荧光素单醛(3)合成,方法与探针PIF-1的合成方法相似,得到深红色固体为PIF-2。产率:90%;熔点:301~303 ℃;IR(KBr),σ/ cm-1: 3 426, 3 072, 1 740, 1 637, 1 599, 1 547, 1 314, 1 210;1H NMR(600 MHz DMSO-d6),δ:14.87(s, 1H), 13.55(s, 1H), 10.22(s, 1H), 9.67(s, 1H), 8.89(d,J=7.50 Hz, 1H), 8.86(d,J=8.00 Hz, 1H), 8.63(d,J=8.50 Hz, 1H), 8.58(d,J=7.50 Hz, 1H), 8.47(d,J=7.20 Hz, 2H), 8.03(d,J=7.50 Hz, 1H), 7.85~7.83(m, 2H), 7.82~7.73(m, 4H), 7.68~7.64(m, 2H), 7.33(d,J=8.50 Hz, 1H), 7.03(s, 1H), 6.81(d,J=7.00 Hz, 1H), 6.74(d,J=8.50 Hz, 1H), 6.65~6.61 (m, 2H);13C NMR(150 MHz, DMSO-d6),δ:169.1, 164.5, 160.0, 158.2, 152.7, 151.7, 151.4, 148.9, 147.5, 137.6, 136.2, 133.8, 130.7, 129.8, 129.4, 128.3, 128.3, 128.1, 127.9, 126.5, 125.9, 124.2, 122.4, 114.3, 109.8, 107.3, 103.4, 82.9;元素分析(C42H25N3O5计算值),%:C 77.35(77.41), H 3.91(3.96), N 6.53(6.45)。
1.3 光谱性能测试
1.3.1 储备液的配制
分别将探针PIF-1和PIF-2采用DMF配置成浓度为1.0×10-4mol/L的储备液备用。阳离子金属采用4-羟乙基哌嗪乙磺酸(HEPES)配置成浓度5.0×10-2mol/L的缓冲溶液备用。探针PIF-1和PIF-2的测试浓度为1.0×10-5mol/L,采用HEPES缓冲稀释。不同pH值的探针溶液用10%的NaOH溶液和5%HCl溶液调节。
1.3.2 测试方法
室温条件下测试紫外-可见吸收光谱和荧光发射光谱,石英比色皿为1 cm×1 cm×4 cm,探针PIF-1和PIF-2的激发波长均为325 nm,激发和发射狭缝宽度都为10.0 nm。
1.3.3 核磁滴定
采用DMSO-d6将探针PIF-1和PIF-2配成浓度为1.0×10-3mol/L的测试液,用微量浓HCl和NaOH固体调节溶液的pH值,充分摇匀后测试核磁共振氢谱。
1.3.4 水样分析
将过滤漂浮物和沉淀等杂质的自来水、齐齐哈尔劳动湖水和嫩江水 (齐齐哈尔段) 作为待测水样,采用HEPES溶液(pH=7.4) 稀释100倍后加入荧光探针PIF-1和PIF-2(1.0×10-5mol/L),测定样品水样的pH值。
2 结果与讨论
2.1 探针随pH值变化的比色特征
探针PIF-1和PIF-2水溶液随pH值变化的裸眼颜色变化如图2所示。从图2看出,随着环境pH值的增加,探针PIF-1和PIF-2溶液颜色由浅黄色逐渐变为亮黄色。这表明,探针溶液随着环境pH值变化表现出裸眼颜色变化。即,探针PIF-1和PIF-2可以通过裸眼颜色变化响应pH,作为pH比色探针应用于pH值检测。

图2 PIF-1和PIF-2探针在日光下随pH值变化的颜色
2.2 探针随pH值变化的紫外-可见吸收光谱特征
在V(DMF)∶V(HEPES)=1∶9体系中,调节探针PIF-1和PIF-2溶液的pH值,其紫外-可见吸收光谱的变化情况见图3所示。
从图3看出,强酸性条件下,探针PIF-1溶液在450 nm左右表现为弱吸收。随着溶液pH值的升高,450 nm处的吸收峰逐渐红移,并在478 nm处出现新的吸收峰。当溶液环境达到中性状态时 (pH=6.6),吸收峰红移至488 nm,吸收波长覆盖整个吸收带。当溶液pH值达到12.0时,吸收强度达到最大。探针PIF-1溶液紫外-可见吸收光谱随pH值变化的现象,与探针PIF-1溶液所呈现的裸眼颜色变化的结果一致。随着溶液pH值的变化,探针PIF-1溶液表现为不同的存在形式。在酸性条件下,探针PIF-1保持分子状态,表现单吸收峰;随着环境碱性的增强,探针酚羟基逐渐变为苯酚负离子,此时溶液中存在分子及苯酚负离子两种形式,吸收波长红移较小;随着溶液中OH-浓度的增加,探针上的酚羟基完全被中和,分子状态全部转化为苯酚负离子状态,探针PIF-1的吸收峰完全红移到488 nm。

图3 PIF-1和PIF-2探针在DMF-HEPES体系中的紫外-可见吸收光谱
探针PIF-2的紫外-可见吸收光谱进一步验证了探针溶液随pH变化的3种状态:酸性条件下,分子状态的探针PIF-2在448 nm有一个吸收峰;随着溶液碱性的增加,探针PIF-2逐渐出现长波吸收(480 nm);pH值继续增加,探针PIF-2的吸收峰红移至490 nm,此时探针分子、苯酚负离子和氮负离子3种状态同时存在时,表现为3个吸收带,波长分别为448、480和490 nm。强碱环境下,探针在490 nm处表现为单吸收。
以上结果表明,探针PIF-1和PIF-2随pH值变化具有明显的紫外-可见吸收光谱响应特征。
2.3 探针随pH值变化的荧光光谱特征
图4是探针PIF-1的荧光发射光谱(λex=325 nm)。

图4 探针PIF-1和PIF-2随pH值变化的荧光光谱
由图4可见,酸性条件下(pH=3.10),探针PIF-1在518 nm处发射低荧光,荧光强度随pH值增加明显增强,当pH值达到4.80时荧光强度较pH值为3.10时增加了20倍。这可能逐渐生成的苯酚负离子加强了相邻分子的相互作用,分子旋转受限,荧光强度增加。pH在5.80~9.30范围内,随着pH值增加,探针PIF-1的发射强度逐渐增加,且发射波长逐渐红移,pH值达到9.30左右时,发射波长红移至530 nm,荧光强度达到最大与pH值3.10时相比增强80倍。
由图4还可见,pH值较低时,探针PIF-2几乎不发射荧光。随着pH值的增加,探针PIF-2在516 nm处的荧光缓慢增强。pH值超过6.50时,发射波长逐渐红移至530 nm,且荧光强度随pH值增加而增强,强度最大值为pH值2.0时的50。上述结果说明了探针PIF-1和PIF-2随pH值变化的荧光响应能力。
在pH=2.0和pH =9.5的条件下,分别向探针PIF-1和PIF-2溶液中加入常见的金属离子,考察干扰离子存在下两个探针对pH值响应的影响,结果如图5所示。酸性条件及金属离子存在下,两个探针均处于低荧光强度状态;而在碱性条件下,两个探针的高荧光强度并未受到其他金属离子的影响。说明常见的金属离子对两个探针响应pH值没有干扰,同时表明两个探针具有在复杂环境中监测pH值的能力。
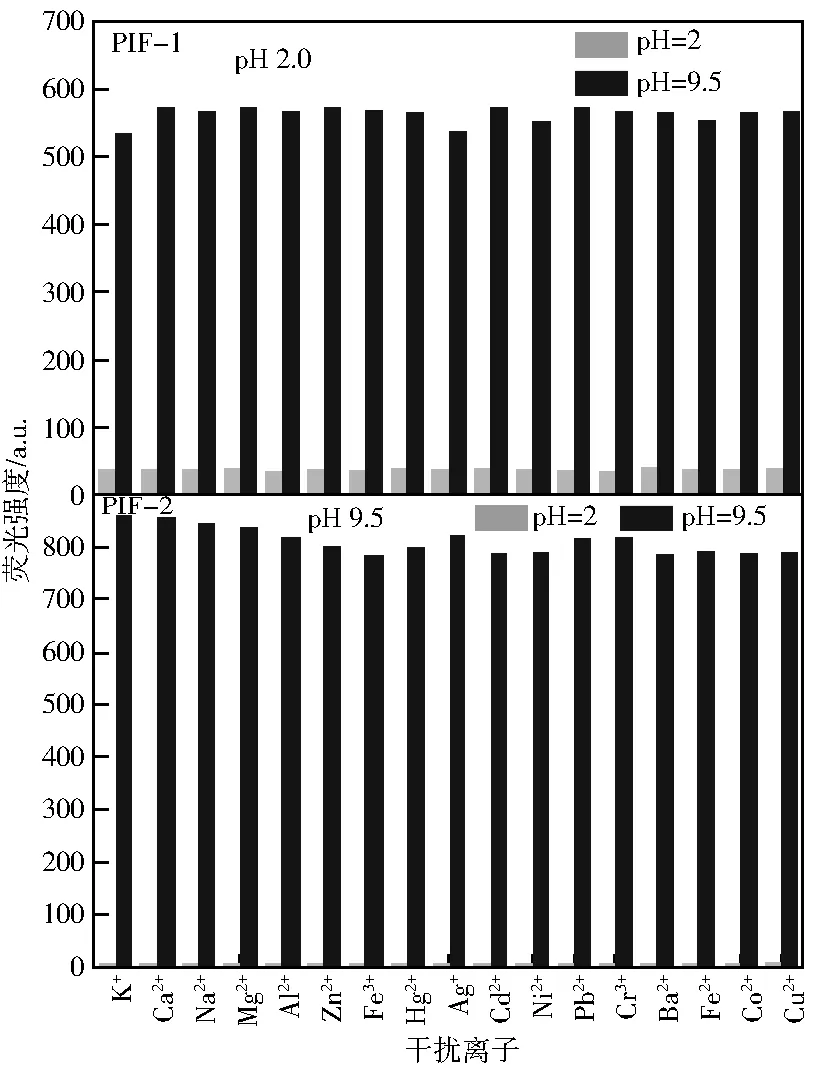
图5 干扰离子存在下探针PIF-1和PIF-2的荧光强度
探针PIF-1和PIF-2最大荧光强度与pH值的拟合曲线如图6所示。pH值在6.50~8.00范围内,探针PIF-1最大荧光强度(Imax)随pH值变化满足良好的线性关系,符合线性方程Y=133.032 6X-654.914 9,偏差R2为0.985 0。在pH值为5.40~7.30范围内,探针PIF-2的最大荧光(Imax)与pH值符合线性关系,线性方程为Y=345.525 6X-1 720.747 1,偏差R2为0.987 2。基于上述线性关系,根据公示pKa=pH±lg[(I-Imin)/(Imax-I)]计算得到探针PIF-1和PIF-2的pKa分别为7.00和6.30。上述结果说明,探针PIF-1和PIF-2可以对环境水样中的pH值进行定量检测。
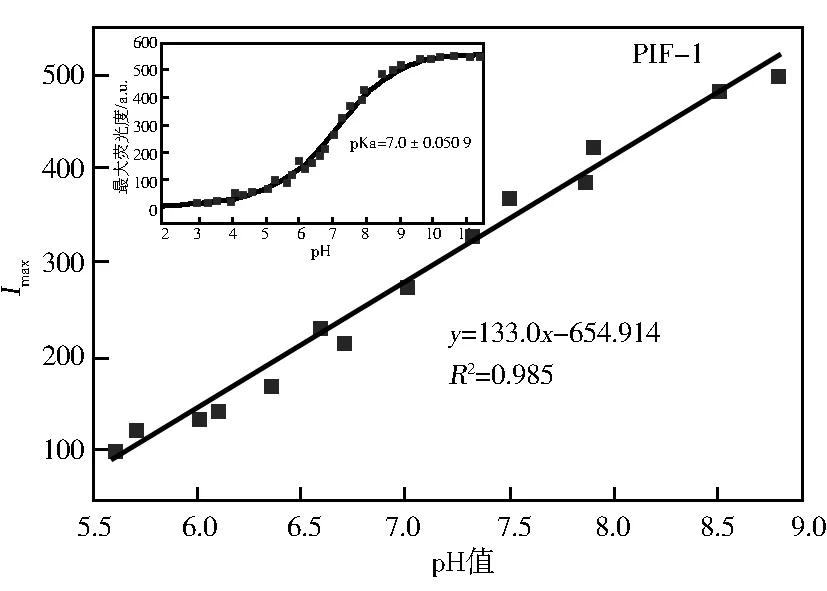
图6 探针PIF-1和PIF-2最大荧光强度与pH值的拟合曲线
图7是探针PIF-1和PIF-2在特定pH值条件下的荧光稳定性。如图7所示:探针PIF-1无论在中性还是碱性条件下均能在1 min之内达到相应的荧光强度,并在测试时间内(60 min)保持稳定。中性和弱碱性条件下,探针PIF-2在20 min时才能达到稳定的荧光强度,在测试时间内(60 min)保持稳定的荧光强度,响应速度明显低于探针PIF-1。这可能是由于探针PIF-2结构中咪唑环氮原子上氢质子的酸性较弱,对碱性条件响应较慢,导致荧光强度变化较慢。上述结果说明,探针PIF-1能够快速响应pH值,且探针PIF-1和PIF-2在各自的pH值响应范围内具有良好的荧光稳定性。
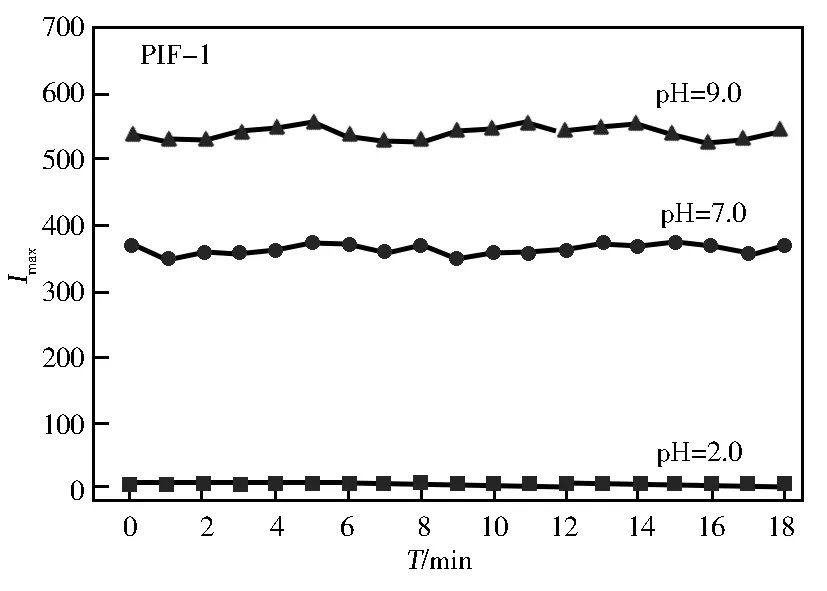
图7 探针PIF-1和PIF-2在特定pH值条件下的荧光强度
2.4 响应机理
采用核磁滴定验证了探针对pH值的响应机制。以DMSO-d6为溶剂,分别采用浓HCl溶液和微量固体NaOH调节中性条件下探针PIF-1和PIF-2溶液pH值,观察其核磁氢谱的变化,结果如图8所示。

图8 探针PIF-1和PIF-2的1H NMR谱
中性条件下,探针PIF-1在低场出现3个单峰,化学位移分别为14.70(H1)、10.20(H2)和9.53(H3),分别归属为两个羟基的氢质子(H1和H2)和亚胺键(H—C—N)上的氢质子(H3)。两个羟基氢质子的化学位移相差较大,可能是由于H1与亚胺氮原子形成分子内氢键的缘故。酸性条件下,3个单峰的化学位移几乎没有发生任何变化。而弱碱性条件下,H1和H2的质子峰完全消失。类似地,中性条件下,探针PIF-2在低场表现出4个单峰,化学位移值分别归属为14.87(H1)、13.55(H2)、10.22(H3) 和9.67(H4),H1归属为咪唑环氮原子上的H质子,H2和H3分别归属为两个羟基的氢质子,H4归属为亚胺键(H—C—N)上的氢质子。同样,酸性条件下的质子峰的化学位移几乎没有变化。而在弱碱性条件下,咪唑氢和羟基氢完全消失。上述结果说明,弱碱性条件下探针PIF-1和PIF-2上咪唑和羟基的活泼氢被氢氧根中和,相应的质子峰消失。
在此基础上,结合探针PIF-1和PIF-2随pH变化的光谱特征,建立了探针随pH值变化荧光响应机制(图9)。酸性条件下,荧光素上的羟基和亚胺氮原子形成分子内氢键,激发态下表现为烯醇式和酮式之间的激发态质子转移(ESIPT)特征,荧光光谱表现为双发射,强度表现为低荧光;随着碱性的增加,羟基氢质子逐渐被中和,形成苯酚负离子,苯酚负离子的存在使探针的紫外吸收波长发生红移,裸眼颜色发生变化;羟基氢质子和氮氢质子完全被中和后,探针变成双苯酚负离子和氮负离子状态,紫外吸收波长彻底红移至长波长。在此过程中,ESIPT作用逐渐被破坏,荧光双发射逐渐向单发射过渡,并伴随荧光强度的逐渐增加。此外,苯酚负离子和氮负离子形成后,促进了分子内电荷转移(ICT),对探针的荧光增强起到了一定的辅助作用。
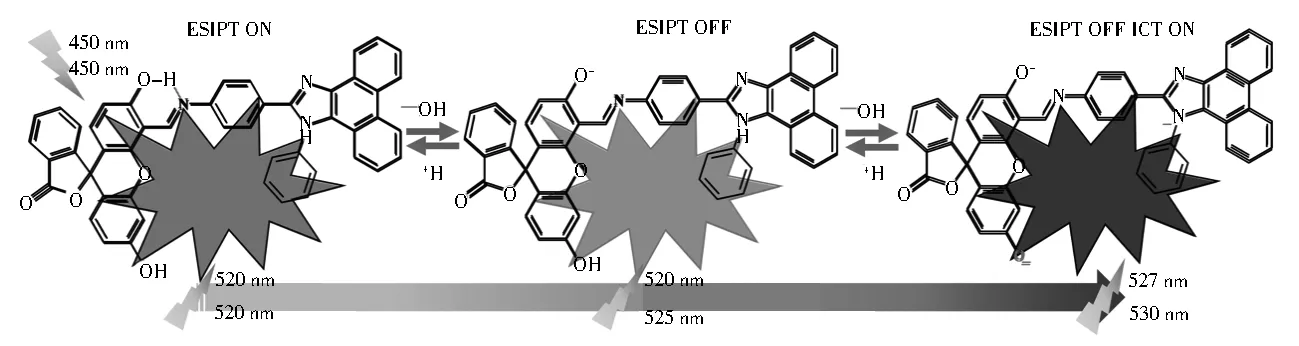
图9 探针PIF的响应机制
3 结 论
基于ESIPT特征设计并合成了含活泼氢位点的菲并咪唑-荧光素pH荧光探针PIF-1和PIF-2。随pH值的增加,探针溶液颜色由浅黄色变为亮黄色,具有显著的比色特征。荧光强度随pH值增加显著增强,并在一定pH值范围内具有良好的线性关系,说明探针PIF-1和PIF-2可实现对环境pH值的定性和定量检测。此外,两个探针均具有较好的荧光稳定性,且探针PIF-1的荧光响应速度明显优于探针PIF-2。核磁滴定结果证明了探针随pH变化发生的脱质子化过程。
