肠内及肠外营养支持在重症急性胰腺炎合并肠源性感染患者中的效果分析
2022-03-25田伟华
田伟华
急性重症胰腺炎是十分危险的急腹症,其发病急、并发症多、进展快、病死率高。发病时机体处于高代谢、高分解状态,若营养支持不及时,易造成免疫功能下降[1]。营养支持虽然不能改变患者自然病程,但能改善负氮平衡、纠正其营养状态,使患者顺利度过并发症期[2]。目前,临床常见营养支持方式包括肠内与肠外营养支持2种,均能改善患者营养状况,但关于2种营养支持方法在重症急性胰腺炎合并肠源性感染中的优劣仍缺乏循证依据。为此,本资料选取我院重症急性胰腺炎合并肠源性感染患者114例,旨在探讨肠内、肠外营养支持对疾病的改善情况。现报告如下。
1 资料与方法
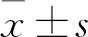
1.1 一般资料 选取我院2018年12月—2020年12月重症急性胰腺炎合并肠源性感染患者114例,按随机数字表法分为肠内组(57例)。肠外组(57例);肠内组男31例,女26例;年龄22~57(41.53±6.51)岁;致病原因:高血脂症19例,暴饮暴食12例,酗酒15例,胆源性11例。肠外组男29例,女28例;年龄24~59(39.51±6.89)岁;致病原因:高血脂症15例,暴饮暴食17例,酗酒12例,胆源性13例。2组基线资料(性别、致病原因、年龄)比较差异无统计学意义(P>0.05)。本研究经我院伦理委员会审批通过。
1.2 纳入及排除标准 (1)纳入标准:符合《中国急性胰腺炎诊治指南》[3]中重症急性胰腺炎合并肠源性感染诊断标准;患者知晓本研究并签署知情同意书。(2)排除标准:伴有严重遗传性疾病者;伴有免疫系统疾病者;妊娠期、哺乳期妇女;伴有严重肝肾功能疾病者;合并有机械性肠梗阻者;伴有严重糖尿病、高血压者;伴有严重心肝肾功能不全者;语言表达不清者;中间退出本研究者。
1.3 方法 2组均给予胃肠减压、静脉营养、纠正水电解质紊乱、抑制胰腺分泌、抗感染等常规治疗。肠内组:在入院后48~96 h放置鼻空肠管,在胃镜辅助下,将鼻空肠管经胃、幽门插入屈氏韧带以下15~20 cm,使用X线确认营养管位置,确认后给予肠内营养;营养液注入前,先滴注生理盐水250 mL,促进肠道蠕动,然后注入短肽类肠内营养剂(百普力,国药准字:H20010285),使用输液泵连续泵入,每袋配置500 mL溶液待用,置管后第1天使用剂量为500 mL,经3~5 d增加至1 500 mL/d,滴速以25~30 mL/h,之后逐渐增加至50~70 mL/h,匀速泵入,维持1~2周,待患者饮食恢复正常后逐步减量。肠外组:由外周中心静脉输注给予肠外营养,营养液由脂肪乳(20%)、葡萄糖(5%)、维生素、氨基酸、微量元素等组成,适当补充胰岛素;控制1 d热量补给在25~30 kJ/kg,持续治疗7~9 d。
1.4 观察指标 (1)肠功能恢复时间:观察2组治疗期间首次通气时间、1天的排便次数、首次排便时间、肠鸣音恢复时间、肠鸣音恢复个数,并做详细记录;(2)病情相关指标:采集治疗前后2组空腹静脉血5 mL,3 000 r/min离心20 min,分离血清后于-20 ℃环境中保存,采用速率比浊法检测CRP、WBC、TNF-α;采用鲎试剂凝胶法检测内毒素;(3)血清免疫球蛋白:采集治疗前后2组空腹静脉血5 mL,3 000 r/min离心20 min,分离血清后于-20 ℃环境中保存,采用免疫比浊法检测IgA、IgG、IgM水平;(4)肝功能、胰腺功能相关指标:分别检测2组治疗前后ALB、AST、ALT、AMS。
2 结果
2.1 2组患者肠功能恢复情况比较 肠内组首次通气时间、排便次数、首次排便时间、肠鸣音个数、肠鸣音恢复时间改善水平优于肠外组,差异有统计学意义(P<0.05)。见表1。
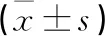
表1 2组患者肠功能恢复情况比较
2.2 治疗前后2组患者病情相关指标比较 治疗前2组CRP、WBC、内毒素、TNF-α比较,差异无统计学意义(P>0.05);治疗后2组CRP、WBC、内毒素、TNF-α均降低,且肠内组低于肠外组(P<0.05)。见表2。
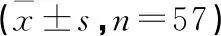
表2 治疗前后2组患者病情相关指标比较
2.3 治疗前后2组患者血清免疫指标比较 治疗前2组IgG、IgA、IgM比较,差异无统计学意义(P>0.05);治疗后肠内组IgG、IgA、IgM高于肠外组(P<0.05)。见表3。
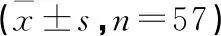
表3 治疗前后2组患者血清免疫指标比较
2.4 治疗前后2组患者肝功能、胰腺功能比较 治疗前2组ALB、AST、ALT、AMS比较,差异无统计学意义(P>0.05);治疗后2组ALB升高,AST、ALT、AMS均降低,且肠内组改善水平优于肠外组(P<0.05)。见表4。
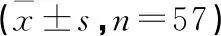
表4 治疗前后2组患者肝功能、胰腺功能比较
3 讨论
重症急性胰腺炎是急性全身性疾病,肠源性感染是由于急性重症胰腺炎引起的机体肠道黏膜损伤,致使肠道内毒素、细菌进入血液,诱发腹腔感染[4]。由于患者长时间禁食,影响机体营养摄入,若不及时给予合理的营养支持,会迅速诱发机体营养不良,加重病情。因此应积极给予患者营养支持治疗[5]。
肠道营养支持是临床常用方法,分为肠内营养、肠外营养。本资料中,肠内组首次通气时间、排便次数、首次排便时间、肠鸣音个数、肠鸣音恢复时间改善情况优于肠外组,提示肠内营养能明显改善重症急性胰腺炎合并肠源性感染患者临床症状。原因如下:胃肠功能出现障碍时,肠外营养能提供机体代谢所需热量、营养素、蛋白质以维持营养状态,满足患者高代谢需求,对胰腺无刺激,但是长期使用,会使机体处于长期禁食状态,导致肠道内特殊营养物质缺乏,引起肠黏膜屏障功能异常,使肠道通透性增强,促进菌群易位、繁殖,诱发肠源性感染,继而诱发一系列并发症,甚至引起器官衰竭[6-7]。同时,由于缺乏食物刺激,肠道蠕动减弱,导致肠黏膜萎缩,抑制肠道相关内皮组织,造成黏膜浆细胞数量减少、免疫球蛋白含量下降[8]。肠内营养经由鼻空肠管进行营养支持,可减少胰腺感染坏死发生率,改善肠黏膜屏障功能,进而减少内毒素易位[9]。肠内营养还可保护肠黏膜完整性,促进营养物质摄取,从而减少肠源性感染发生,有效避免肠外营养造成的黏膜损伤,且不易引起菌群失衡,减少继发性感染风险[10]。同时肠内营养有维持正常肠道功能、修复上皮功能等作用,能促进肠道蠕动,加强门静脉系统血液循环,在治疗过程中,加入某些特殊营养物质有改善免疫功能作用[11]。本资料还显示,治疗后肠内组ALB、AST、ALT、AMS改善水平优于肠外组,说明与肠外营养支持相比,肠内营养支持在改善肝功能、胰腺功能方面具有明显优势。因此,适时肠内营养支持对疾病治疗、康复有积极作用。
当发生肠源性感染时,机体内出现炎性反应,WBC受炎性刺激后水平上升,临床常使用WBC、内毒素、CRP、TNF-α含量,来反映感染严重程度[12-13]。临床实践[14-15]证实,重症急性胰腺炎患者普遍存在机体防御能力、免疫功能下降现象,严重影响体液免疫。而IgG、IgA、IgM是反映机体体液免疫的主要指标[16]。本资料结果显示,治疗后肠内组CRP、WBC、内毒素、TNF-α低于肠外组,IgG、IgA、IgM改善水平优于肠外组,进一步验证肠内营养支持能改善重症急性胰腺炎合并肠源性感染,能显著提高患者免疫功能,减轻炎症反应,值得临床推广。
综上所述,与肠外营养支持比较,肠内营养支持能明显改善重症急性胰腺炎合并肠源性感染患者临床症状,提高免疫功能,减轻炎症反应,有利于病情恢复。
