年龄相关性白内障晶状体上皮细胞中P53及SIRT1的表达及临床意义
2022-03-25李宁卜京丽李娟
李宁,卜京丽,李娟
白内障是各种原因导致的晶状体混浊,目前已成为首位致盲眼病,其中最常见的是年龄相关性白内障(age-related cataract,ARC)[1]。在我国ARC患者约有500万,并且每年新增的ARC患者约40万。若白内障病程延缓10年,ARC的发病率将降低14%,而需要通过手术治疗的ARC患者将减少50%[2]。所以,深入探究ARC的发病机制,从而有效地降低其发病率,延缓白内障病程进展,对ARC的防治有着重大意义。
晶状体上皮细胞(lens epithelial cells,LECs)的功能对于维持晶状体透明性起着至关重要的作用,LECs是ARC研究的关键细胞,凋亡的相关研究,成了ARC发病机制中的热点问题。P53是调控凋亡的主要因子之一,当DNA受损时,P53表达上调,引起细胞凋亡[3]。因此,如何保护LECs,避免凋亡发生,对于ARC的发病具有重要意义。沉默信息调节因子(silent information regulator1,SIRT1)属于组蛋白脱乙酰酶,其能够感受细胞内的能量水平,避免细胞过早凋亡,延长细胞寿命[4]。目前,SIRT1已成为老年性疾病治疗的药物靶点,通过改变SIRT1的表达,延缓老年性疾病的发生,对于老年性疾病的防治具有重大意义。对于P53与SIRT1表达情况是否参与ARC发生和发展的研究较少,本研究拟对ARC患者LECs内P53以及SIRT1表达水平进行分析,以期待为临床干预ARC的发生和发展提供新方向。现报告如下。
1 资料与方法
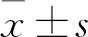
1.1 一般资料 选取2019年3月—2020年3月本院收治的20例(20眼)ARC患者为实验组,选择相同年龄段行透明晶状体摘除手术的视网膜脱离患者20例(20眼)为对照组。实验组:男8例,女12例;年龄60~70(64.89±2.12)岁;病程2~5(3.06±1.01)年。纳入标准:(1)裂隙灯检查确诊为ARC;(2)最佳矫正视力低于0.5;(3)有意愿通过手术提高视力者。排除标准:(1)高血压、糖尿病、心脏病等慢性疾病者;(2)其他原因导致的晶状体混浊;(3)合并青光眼、葡萄膜炎患者不在本次研究范围;(4)依从性差,不愿意配合研究者。对照组:男7例,女13例;年龄60~70(64.93±2.11)岁。纳入标准:(1)新发孔源性视网膜脱离,病程<1个月;(2)晶状体无明显混浊,未达到白内障诊断标准;(3)需行晶状体摘除联合玻璃体切割手术者。排除标准:(1)高血压、糖尿病、心脏病等慢性疾病者;(2)合并葡萄膜炎、青光眼及其他眼部慢性疾病者;(3)依从性差,不愿意配合研究者。2组患者年龄、性别比较差异无统计学意义(均P>0.05)。全部患者及其家属均存在知情同意权,自愿签署相关医疗文书。本研究经医院伦理委员会审批通过。
1.2 方法
1.2.1 LECs前处理 2组患者均在手术过程中实施前囊膜环形撕除,直径5 mm。使用无菌生理盐水进行充分清洗,放置在EP管内,并置于-80℃冰箱内保存。
1.2.2 免疫组织化学SP法检测LECs内P53表达 (1)防脱片;(2)制作常规石蜡切片;(3)HE染色,并使用中性树胶进行封片,放置在显微镜下观察和拍照。使用SP免疫组化检测试剂盒(采购自北京博奥森生物技术有限公司)对标本内P53表达情况进行检测,全部操作均严格依据试剂盒使用说明进行。
1.2.3 实时荧光定量PCR检测LECs内SIRT1表达情况 选择LECs组织,使用总RNA提取试剂盒(Trizol法,采购自无锡百泰克生物技术有限公司)对组织标本内总RNA进行提取,使用miRNA逆转录试剂盒(采购自美国GeneCopoeia)依据步骤将2 μg RNA逆转录成cDNA,随后依据试剂使用说明配反应体系,加样。实时荧光定量PCR反应体系共包含20 μL,配制完成后将其放置在荧光定量PCR仪(采购自厦门安普利生物工程有限公司)中实施反应,将操作程序设置成:95 ℃ 5 s、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 15 s,以上述模式一共开展41次循环,最后72 ℃延伸10 min。并在反应完成后整理所得数据,计算SIRT1mRNA相对表达量。
1.2.4 检测氧化应激因子水平 选择LECs标本,要求范围是3 mm×3 mm,添加pH值是7.3的磷酸缓冲液,使用涡旋振荡,并置于-4 ℃环境中冷冻离心,使用酶联免疫吸附法开展定量检测,主要指标有GSH-Px、GSH、MDA以及SOD。
1.3 观察指标 (1)比较2组患者P53以及SIRT1的表达水平。P53蛋白表达阳性的细胞中,细胞核表现为棕黄色,使用高倍镜(×40)进行观察,并在此基础下每张切片随机选择5个高倍视野用于表达情况统计,开展灰度值扫描。(2)比较2组患者氧化应激指标水平。
2 结果
2.1 2组患者P53及SIRT1的表达水平比较 实验组患者P53以及SIRT1表达水平高于对照组,差异有统计学意义(P<0.05)。见表1。
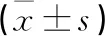
表1 2组患者P53以及SIRT1的表达水平比较
2.2 2组患者氧化应激指标水平 比较实验组患者GSH-Px、GSH以及SOD、MDA水平均高于对照组,差异有统计学意义(P<0.05)。见表2。
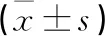
表2 2组患者氧化应激指标水平比较
2.3 影响ARC发生的多因素Logistic回归分析 为减少自变量之间的混杂干扰,将上述因素分析中与ARC发生有关的P53、SIRT1表达水平及GSH-Px、GSH、SOD、MDA水平进行多因素逐步Logistic回归分析,ARC为因变量(有=1,无=0),其他因素为自变量,均以实际值赋值。结果发现,SIRT1表达水平为ARC发生的保护因素,P53以及GSH、SOD、MDA水平为ARC发生的独立危险因素(P均<0.05)。见表3。
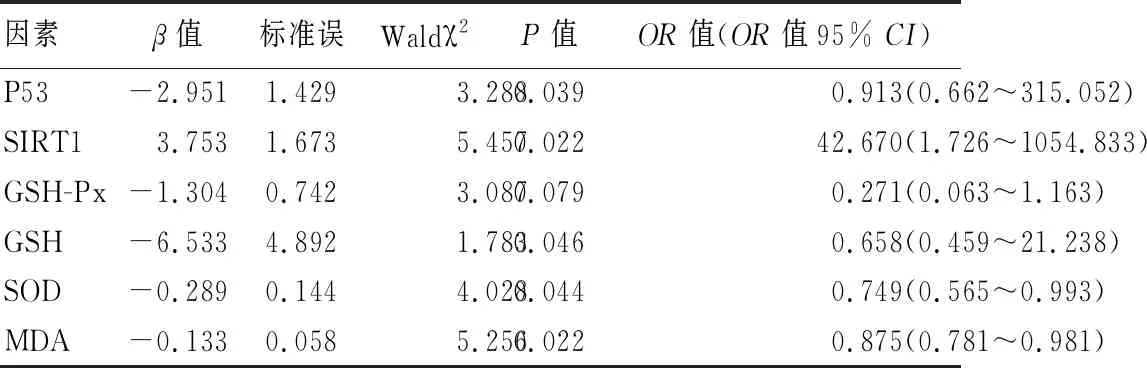
表3 影响ARC发生的多因素Logistic回归分析
3 讨论
ARC是世界范围内主要致盲眼病,其发病机制复杂,氧化损伤是其主要致病原因[5]。正常人晶状体内有功能良好的抗氧化系统,能够有效阻挡外部因素所造成的氧化应激伤害,随着年龄增长,自身晶状体抗氧化功能逐渐下降,导致白内障出现。SH-Px、GSH以及SOD、MDA等是反应组织氧化损伤程度的重要指标,氧化应激时会有上述细胞因子表达的升高。而ARC的发生、发展与LECs的状态密切相关,LECs的凋亡是ARC发病的细胞学基础。高水平的氧自由基造成LECs代谢异常,使LECs凋亡及晶状体蛋白变性[6]。ARC患者LECs存在大量凋亡细胞,未患白内障同龄人LECs仅有少量凋亡细胞,而LECs的凋亡、脱落,Ca2+的稳态失衡,造成细胞膜通透性增加,导致晶状体混浊[7]。凋亡是细胞在应激条件下,由基因调控的有序且主动的程序性细胞死亡过程,是人体正常生长发育的组成部分,细胞凋亡的不平衡则会导致细胞的生长或者死亡。凋亡由多种途径介导,同时受多种凋亡因子调控,其中P53是调控凋亡的主要因子之一,P53是当前发现的同人类肿瘤相关性最高的基因,编码的蛋白处于细胞核内,对细胞生长发挥负调节作用,能够促进细胞凋亡。当氧化应激损伤发生时,机体通过上调P53,降低Bcl-2/Bax比例,激活半胱氨酸水解酶(caspase)通路[8],使处于线粒体内的细胞色素C以及处于胞质内的ATP被大量释放,当上述2种物质同凋亡蛋白酶活化因子1结合后能够对caspase9产生激活效应,处于激活状态的caspase9能够对下游效应蛋白caspase3产生裂解,进而引起细胞凋亡,同时P53还可促使氧化应激有关基因形成,表达产物形成活性氧等,进一步增加细胞色素C释放量,激活caspase而促进细胞凋亡;另一方面,P53可诱导死亡配体Fas/Apol以及KILLER/DR5形成三聚体,并结合至相应配基,引起下游效应caspase裂解,进而导致细胞凋亡[9-11],同时P53促进细胞周期停滞为细胞损伤修复创造条件,对于损伤后不能修复的细胞,诱导细胞衰老和凋亡来清除。在此基础上,寻找降低LECs凋亡的保护途径或者增强LECs抵抗凋亡的保护体系,无疑对于ARC的发病进程产生积极的影响。
近年来,SIRT1逐渐走进人们视线,并越来越多地受到人们的重视。SIRT1是一种细胞代谢辅酶NAD+依赖地Ⅲ类组蛋白去乙酰化酶,通过转录调控,参与基因转录、能量代谢以及细胞衰老过程的调节,具有延长生物寿命,延缓各种年龄相关性疾病进展的作用,因此,在抗衰老领域备受关注。SIRT1可以通过调节叉头转录因子(Forkhead box O,FOXOs)、P53等的活性,通过组蛋白脱乙酰基作用,发挥抗凋亡的作用[12],从而延缓年龄相关性疾病的进展。P53是SIRT1的重要底物,在正常情况下,P53呈现休眠状态,但是当细胞发生DNA损伤等刺激后,在P53 C末端的多个赖氨酸位点出现乙酰化,从而呈现激活状态,刺激下游多种靶基因转录,诱导细胞凋亡[13]。而SIRT1能够利用去乙酰化P53后降低P53介导的转录激活,进而发挥维护细胞避免出现凋亡的效果[14]。SIRT1作为机体自身防御体系的重要组成成分,当氧化应激发生时可出现反应性表达上调,既往报道[15]显示,在角膜、晶状体、视网膜等组织中均观察到SIRT1的表达。同其他细胞相同,在氧化损伤环境中出现反应性上调,也是SIRT1对人LECs发挥保护作用的关键措施,从而降低细胞凋亡水平,延缓ARC疾病进展。
本次研究中,在GSH-Px、GSH以及SOD、MDA水平方面,实验组均高于对照组,实验组P53、SIRT1表达水平高于对照组,该结果与文献报道[6]结果一致。通过研究我们发现,ARC发病过程中伴有氧化应激的发生,在氧化损伤的过程中伴有P53的表达上调促进细胞凋亡,SIRT1的表达上调,是LECs保护自身,避免凋亡的重要因素之一。目前,对于ARC的研究多针对其致病原因行相关细胞因子检测,而对于如何抑制凋亡、延缓ARC病程进展研究较少。本研究不但从致病因素,同时从如何延缓ARC病程进展、抑制凋亡两方面同时入手。但因样本量及细胞因子较少等因素影响,本研究也存在一定不足,P53如何促进凋亡、SIRT1如何在ARC的发病过程中对LECs起着保护作用以及如何调控P53表达水平影响LECs凋亡等分子机制还需在增加样本量以及更多细胞因子、更多调控途径的基础上,进行进一步深入研究。
综上所述,ARC患者LECs内,P53、SIRT1呈高表达,在ARC的发病中起着潜在的作用。通过SIRT1的表达调节,延缓ARC的病程进展,可作为ARC药物治疗的靶点,为ARC的预防和治疗提供新的理论依据。
