骨肽类注射剂类过敏反应评价研究
2022-03-25杨奇涛吴殷囡汪玉馨孟长虹宗卫峰陆益红史清水
杨奇涛,吴殷囡,汪玉馨,孟长虹,宗卫峰,陆益红,史清水∗
(1.中国药科大学,南京 211198;2.江苏省食品药品监督检验研究院,南京 210019;3.徐州医科大学药物分析教研室,江苏 徐州 221004)
类过敏反应的临床表现有皮疹、瘙痒、荨麻疹、寒战、恶心、呕吐、腹痛、腹泻、胸闷、呼吸困难、血压下降以及过敏性休克等,与I型过敏反应相似,容易混淆,其发生于首次给药后30min内,无需IgE介导[1-2]。骨肽类制剂为多组分生化药,以猪或牛的四肢骨提取物制成,或与全蝎提取物混合制成复方骨肽制剂,成分包括活性肽、肽类活性因子、有机钙、磷、无机钙、无机盐、微量元素、氨基酸等[3-4]。临床该制剂主要通过静脉注射或肌肉注射给药,用于骨折、骨关节炎、风湿、类风湿关节炎等疾病的治疗[5-6]。国家药品不良反应监测中心在《药品不良反应信息通报》中对骨肽和复方骨肽注射剂的安全问题进行了通报[7]。近年来,对骨肽类注射剂不良反应病例分析发现,其不良反应的临床表现有过敏性休克、皮疹、瘙痒、胸闷、心慌、呼吸困难、寒战、发热、等过敏性反应,还包括消化系统、血液系统的损害[8]。骨肽类注射剂的不良反应中,给药30min内发生的不良反应占比较多(40%以上)[9]。由于前期本课题组采用全身主动过敏实验法对骨肽类注射剂的过敏反应进行评估,结果均为阴性,故在本研究进一步采用类过敏相关模型考察骨肽类注射剂与类过敏反应的相关性,对骨肽类制剂的临床安全用药及其不良反应的阐述和发生机制研究具有重要意义。
类过敏反应机制在体内较为复杂,可能与补体系统或膜表面受体介导肥大细胞和嗜碱性粒细胞脱颗粒释放活性物质,导致毛细血管通透性增加有关[10]。在此基础上,细胞脱颗粒实验、大鼠蓝斑皮肤实验、小鼠耳廓蓝染实验等方法在类过敏反应研究中有相关报道[11-13]。其中小鼠耳廓蓝染实验由类过敏物质与伊文思蓝(evans blue,EB)混合经静脉注射入体内后,EB迅速与血浆蛋白结合,在类过敏相关物质影响下,体内毛细血管通透性增加,导致EB随血浆蛋白渗出血管,表现为小鼠耳廓蓝染[14],该检测法操作简便,但在阳性药物选择与剂量、实验方法及评价指标未有明确的标准,因此,本课题通过阳性药筛选,建立了适宜的阳性模型,并将其用于骨肽类注射剂的类过敏反应评价研究。
1 材料和方法
1.1 实验动物
SPF级雄性ICR小鼠246只,体重20~22g,5~6周龄,购于北京维通利华实验动物技术有限公司[SCXK(浙)2019-0001]。动物饲养于江苏省食品药品监督检验研究院屏障系统内[SYXK(苏)2019-0047],本研究经江苏省食品药品监督检验研究院实验动物福利伦理审查委员会审批(JSIFDC2020-04),实验动物按3R原则给予人道关怀。
1.2 主要试剂与仪器
骨肽注射液(企业A、B、C)、复方骨肽注射液(企业A、D)、骨肽氯化钠注射液(企业E)、注射用骨肽(企业E、F)、注射用骨瓜提取物(企业G、H)、骨瓜提取物注射液(企业I、H);磷酸组胺(中国食品药品监督检验研究院,批号:150510-201313);组胺(北京百灵威科技有限公司,批号:LK90T46);组胺二盐酸盐(德国LGC公司,批号:G165368);0.9%氯化钠溶液(中国大冢制药有限公司、批号:8J95D4);伊文思蓝(上海Sigma-Aldrich公司,批号:MKCF0851);甲酰胺(上海Sigma-Aldrich公司,批号:94024020)。
XP6型/XS205DU型电子天平(瑞士梅特勒-托利多仪器有限公司);Synergy H1多功能酶标仪(美国博腾Bio Tek公司);XiangYi L-550低速离心机(长沙湘仪离心机仪器有限公司)。
1.3 实验方法
1.3.1 实验分组及给药
(1)溶液配制
天平称取EB2g,溶解于100mL0.9%氯化钠溶液,超声10~15min,直至充分溶解,然后用0.22 μm滤膜过滤得到2% EB溶液,用于配制含EB的各组药液。
阴性对照组:含0.16% EB的0.9%氯化钠溶液。
阳性对照组:高剂量组:(1)组胺:以0.9%氯化钠溶液为溶剂,配制成浓度为1mg/mL(含0.16%EB)的溶液;(2)磷酸组胺:以0.9%氯化钠溶液为溶剂,按照分子量折算,配制含组胺1mg/mL(含0.16% EB)的溶液;(3)组胺盐酸盐:以0.9%氯化钠溶液为溶剂,按照分子量折算,配制成含组胺1 mg/mL(含0.16% EB)的溶液;低剂量组:(1)组胺:以0.9%氯化钠溶液为溶剂,配制成浓度为0.5mg/mL(含0.16% EB)的溶液;(2)磷酸组胺:以0.9%氯化钠溶液为溶剂,按照分子量折算,配制为含组胺0.5mg/mL(含0.16% EB)的溶液。
样品组:高剂量组:骨肽类注射剂按照其规格用0.9%氯化钠溶液配制为5mg/mL(含0.16%EB)的药液。中剂量组:骨肽类注射剂按照其规格用0.9%氯化钠溶液配制为2.5mg/mL(含0.16%EB)的药液。低剂量组:骨肽类注射剂按照其规格用0.9%氯化钠溶液配制为1mg/mL(含0.16%EB)的药液。骨肽氯化钠注射液的原液浓度为1 mg/mL故实验中设置了1mg/mL与0.5mg/mL两个剂量组。
(2)实验分组
小鼠按照体重随机分组,每组6只,每只小鼠尾静脉给予0.5mL药液。阴性对照组给予0.9%氯化钠溶液(含0.16% EB);阳性对照组,分别给予高剂量及低剂量的组胺(含0.16% EB)、磷酸组胺(含0.16% EB)、组胺盐酸盐(含0.16% EB);样品组,分别给予相应的高、中、低剂量含0.16% EB的样品溶液。
1.3.2 实验指标选择
(1)小鼠耳廓蓝染率测定
给药30min后处死小鼠。观察并记录各组出现耳廓蓝染色的动物数量,计算各组耳廓蓝染的发生率。
(2)小鼠耳廓EB渗出量测定
EB标准曲线配制:将10mg EB溶于10mL甲酰胺中,配制得浓度为1mg/mL的备用溶液。取200μL备用溶液用20mL甲酰胺稀释得到浓度为10μg/mL的工作液。
观察并记录小鼠的耳廓蓝染情况后,处死并立即沿耳根部剪去双耳后,剪成小块,用2mL甲酰胺浸没,室温浸泡48h,提取耳廓中渗出EB染料,各组双耳EB渗出量及升高率的测定:浸泡48h后离心15min,转速为3000r/min。在96孔培养板中加入200μL各组上清液,以等量甲酰胺作为空白对照,用酶标仪在620nm下测定吸光度(A)值。根据标准曲线计算EB含量,将其换算2mL甲酰胺中所含有EB染料的总渗出量,并计算EB升高率。EB升高率=(给药组EB含量-阴性对照组EB含量)/阴性对照组EB含量×100%。
本实验中设定的类过敏反应判断标准如下:a:耳廓蓝染发生率≥30%;b:耳廓EB升高率≥50%。以上2项条件均符合时,类过敏反应判断为阳性。
1.4 统计学方法
采用GraphPad Prism5软件对所有实验数据进行统计分析采用平均数±标准差(±s)表示各组实验数据。P<0.05为差异具有统计学意义。
2 结果
2.1 阳性模型的建立
利用3种组胺标准品(磷酸组胺、组胺、组胺盐酸盐)建立阳性模型,结果见表1。结果发现各组高低剂量阳性对照组蓝染发生率均为100%,同时其EB渗出量相比阴性对照组都明显升高且升高率大于50%,类过敏反应均判定为阳性(图1)。考虑到实验过程中静脉注射高剂量组胺盐酸盐,30min内小鼠存在呼吸加快、轻微抽搐等情况,无法判定类过敏的产生是否由组胺盐酸盐引起,因此在低剂量考察时,未将其纳入考察对象。比较了低剂量组胺与磷酸组胺的类过敏结果发现,磷酸组胺的蓝染情况与EB升高率更为明显,且低剂量下的EB升高率与其高剂量组相差不大。综上,后期选择低剂量的磷酸组胺作为骨肽类注射剂类过敏考察的阳性对照模型药物。

图1 阳性模型典型耳廓蓝染图(高剂量组)Figure1 Typical ear blue staining of positive model(High-dose group)
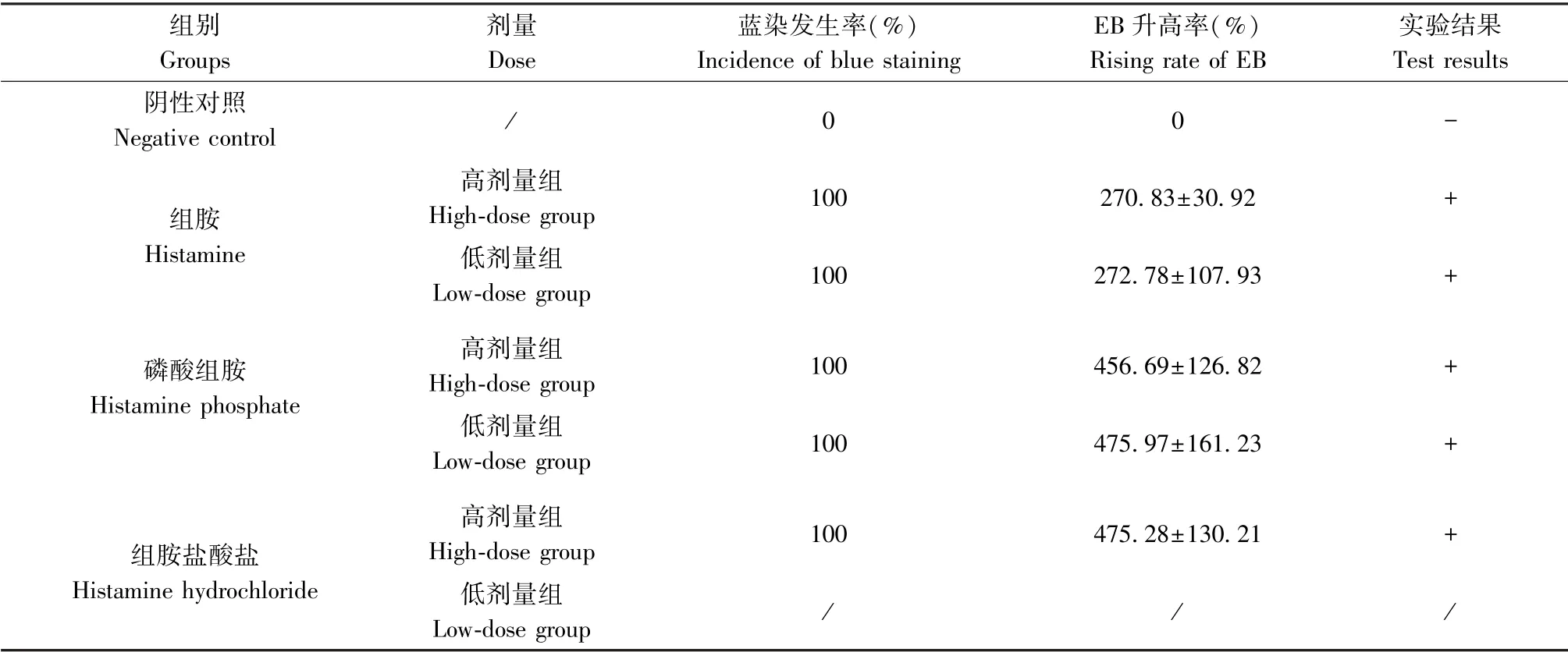
表1 不同剂量的阳性对照的耳廓蓝染结果(n=6)Table1 Ear blue staining results of different doses of positive control
2.2 骨肽类注射液类过敏反应的考察
根据骨肽注射液及复方骨肽注射液的临床用药浓度,设置高剂量组药液浓度为5mg/mL;中剂量组药液浓度为2.5mg/mL;低剂量组药液浓度为1 mg/mL。综合比较了骨肽类注射液在小鼠耳廓蓝染实验中观察记录的耳廓蓝染发生率及计算所得的EB升高率(见表2)。高剂量(5mg/mL)下,不同企业间骨肽类注射液引起的类过敏反应具有一定差异,企业B骨肽注射液的EB升高率大于50%,企业A骨肽注射液和复方骨肽注射液、企业D复方骨肽注射液的EB升高率大于50%且大于阳性对照组,以上各组蓝染发生率均大于30%,故类过敏反应均呈阳性;企业C骨肽注射液EB升高率低于50%且无蓝染发生,类过敏反应呈阴性。中剂量(2.5mg/mL)下,企业A骨肽注射液和复方骨肽注射液、企业B骨肽注射液、企业D复方骨肽注射液的EB升高率相均大于50%,同时蓝染发生率也大于30%,上述企业的制剂类过敏反应仍呈阳性;其余骨肽类注射液结果判定为阴性。在低剂量(1mg/mL)下,上述部分制剂小鼠蓝染实验结果虽然EB升高率大于50%,蓝染发生率均低于30%,各组结果判定均呈阴性。(见图2、图3)。
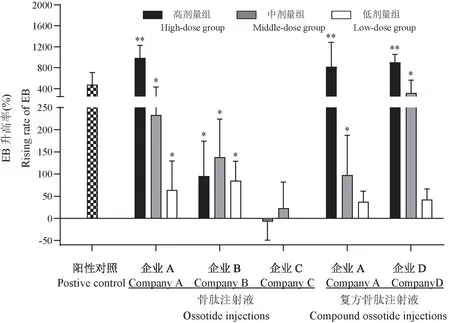
图2 不同企业的骨肽类注射液耳廓蓝染实验EB升高率Figure2 Rising rate of EB in ear blue staining experiment of osteopeptide injections from different companies

表2 不同企业的骨肽类注射液的耳廓蓝染结果(n=6)Table2 Results of ear blue staining experiments of osteopeptide injections from different companies

图3 不同企业的骨肽注射液典型耳廓蓝染图(高剂量组)Figure3 Typical ear blue staining pictures of osteopeptide injections from different companies(High-dose group)
2.3 其他骨肽类注射剂类过敏反应的考察
骨肽注射液与复方骨肽注射液是临床上使用较多的骨肽类注射剂,除此之外还有多种其他的骨肽类注射剂,因此我们还利用小鼠耳廓蓝染模型考察了骨肽氯化钠注射液、注射用骨肽、骨瓜提取物注射液及注射用骨瓜提取物的类过敏反应(见表3)。高剂量下,除了企业E的骨肽氯化钠注射液与企业I的骨瓜提取物注射液,其余5个骨肽类注射剂EB升高率均大于50%,且蓝染发生率大于30%,其中企业G、H的注射用骨瓜提取物与企业F的注射用骨肽EB升高率明显高于阳性对照组,故类过敏反应呈阳性。中剂量下,企业G、H的注射用骨瓜提取物与企业H的骨瓜提取物注射液EB升高率均大于50%,且蓝染发生率大于30%,类过敏反应判断仍为阳性,其余四组判定结果为阴性。在低剂量下,上述部分制剂小EB升高率虽然大于50%,但各组的蓝染发生率均低于30%,因此结果判定均呈阴性。(见图4、图5)。
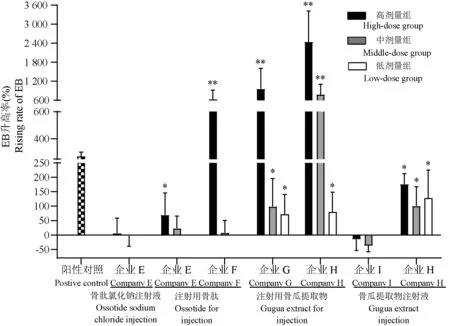
图4 不同企业的其他骨肽类注射剂耳廓蓝染实验EB升高率Figure4 Rising rate of EB in ear blue staining experiment of other osteopeptide injections from different companies

图5 不同企业的其他骨肽类注射剂典型耳廓蓝染图(高剂量组)Figure5 Typical ear blue staining pictures of other osteopeptide injections from different companies(High-dose group)
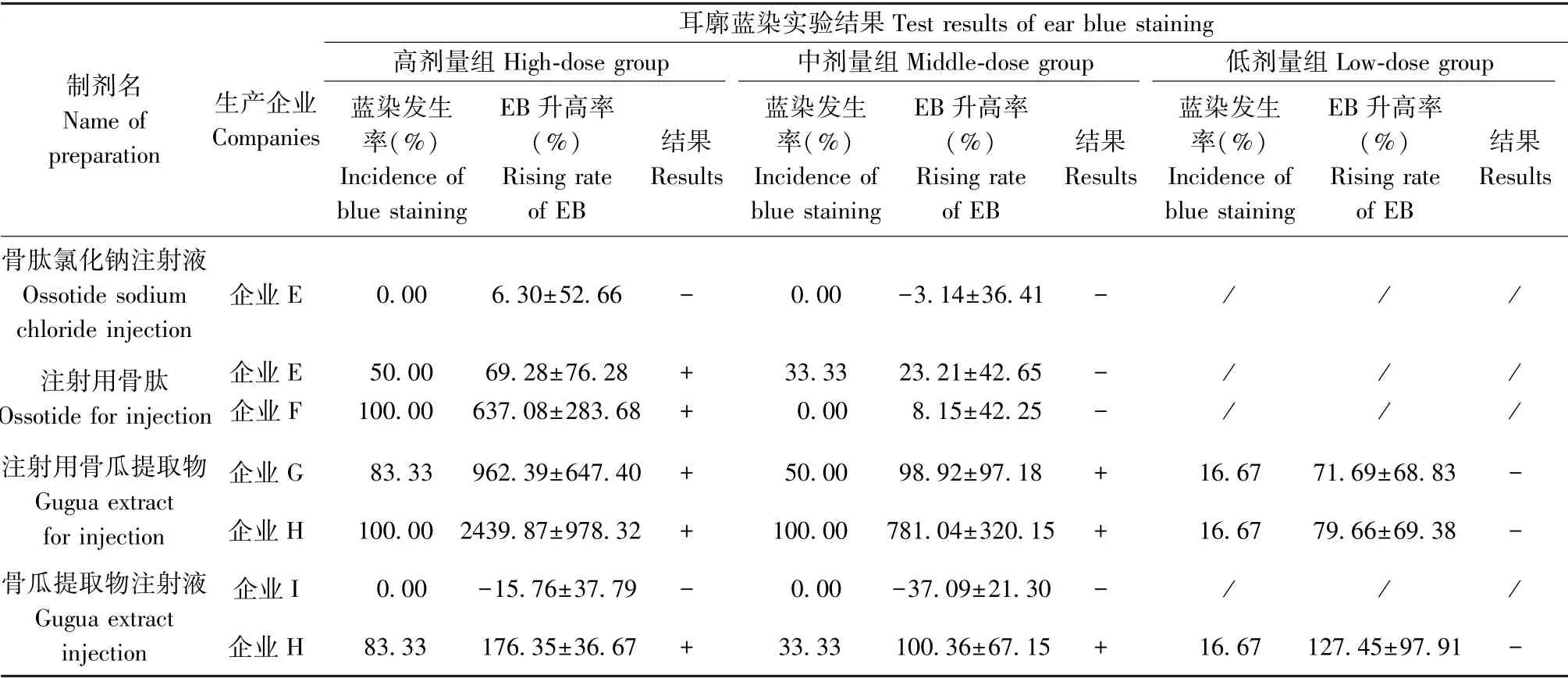
表3 不同企业的其他骨肽类注射剂的耳廓蓝染结果(n=6)Table3 Results of ear blue staining experiments of other osteopeptide injections from different companies
3 讨论
根据临床数据显示[9,15],大部分的类过敏反应于给药30min内发生,故小鼠耳廓蓝染实验中,将给药时间设为30min,观察耳廓蓝染情况,以与临床不良反应相关。同时本研究分析了制剂临床用药浓度与动物实验浓度的相关性。
骨肽注射液与复方骨肽注射液是常用的骨肽类注射剂,临床上常作为骨折、骨关节炎、风湿、类风湿关节炎等疾病的治疗或辅助治疗药物。骨肽注射液(临床用药剂量为1.67mg/kg)给药浓度由高到低折算后分别为临床用药剂量的8.33倍、4.17倍、1.67倍;复方骨肽注射液(临床用药剂量为2.5 mg/kg)的给药浓度由高到低依次为临床用药浓度的5.5倍、2.75倍、1.1倍。结果表明,高、中剂量下,仅1批骨肽注射液呈阴性反应;低剂量下均呈阴性反应,蓝染发生率均低于30%,但有2批骨肽注射液的EB升高率大于50%。
为了更好地评价骨肽类注射剂的类过敏反应相关性,利用小鼠耳廓蓝染模型对其他骨肽类注射剂(骨肽氯化钠注射液、注射用骨肽、骨瓜提取物注射液、注射用骨瓜提取物)进行类过敏评价。注射用骨肽、骨瓜提取物注射液、注射用骨瓜提取物的临床剂量都为1.67mg/kg,其给药浓度由高到低折算后分别为临床用药剂量的8.33倍、4.17倍、1.67倍,与骨肽注射液的实验结果相似,在高、中剂量下多数给药组存在不同程度的类过敏阳性情况,而在低剂量下类过敏反应均判定为阴性;而骨肽氯化钠注射液在原液浓度下类过敏反应呈阴性。
结合近年对药物的类过敏研究[16],在1倍临床用药剂量下,清开灵注射液、生脉注射液、鱼腥草注射液等均未呈现阳性反应,但清开灵注射液在2倍临床剂量下、生脉注射液在1.67倍临床剂量有轻微的类过敏阳性反应。骨肽注射液、注射用骨肽、骨瓜提取物注射液、注射用骨瓜提取物在临床剂量的4.17倍与复方骨肽注射液在临床剂量的2.75倍即呈有不同程度的阳性反应,故骨肽类注射剂可能存在类过敏风险。此外,类过敏反应具有明显的量效关系,单位时间内给予的药物浓度越高,类过敏发生的可能性越高,且程度逐渐加重[17-18];而骨肽类注射剂的类过敏反应也存在一定的量效关系,与之相符。因此骨肽类注射剂在临床用药时应注意用药浓度以及需要观察患者用药后的身体情况。
骨肽类注射剂的临床不良反应多发生于给药后30min,而在患者持续给药期间也会出现过敏样反应[9]。此外,胡青[19]发现骨肽类注射剂的临床不良反应与患者的给药量、基础病史、过敏史等诸多因素相关,故骨肽类注射剂的过敏样反应可能与类过敏反应与过敏反应均有关。本研究采用小鼠耳廓蓝染模型,通过观察小鼠首次给予骨肽类注射剂后的耳廓蓝染情况,考察骨肽类注射剂的类过敏反应,而对于骨肽注射剂的过敏反应需要采用相关模型进一步考察。综上,骨肽类注射剂的类过敏评估对其不良反应研究具有重要意义,也为临床用药给药浓度的选择、速度的控制,用药安全的保障提供参考和依据。
