鳜源维氏气单胞菌的分离鉴定及毒力基因分析
2022-03-25邓汝森张建州张浩权黎家明罗世诚颜广智陈盛楠黄良宗
邓汝森,张建州,张浩权,黎家明,罗世诚,颜广智,陈盛楠,黄良宗
(佛山科学技术学院生命科学与工程学院,广东佛山 528000)
鳜(Sinipercachuatsi),即鳜鱼,俗称翘嘴鳜、桂花鱼、桂鱼等,为硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、鮨科(Serranidae)、鳜亚科(Sinipercina)、鳜属(Siniperca),为我国特有的淡水肉食性凶猛鱼类,其生长过程对水质的要求较高[1-2]。近年来,随着集约化养殖业的发展,鳜鱼养殖密度逐渐加大,水质条件也随之变差;很多繁殖场不注重苗种选育,近亲繁殖较为普遍,从而导致鳜鱼抗逆性和抗病性越来越差[3]。2020年10月,广东省肇庆市某养殖池塘鳜鱼出现大规模游塘死亡,检查发现鱼脊部、腹部和尾鳍等部位带有轻微白色溃疡,肝脏、肾脏和肠道未见明显病理变化。该池塘的鳜鱼在3 d前已出现零星死亡,用阿莫西林、维生素C等药物后效果不明显;常规水质指标检测显示,氨氮含量高达1.2 mg/L,亚硝酸盐0.2 mg/L,pH8.1,平均水温21℃。采集病变明显的鳜鱼在低温条件下送实验室,未检测到相关病毒,镜检无寄生虫,对其进行了细菌分离鉴定。
1 材料与方法
1.1 材料
1.1.1 病料来源及试验用动物 发病鳜鱼体重28 g±2 g,采集于广东省肇庆市某鳜鱼养殖场。动物回归试验用的健康鳜鱼,广东省肇庆市某鳜鱼繁殖场,体重40 g±3 g,共120尾。
1.1.2 主要试剂 营养肉汤培养基和血平板,广东环凯微生物科技有限公司;细菌生化鉴定管,杭州微生物试剂有限公司;药敏纸片,赛默飞世尔科技(中国)有限公司;PCR扩增试剂盒、DNA Marker DL 2 000、Gold view 染料、pMD18-T载体连接试剂盒、DNA凝胶回收试剂盒,TaKaRa 公司;细菌DNA抽提试剂盒、质粒抽提试剂盒,南京诺唯赞生物科技有限公司。
1.1.3 主要仪器 T-cycles PCR仪,美国MJ ReSearch 公司;水平电泳槽、电泳仪,北京百晶生物技术有限公司;数码凝胶图像分析系统,上海天能科技有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;高速冷冻离心机,德国Eppendorf公司。
1.2 方法
1.2.1 细菌分离纯化及形态观察 参照文献[4],无菌条件下,挑取患病鳜鱼病变明显的溃疡组织,用无菌接种环接种于含100 mL/L小牛血清和10 g/L NAD的营养琼脂固体培养基,28℃恒温条件下分别进行有氧和厌氧培养24 h,挑取典型的优势单菌落接种于血平板纯化培养,蘸取纯化培养的菌落固定于载玻片上,革兰氏染色后镜检观察细菌形态特征。把分离菌转接到LB液体培养基进一步鉴定。
1.2.2 细菌生化特性鉴定 无菌操作,挑取分离菌接种于微量生化鉴定管,28℃恒温下培养24 h,进行细菌鉴定[5]。
1.2.3 细菌16S rRNA及gyrB基因序列分析 按细菌DNA抽提试剂盒说明抽提分离菌DNA,作为PCR反应模板。用16S rRNA通用引物和gyrB基因特异性引物[6]进行PCR扩增(表1)。引物由生工生物工程(上海)股份有限公司合成。PCR反应程序为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,共30个循环;72℃延伸10 min。PCR扩增结束后取产物于10 g/L琼脂糖凝胶进行电泳检测,将阳性产物做胶回收,连接PMD-18T载体,转化DH5α感受态细胞,冰浴30 min,42℃热击90 s,冰浴3 min,加入LB肉汤37℃培养45 min后涂布氨苄平板,分别挑取5个阳性克隆送生工生物工程(上海)股份有限公司测序。将测序结果与GenBank中登录的参考菌株序列进行比对,用MEGA7.0 软件中的Neighbour-Joining 法构建系统进化树,重复抽样1 000次对系统进化树各分支进行置信度分析。

表1 引物序列信息Table 1 Primer sequence information
1.2.4 人工感染试验 选取健康、体重接近的鳜鱼进行人工感染试验。无菌操作挑取分离菌接种于LB营养肉汤,28℃、220 r/min振摇培养18 h。经LB固体培养基进行细菌计数后,菌液浓度分别调整为4.5×109、4.5×108、4.5×107、4.5×106CFU/mL。本试验设A、B、C、D 4组为攻毒组,E组为对照组,每组8尾鳜鱼,攻毒组分别腹腔注射0.1 mL上述菌液;对照组注射等量生理盐水,重复3次试验。每个试验组的鳜鱼分别暂养于1 m×0.8 m×0.8 m的水族缸,每天换水20%,温度保持28℃±2℃,观察7 d后再进行人工感染试验。试验期间增氧机保持开启,定时监测水质变化和鳜鱼动态。及时对攻毒死亡的鳜鱼进行剖检观察和细菌分离鉴定。
1.2.5 毒力基因检测 用分离菌的DNA作为模板,参照文献[7]对气溶素(aerolysin,aerA)基因、细胞毒性肠毒素(cytotoxic enterotoxin,Act)基因、热不稳定性肠毒素(heat-labile enterotoxins,Alt)基因、热稳定性肠毒素(heat-stable enterotoxin,Ast)基因、溶血素(haemolysin A,hlyA)基因、鞭毛(flagellin,Fla)基因、核酶(DNases,Exu)基因、丝氨酸蛋白酶(serineprotease,Ser)基因、弹性蛋白酶(elastase,ahyB)基因和酯酶(lipase,Lip)基因进行PCR检测(表1),引物均由生工生物工程(上海)股份有限公司合成。
1.2.6 药敏试验 无菌条件下取100 μL分离菌菌液均匀涂布于LB固体培养基,按照KB药敏纸片法将17种药敏纸片紧贴于培养基,每种药物重复3次,每个培养基的药敏纸片不超过4片。28℃恒温培养24 h,测量抑菌圈直径,参考美国临床和实验室标准化协会(CLSI 2016)抗微生物药敏试验标准对分离菌进行判定。
2 结果
2.1 细菌形态观察及生化特性分析
从病变明显的鳜鱼溃疡组织分离到一株优势菌(ZQ202010),在有氧和厌氧条件下生长良好,在血平板上形成乳白色、边缘整齐、光滑微隆起的菌落,无溶血现象(图1A)。经革兰氏染色观察,可见形态一致、单个或成对排列的阴性短杆菌(图1B)。生化特性鉴定结果显示,该分离菌具有运动性,赖氨酸脱羧酶、氧化酶、蔗糖、D-葡萄糖、甘露醇、VP、尿素和吲哚反应呈阳性;精氨酸水解酶、乳糖、木糖、硫化氢、乙酰胺和苯丙氨酸反应呈阴性。结合细菌形态特征和生理生化反应结果可初步判定分离菌为维氏气单胞菌。

图1 分离菌菌落形态(A)和革兰氏染色(B)(1 000×)Fig.1 The morphological characteristics of isolated strain(A)and Gram staining(B)(1000×)
2.2 细菌16S rRNA及gyr B基因序列分析
用细菌16S rRNA通用引物和维氏气单胞菌gyrB基因特异性引物对目的基因进行PCR扩增,凝胶电泳结果显示在1 500 bp和746 bp处分别出现清晰条带,阴性对照无条带(图2)。对PCR纯化产物分别进行克隆测序,16S rRNA基因测序获得1 443 bp大小的序列,与GenBank中登录的参考菌株序列进行比对,分离菌株与维氏气单胞菌同源性均>99%,其中与LTJC株(登录号:MW116753.1)、LS-912株(登录号:MG063196.1)和LTFS2株(登录号:MW116758.1)同源性高达100%。gyrB基因测序后得到714 bp的序列,经比对发现,分离菌株的gyrB基因与维氏气单胞菌gyrB基因的同源性>99%。运用MEGA7.0软件对分离菌株的16S rRNA基因和gyrB基因分别构建系统进化树(图3、图4),可见分离菌株与维氏气单胞菌处于同一分支,说明分离菌为维氏气单胞菌。
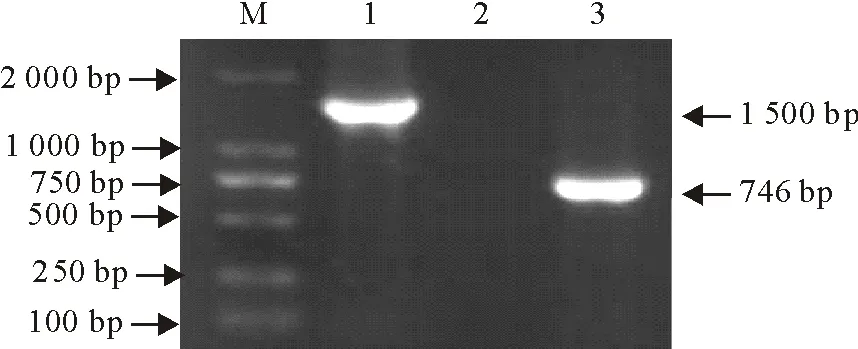
M.DNA标准DL 2 000 ;1.16S rRNA基因扩增产物;2.阴性对照;3.gyr B基因扩增产物M.DNA Marker DL 2 000;1.Amplification product of 16S rRNA gene;2.Negative control;3.Amplification product of gyr B gene图2 分离菌16S rRNA基因和gyr B基因PCR扩增凝胶电泳图Fig.2 Gel electrophoresis of PCR amplification of isolate 16S rRNA and gyr B genes

图3 分离菌株ZQ202010与参考菌株16S rRNA基因系统进化树Fig.3 Phylogenetic tree based on 16S rRNA gene between isolated strain ZQ202010 and reference strains

图4 分离菌株ZQ202010与参考菌株gyr B基因系统进化树Fig.4 Phylogenetic tree based on gyr B gene between isolated strain ZQ202010 and reference strains
2.3 人工感染试验
攻毒8 h后,试验组鳜鱼均出现游动迟缓、水面漂浮现象,对照组未见异常。攻毒12 h后,试验组鳜鱼接连出现死亡;对照组无死亡现象(表2)。死亡鳜鱼接种部位出现不同程度溃疡,与自然发病一致;无菌条件下剖检试验组鳜鱼,可见肠道透明肿胀,充满淡黄色分泌物,腹腔少量积液。挑取鳜鱼溃疡处组织和肠道内容物进行细菌分离鉴定,均分离到与ZQ202010一致的维氏气单胞菌。说明分离菌株具有较强的致病力,是导致该养殖场鳜鱼大量死亡的病原。参见表2 计算ZQ202010对鳜鱼的半数致死量为4.09×106CFU。
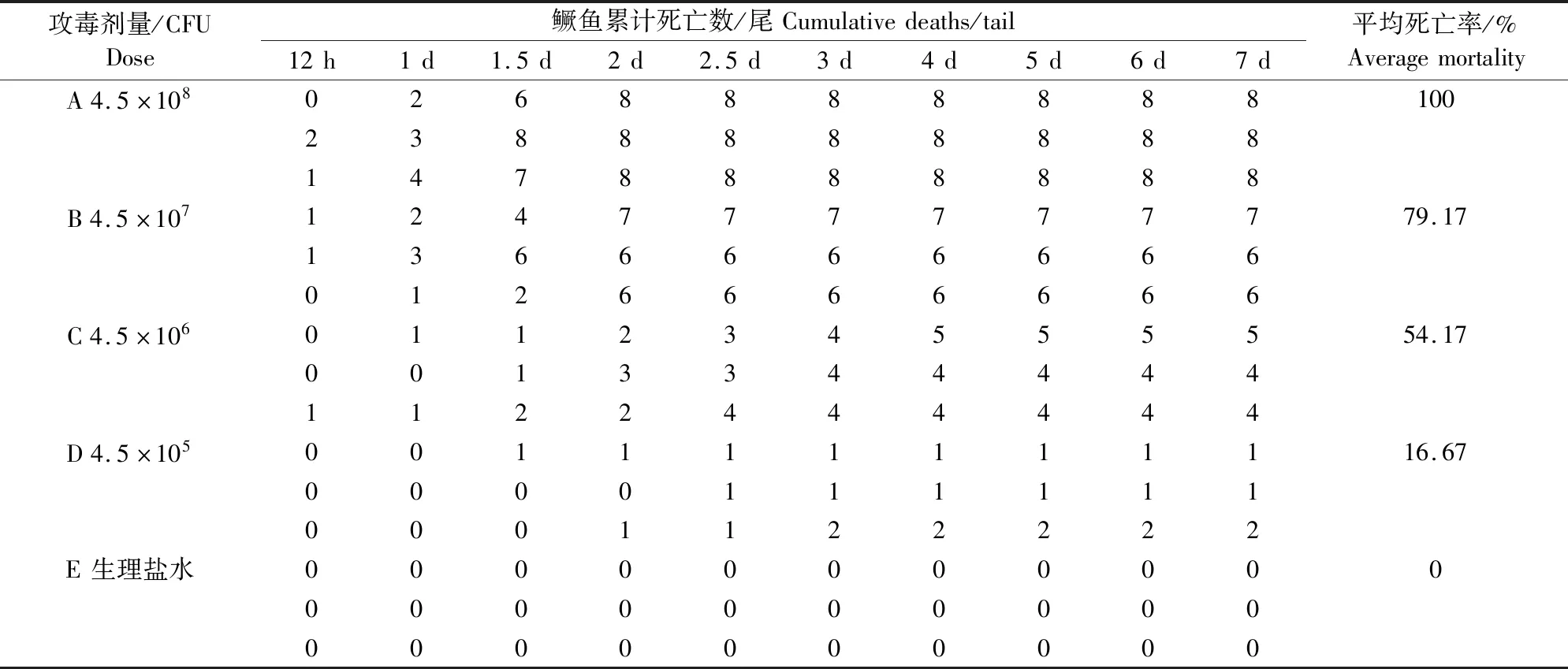
表2 鳜鱼接种分离菌株ZQ202010的半数致死量测定Table 2 Determination ofLD50 of Siniperca chuatsi inoculated with strain ZQ202010
2.4 毒力基因检测
对分离株ZQ202010的aerA、Act、Alt等10个毒力基因进行PCR检测,发现该分离株携带aerA、Alt、Fla、Exu、Ser、ahyB和Lip共7个毒力基因,经克隆测序鉴定与目的基因一致,但没检测到Act、Ast和hlyA毒力基因(图5)。进一步说明分离株ZQ202010具有较强毒力。

M.DNA Marker DL 2 000;1-10.Alt,ahy B,Fla,aer A,Ast,hly A,Lip,Ser,Exu,Act图5 分离菌株毒力基因PCR扩增结果Fig.5 PCR amplification results of virulence genes of isolated strain
2.5 药敏试验
采用17种药敏片对分离菌ZQ202010进行药物敏感性测试,结果表明分离株对头孢拉定、替米考星、头孢曲松、氟苯尼考、强力霉素等5种药物敏感;对阿米卡星、大观霉素、新霉素和庆大霉素中度敏感;对环丙沙星、头孢噻肟、青霉素、阿莫西林/克拉维酸、恩诺沙星、复方磺胺甲噁唑、利福平和氧氟沙星等8种药物产生耐药(表3)。

表3 分离菌株药敏试验结果Table 3 Drug sensitivity test results of isolated strain
3 讨论
维氏气单胞菌(Aeromonasveronii)为革兰氏阴性兼性厌氧杆菌,对环境具有很强的适应性,广泛存在于淡水环境,夏、秋季节其繁殖最快。免疫力降低或体表有创伤的水生动物更容易感染A.veronii[8]。研究表明[9-10],A.veronii已成为一种重要的人、兽、水生生物共患的病原菌,其不但感染鱼类、爬行动物和两栖动物,也可感染包括人在内哺乳动物,特别是老年人、儿童及免疫力低下的人群,不仅给水产养殖业造成了巨大经济损失,同时也严重威胁着人类的健康。近年来,A.veronii感染水生生物的病例越来越多,可导致大口黑鲈(Micropterussalmoides)[11]、克氏原螯虾(Procambarusclarkii)[12]、湘华鲮[Sinilabeodecorustungting(Nichols)][4]、草鱼(Grasscarp)[6]、锦鲤 (Cyprinuscarpio)[13]等数种水产经济动物遭受严重病害,引发鱼类出血、皮肤溃烂、眼球突出、肠炎及腹水等症状[14],应引起足够重视。
本试验分离的维氏气单胞菌携带气溶素、热不稳定性肠毒素、鞭毛、核酶、丝氨酸蛋白酶、弹性蛋白酶及脂酶等毒力基因,经动物回归试验证明该分离菌具有较强的致病力,可引起鳜鱼皮肤溃疡、肠道炎症等病理变化。药敏试验显示,分离菌株对环丙沙星、头孢噻肟、青霉素、阿莫西林/克拉维酸、恩诺沙星、复方磺胺甲噁唑、利福平和氧氟沙星等8种药物产生耐药,其中恩诺沙星耐药明显,这可能与恩诺沙星在水产养殖过程中使用较多有关;对阿米卡星、大观霉素、新霉素和庆大霉素中度敏感;对头孢拉定、替米考星、头孢曲松、氟苯尼考、强力霉素等药物高度敏感。针对本次发病鳜鱼实际情况,本研究团队结合临床治疗经验建议接连换水2次,每次换水量为20%,再利用过硫酸氢钾进行改底,用有机酸和维生素C全池泼洒,4 h后用替米考星进行治疗;第2天鳜鱼死亡量迅速减少,由疾病暴发当天死亡量1 264尾减少到12尾;第2天鳜鱼基本恢复正常。
维氏气单胞菌致病性的强弱与多种毒力因子的表达、分泌相关,如外毒素、肠毒素、胞外蛋白酶和各种黏附因子等[15]。维氏气单胞菌外毒素中,气溶素(aer A)具有很强的细胞毒性、溶血性和肠毒性,对细胞具有很强的裂解作用,aer A缺失株对斑马鱼(Daniorerio)的死亡率明显下降,aerA是维氏气单胞菌致病性的关键毒力基因[16]。aerA检测的有无并不能代表气单胞菌的毒力强弱,携带aerA基因的维氏气单胞菌未必能够产生溶血现象,据此推测aerA基因可能与其他毒力基因存在相互作用关系,这与刘小芳[14]的观点一致。肠毒素包括细胞毒性肠毒素(Act)、热不稳定性肠毒素(Alt)和热稳定性肠毒素(Ast),其中Act具有溶血活性、细胞毒性和肠毒性,Alt和Ast虽没有溶血和溶细胞活性,但能够增加肠上皮细胞cAMP和前列腺素的水平[17]。气单胞菌能够产生多种蛋白酶,其中胞外蛋白酶是重要的致病因子,包括脂肪酶、DNA酶、丝氨酸蛋白酶、弹性蛋白酶、酪蛋白酶、淀粉酶、温度敏感性蛋白酶和卵磷脂酶。本试验中的分离菌株检测到aerA、Alt、Fla、Exu、Ser、ahyB和Lip基因,并结合动物致病性试验,进一步说明分离菌株具有一定的致病性。但维氏气单胞菌对鳜鱼的具体致病机理和传播途径仍有待进一步研究。
