当归挥发油对痛性糖尿病周围神经病变大鼠钙通道蛋白表达的影响
2022-03-24王雨薇陈国廉牛慧琴车永贵陈光艳
王雨薇,陈国廉,普 彬,牛慧琴,车永贵,陈光艳
(甘肃省人民医院,甘肃 兰州 730030)
痛性糖尿病周围神经病变(painful diabetic peripheral neuropathy,PDPN)在糖尿病患者中的发病率为10%~20%[1]。PDPN 以自发性疼痛、痛觉过敏、痛觉超敏和一定程度感觉缺失为特征,症状多为四肢末端的灼烧样或针刺样疼痛,夜间加重,强度异常剧烈,对标准化镇痛治疗效果差,是糖尿病并发症治疗领域的重要难题,严重影响患者的生活质量[2]。目前研究表明,PDPN发病机制与Ca2+稳态失调相关[3],在 STZ 诱导的糖尿病大鼠模型的神经细胞中,T型和N型Ca2+通道的基因表达水平增高,神经损伤后的早期使用Cav3.2通道阻断剂,可以阻断神经病理性疼痛由急性期向慢性期的转变,有效阻止神经病理性疼痛的发生[4]。本研究观察了当归挥发油对PDPN大鼠L4~5背根神经节细胞T型及N型钙离子通道Cav3.1、Cav3.2、Cav2.2蛋白表达的影响,探讨其是否能够改善PDPN大鼠L4~5背根神经节细胞钙离子超载,从而抑制PDPN的发生和进展。
1 实验材料与方法
1.1实验动物 成年雄性SPF级Wistar大鼠50只,体重200~250 g,购自常州卡文斯实验有限公司,许可证号:SYXK(闽)2018-0008。所有操作及动物处理均严格遵循相关动物保护及使用规定。
1.2主要仪器 低温高速离心机,Eppenedorf(Centrifuge 5418 R);电泳仪、电泳槽,Tanon(EPS-300);小型垂直电泳槽,Bio-rad(1658001);转印槽,Bio-rad(170-3930);脱色摇床,Aohua(TY-80B);暗匣,Servicebio(WGA0017);暗室专用红灯,Servicebio(WGA0016);柯达胶片,Servicebio(WGJP0001);倒置显微镜,Leica(DMi3000 B);Von Frey纤维丝,上海玉研(Aesthesio);石蜡切片机,Leica (RM2245);摊片机,Leica (TPJ-438);恒温烘箱,上海恒一科学仪器有限公司(DHG-9030);显微镜,Olympus(BX53);数码相机,Olympus(SC180)。
1.3主要药物及试剂 当归挥发油(南京草本源生物科技有限公司,批号: 2019032415);RIPA裂解液,Beyotime(P0013B);PMSF (100 mmol/L),Beyotime(ST506);BCA蛋白浓度测定试剂盒,Beyotime(P0010S);显影定影试剂,Servicebio(G2019);ECL,Servicebio(G2014);预染蛋白Marker,Beyotime(P0066);PBS,Beyotime(C0221A);PVDF膜,Beyotime(FFP24);TBSTx (10X),Beyotime(ST677-100 mL);10% SDS,Beyotime(ST628);SDS-PAGE蛋白上样缓冲液,Beyotime(P0015A);丙烯酰胺,sigma(HC2040);过硫酸铵,sigma(17874);TEMED,sigma(17919);脱脂奶粉,Beyotime(P0216-300 g);Tris-HCl,pH8.8,Beyotime(ST789-100 mL);Tris-HCl,pH6.8,Beyotime(ST768-100 mL);Cav3.1 Antibody(兔多克隆抗体),Abcam(ab134269);Cav3.2 Antibody(兔多克隆抗体);Affinity(DF4615)。
1.4实验方法 取雄性Wistar大鼠10只作为正常组,其余大鼠用于糖尿病造模。造模方法:大鼠夜间禁食,然后单次腹腔注射烟酰胺50 mg/kg,间隔15 min后腹腔注射链脲佐菌素52.5 mg/kg。链脲佐菌素注射后,所有大鼠用5%葡萄糖溶液代替自来水饮用24 h,以降低低血糖休克相关死亡的风险。链脲佐菌素注射2 d后,从每只大鼠的尾静脉取血测量血糖水平,血糖超过200 mg/dL的大鼠被认为患有糖尿病。将造模成功的大鼠随机分为模型组和当归挥发油高、中、低剂量组,每组10只。当归挥发油高剂量组给予10%当归油15 mL/(kg·d)灌胃[按照1%吐温80与当归挥发油2∶1的比例加蒸馏水配成,等效剂量约等于60 kg成人每日当归用量(30 g)的10倍],当归挥发油中剂量组给予5%当归油15 mL/(kg·d)灌胃[按照1%吐温80与当归挥发油2∶1的比例加蒸馏水配成,等效剂量约等于60 kg成人每日当归用量(30 g)的5倍],当归挥发油低剂量组给予 2.5%当归油15 mL/(kg·d)灌胃[按照1%吐温80与当归挥发油2∶1的比例加蒸馏水,等效剂量约等于60 kg成人每日当归用量(30 g)的2.5倍],模型组和正常组灌胃等容量生理盐水,均1次/d,连续灌胃8周。整个实验期间,各组大鼠给予SPF级饲料喂养,自由进食和水。
1.5检测指标与方法
1.5.1体重和血糖 分别于造模成功后灌胃前及灌胃4周、8周用天平称量各组大鼠体重,血糖仪检测尾静脉空腹血糖水平。
1.5.2双后足机械痛阈 分别于造模成功后灌胃前及灌胃4周、8周检测各组大鼠双后足机械痛阈:将大鼠置于20 cm×20 cm金属笼中适应环境30 min,用重量为0.099 g的Von Frey纤维丝刺激大鼠后爪的足掌中心部位,逐渐增加压力,当大鼠出现后足迅速缩回、抬起、快速甩足、甩足后舔足、嘶叫等反应时计为阳性,记录此时刺激力度。左右后足轮流测试,每次间隔10 min,计算3次测试的平均值。
1.5.3L4~5背根神经节中Cav3.2表达情况 随机取造模成功后灌胃前及灌胃4周各组3只大鼠和灌胃8周末剩余大鼠的L4~5背根神经节组织,置于4%甲醛固定24 h。洗涤、脱水,透明、浸蜡、包埋、切片、烤片和脱蜡,37 ℃下5%BSA封闭60 min。倾去多余血清,滴加以1∶100稀释的Cav3.2抗体,4 ℃下封闭过夜。PBS冲洗,5 min,3次。加1∶1 000稀释荧光二抗cy3和DAPI混合液,避光室温孵育60 min。PBS冲洗,5 min,3次。防淬灭封片剂封片,4 ℃下避光保存。显微镜拍照观察。
1.5.4L4~5背根神经节中Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达情况 随机取造模成功后灌胃前及灌胃4周各组3只大鼠和灌胃8周末剩余大鼠的L4~5背根神经节,按照Western blot法处理检测:组织块用PBS洗涤2~3次,每60 mg组织加入200 μL裂解液,震荡、离心,收集裂解液上清、计算各标准品和待测蛋白质样品在562 nm 处的吸光值,根据标准曲线的计算公式算出样品浓度、SDS-PAGE凝胶电泳,参照预染Marker的位置,待目的条带进入凝胶最佳分离区(大约凝胶的2/3)时,停止电泳。PVDF膜无水甲醇浸泡3~5 min,水和电转液依次漂洗2 min,2次;参考目的条带分子量大小将转好的膜对照Marker进行裁剪,PVDF膜置于封闭液中,室温下封闭1 h;将Cav3.1用封闭液稀释1 μg/mL,Cav3.2和Cav2.2用封闭液按1∶1 000的比例稀释,Cav3.3用封闭液按1∶200的比例稀释,内参一抗用封闭液按1∶10 000的比例稀释;封闭后的膜分别加入对应的一抗工作液中,4 ℃摇动过夜;将PVDF膜重复洗涤3次;将二抗用1×TBST稀释2 000倍,将洗涤后的PVDF膜放入二抗工作液中,室温、避光缓慢摇动60 min,用1×TBST洗膜3次,洗去游离二抗。取ECL化学发光显色液A液和B液等量混合,冲洗PVDF膜3~5 min,然后用保鲜膜包裹好。在暗室中使用胶片曝光,胶片先置于显影液中2 min,用清水冲洗后再置于定影液中。最后冲洗胶片,烘干后保存。将胶片进行扫描存档,用蛋白条带灰度值与内参蛋白条带灰度值的比值表示蛋白表达量。
2 结 果
2.1各组大鼠体重和血糖 造模成功灌胃前,模型组及当归挥发油各组大鼠体重均明显低于正常组(P均<0.05);灌胃4周、8周后,模型组及当归挥发油各组大鼠体重仍明显低于正常组(P均<0.05),但当归挥发油各组大鼠体重均明显高于模型组(P均<0.05),且当归挥发油高剂量组明显高于当归挥发油低、中剂量组(P均<0.05),当归挥发油中剂量组明显高于当归挥发油低剂量组(P<0.05)。造模成功灌胃前,模型组及当归挥发油各组大鼠空腹血糖均明显高于正常组(P均<0.05);灌胃4周、8周后,模型组及当归挥发油各组大鼠空腹血糖仍明显高于正常组(P均<0.05),但当归挥发油各组大鼠空腹血糖均明显低于模型组(P均<0.05),且当归挥发油高剂量组明显低于当归挥发油低、中剂量组(P均<0.05),当归挥发油中剂量组明显低于当归挥发油低剂量组(P<0.05)。见图1。

图1 正常组和痛性糖尿病周围神经病变各组大鼠造模成功灌胃前及灌胃4周、8周后体重及血糖
2.2各组大鼠双后足机械痛阈 造模成功灌胃前,模型组及当归挥发油各组大鼠双后足机械痛阈值均明显高于正常组(P均<0.05);灌胃4周、8周后,模型组及当归挥发油各组大鼠双后足机械痛阈值仍明显高于正常组(P均<0.05),但当归挥发油各组大鼠双后足机械痛阈值均明显低于模型组(P均<0.05),且当归挥发油高剂量组明显低于当归挥发油低、中剂量组(P均<0.05),当归挥发油中剂量组明显低于当归挥发油低剂量组(P<0.05)。见图2。
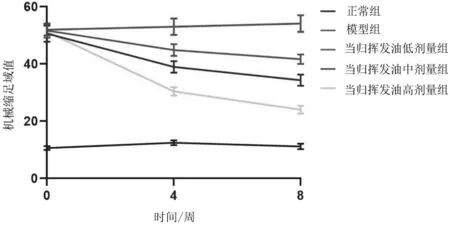
图2 正常组和痛性糖尿病周围神经病变各组大鼠造模成功灌胃前及灌胃4周、8周后双后足机械痛阈
2.3各组大鼠L4~5背根神经节中Cav3.2表达情况造模成功灌胃前与正常组比较,模型组及当归挥发油各组大鼠L4~5背根神经节中Cav3.2阳性表达荧光强度明显增强;灌胃4周、8周后与模型组比较,当归挥发油各组大鼠Cav3.2阳性表达荧光强度减弱,且当归挥发油低、中、高剂量组呈剂量依赖性减弱。见图3~5。

图3 正常组和痛性糖尿病周围神经病变各组大鼠造模成功后灌胃前L4~5背根神经节中Cav3.2表达情况(免疫荧光染色,×400)

图4 正常组和痛性糖尿病周围神经病变各组大鼠灌胃4周后L4~5背根神经节中Cav3.2表达情况(免疫荧光染色,×400)

图5 正常组和痛性糖尿病周围神经病变各组大鼠灌胃8周后L4~5背极神经节中Cav3.2表达情况(免疫荧光染色,×400)
2.4各组大鼠L4~5背根神经节中Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达情况 造模成功灌胃前,模型组及当归挥发油各组大鼠Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达量均明显高于正常组(P均<0.05);灌胃4周、8周后,模型组大鼠Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达量仍明显高于正常组(P均<0.05);灌胃4周后,当归挥发油低剂量组大鼠Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达量与模型组比较差异均无统计学意义(P均>0.05),当归挥发油中、高剂量组均明显低于模型组(P均<0.05),且当归挥发油高剂量组均明显低于当归挥发油中剂量组(P均<0.05);灌胃8周后,当归挥发油各剂量组大鼠Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达量均明显低于模型组(P均<0.05),且当归挥发油高剂量组明显低于当归挥发油低、中剂量组(P均<0.05),当归挥发油中剂量组明显低于当归挥发油低剂量组(P<0.05)。见图6~8。

图6 正常组和痛性糖尿病周围神经病变各组大鼠造模成功后灌胃前L4~5背根神经节中Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达情况

图7 正常组和痛性糖尿病周围神经病变各组大鼠灌胃4周后L4~5背根神经节中Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达情况

图8 正常组和痛性糖尿病周围神经病变各组大鼠灌胃8周后L4~5背根神经节中Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达情况
3 讨 论
中医根据PDPN的症状特点,认为其属于“痛证”“血痹”“痿证”等范畴[5]。其发病多由久食肥甘、情志不畅等导致脏腑功能受损,日久脾气不能散精,气血阴阳皆有不足,气血亏虚,津枯血滞,生痰成瘀,痰浊瘀血痹阻脉络,经络不通则“痛”,肌肤不荣则“麻”,阴阳俱损,阳虚不能温煦气化,血行不畅,血得寒则凝,形成络脉瘀血,营卫不能周流,肢体脉络、筋骨、皮肤失于濡养则“痹”之症成矣。当归挥发油是从当归中提取的有效成分,基于“血中气药”的理论,当归挥发油为当归中“轻者”,“轻者”能行气,气又能行血,因此可治疗“血瘀”所致的疾病[6]。
神经细胞钙稳态失调是导致缺血性神经元发生不可逆损伤的关键步骤[7],神经细胞钙超载是细胞凋亡的最后共同通路[8-11]。导致细胞内Ca2+升高的原因是胞外Ca2+内流和胞质Ca2+库释放,前者为Ca2+通过开放的细胞膜钙通道进入细胞质。在外源性Ca2+内流中,电压门控钙通道是Ca2+进入细胞的主要方式[12]。
有研究证实,T型Ca2+通道调节伤害感受器的亚阈值兴奋性,且这种电流在实验性糖尿病周围神经病变大鼠的伤害感受器中增加[3]。在链脲佐菌素诱导的糖尿病大鼠模型中,神经元和神经胶质细胞均经历代谢应激和线粒体功能障碍,其导致Ca2+稳态失调,线粒体内的Ca2+缓冲受损,内质网应激导致的Ca2+积聚和Ca2+信号传导失调,进而促进PDPN的发展[4],使用特异性受体阻断Cav3.2表达通道的功能可以抑制痛觉过敏,T型钙离子通道的下调可以减轻痛觉超敏反应[4,13-15]。
本实验结果显示,高血糖可致大鼠双后足机械痛阈升高,细胞内钙离子增多,Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达量显著升高;不同剂量的当归挥发油干预可以降低大鼠的双后足机械痛阈值,减弱Cav3.2表达荧光强度,下调Cav3.1、Cav3.2、Cav3.3、Cav2.2蛋白表达,高剂量当归挥发油效果最为显著。证实当归挥发油可以有效降低N型及T型钙离子通道蛋白Cav3.1、Cav3.2、Cav3.3、Cav2.2的表达,通过Ca2+通道的下调,起到钙阻滞作用,改善PDPN大鼠痛觉超敏反应,从而抑制PDPN的进展,说明当归挥发油具有T型钙离子通道靶向治疗作用,为中西医结合治疗PDPN提供了基础理论依据及新思路。
利益冲突:所有作者均声明不存在利益冲突。
