基于β-catenin通路研究富血小板纤维蛋白复合β-磷酸三钙对小鼠成骨细胞成骨分化的影响
2022-03-24付冬梅李素兰
付冬梅,周 婧,王 浪,罗 阳,兰 红,李素兰,王 劲
(资阳市雁江区人民医院口腔科,四川 资阳 641300)
创伤、炎症和手术过程导致的骨缺损给功能性牙槽骨的美学重建带来了很大的困难,促进牙槽骨的再生已成为当前研究的热点[1]。成骨细胞作为牙槽骨组织工程的重要组成部分,被广泛用于新骨的再生和骨缺损的修复。组织工程(Tissue engi‐neering,TE)是现代再生医学的概念之一,这种多学科的方法,将医学、生物学、材料学联系起来。在TE 中,支架作为支持材料,可以植入细胞或其他补充因子,在体外制备,用作受损组织再生的植入物[2]。β-磷酸三钙作为支架材料,不仅可以释放大量钙离子促进新骨生成,还具有良好的生物相容性和生物安全性,其已在骨科领域广泛用作骨替代物[3]。此外有研究表明,血小板纤维蛋白(Plateletrich fibrin,PRF)中富含多种生长因子,对成骨细胞的增殖、分化具有促进作用[4],然而PRF 作为补充因子加入β-磷酸三钙支架材料后,是否对成骨细胞的增殖分化具有更好的促进作用尚不清楚。因此,本实验拟先探究不同浓度PRF 对成骨细胞MC3T3-E1增殖、分化的影响,根据结果,选出最佳浓度的PRF,然后基于β-catenin 通路探究最优浓度PRF 复合β-磷酸三钙对成骨细胞成骨分化的影响。
1 材料与方法
1.1 材料 小鼠成骨细胞株MC3T3-E1 购自中科院上海细胞库,碱性磷酸酶(ALP)ELISA 试剂盒购自中国碧云天生物技术有限公司,骨钙素(OC)、Ⅰ型胶原蛋白(COL-1)ELISA 试剂盒均购自武汉菲恩生 物 科 技 有 限 公 司,β-catenin、LEF-1、RunX2、Osterix 抗体购自Abcam 公司(美国),OPN 抗体购自普健生物(武汉)科技有限公司,茜素红购自北京索莱宝科技有限公司,α-MEM 培养基购自浙江吉诺生物医药技术有限公司,β-磷酸三钙材料购自中国上海贝奥路公司,倒置显微镜(Olympus,日本),MK3酶标仪(Thermo,美国),EVOS FL AUTO 显微照相系统(Thermo,美国)。
1.2 方法
1.2.1 PRF 制备 体重400~500 g 的健康雄性SD大鼠,用10%水合氯醛(0.3 mL·100 g-1体重)麻醉,无菌条件下,于腹主动脉取血10 mL 置于无添加抗凝剂的真空离心管中,立即置于离心机离心(400 g,12 min)。离心后可见血液分3 层:由下到上分别为红细胞层、PRF 凝块及无细胞血浆。在超净工作台中,将PRF 凝块放入无菌离心管中,-80 ℃冷冻1 h,4 ℃解冻后离心(230 g,10 min),得到PRF 提取物,随后,在离心管中加入5 mL α-MEM 培养液(含双抗),连同PRF 提取物放入6 孔板中,37 ℃孵育24 h后离心(3 000 r·min-1,5 min),取上清,用0.22 µm滤器过滤,加入10%FBS 得到PRF。将正常培养基分别稀释PRF为50%、40%、30%、20%、10%浓度。
1.2.2 CCK-8 检测细胞增殖 将对数生长期的MC3T3-E1 细胞接种于96 孔板,密度为3×104个/mL,每孔100µL,设1个对照组和5个实验组,分别为:对照组、10%PRF 组、20%PRF 组、30%PRF 组、40%PRF组和50%PRF 组,对照组用不含PRF 的α-MEM 培养基,各实验组选用含对应浓度PRF 的α-MEM 培养基,置于细胞培养箱中37 ℃、5% CO2条件下培养48 h。按照CCK-8 试剂盒说明书检测细胞增殖,每孔加入100µL CCK-8混合液在37 ℃下孵育2 h,用酶标仪于450 nm 波长测定吸光度值。细胞增殖比例=实验组吸光度值/对照组吸光度值的平均值×100%。
1.2.3 划痕实验检测细胞迁移能力 取对数生长期的MC3T3-E1 细胞以2×105/孔的密度接种于6 孔板,待细胞单层融合时,用无菌的200µL枪头在细胞层垂直划痕,然后用PBS 冲洗将划痕区域的残留细胞去除。然后加入含不同浓度PRF 的α-MEM 培养基,37 ℃、5%CO2条件下培养24 h。在0 h和24 h,将不同实验分组的细胞于成像系统显微镜下照相记录,迁移率=(初始划痕距离-现划痕距离)/初始划痕距离×100%。
1.2.4 茜素红染色观察钙结节 将对数生长期细胞以1×105个·mL-1的浓度于12 孔板中制作细胞爬片。细胞爬片后,更换含有不同浓度PRF 的培养基继续培养细胞(分组和CCK-8检测相同),每2 d换液一次,培养14 d 后进行茜素红染色。茜素红染色步骤为:PBS轻柔清洗3次爬片,多聚甲醛固定10 min,1%茜素红37 ℃下染色30 min,超纯水清洗,倒置相差显微镜观察,橘红色表明钙盐沉积。设1 个对照组和5 个实验组,分别为:对照组、10%PRF 组、20%PRF 组、30%PRF 组、40%PRF 组和50%PRF 组。对照组用不含PRF的α-MEM培养基,各实验组选用含对应浓度PRF的α-MEM培养基,置于细胞培养箱中37 ℃、5%CO2条件下培养48 h。
1.2.5 WB 将对数生长期细胞浓度调整为2×107·mL-1,将细胞悬液缓慢滴加于β-磷酸三钙(3 mL/长方体),培养4 h 使细胞和支架空隙表面充分黏附。将细胞支架复合物分为两组,第1 组:使用无PRF 培养液;第2 组:细胞支架复合物置于含有50%的PRF 培养液中。之后每隔1 d 更换1 次培养液。于第1 d、3 d、7 d 裂解细胞进行WB 检测。WB 步骤采用常规检测步骤,包括:提取细胞的总蛋白并测量蛋白含量。经电泳、转膜、封闭、清洗后,依次加入β-catenin、LEF-1、RunX2、Osterix、OPN 一抗(1∶500)孵育过夜后,添加二抗(1∶5 000)继续孵育2 h,曝光显影,以β-actin为内参分析蛋白表达水平。
1.2.6 ELISA 将对数生长期细胞浓度调整为2×107·mL-1,将细胞悬液缓慢滴加于β-磷酸三钙(3 mL/长方体),培养4 h 使细胞和支架空隙表面充分黏附。将细胞支架复合物分为两组,第1 组:使用无PRF 培养液;第2 组:细胞支架复合物置于含有50%的PRF 培养液中。之后每隔1 d 更换1 次培养液。于第1 d、3 d、7 d弃去培养液,每孔加入200µL 细胞裂解液,4 ℃过夜,充分裂解后,离心取上清,按照骨钙素(OC)、Ⅰ型胶原蛋白(COL-1)ELISA 试剂盒说明书进行操作,酶标仪测定450 nm 处的OD 值,按公式计算出OC、COL-1的活性。
1.2.7 验证实验 本实验分为4 组,分别为:对照组、β-catenin 抑制剂组、β-磷酸三钙+50%PRF 组和β-磷酸三钙+50%PRF+β-catenin 抑制剂组。将对数生长期细胞浓度调整为2×107·mL-1,每组加入1 mL细胞悬液。对照组和β-catenin 抑制剂组没有β-磷酸三钙,β-磷酸三钙+50%PRF 组和β-磷酸三钙+50%PRF+β-catenin 抑制剂组包含β-磷酸三钙。β-catenin抑制剂组和β-磷酸三钙+50%PRF+β-catenin抑制剂组在含有XAV-939(浓度2µmol·L-1)的培养液中培养3 d 后,弃去培养液,消化、离心得到细胞。通过ELISA 检测细胞ALP 活性,通过WB 检测成骨细胞β-catenin、LEF-1、RunX2、Osterix和OPN的蛋白表达。
1.3 统计学方法 使用SPSS 13.0 统计软件和GraphPAD 8.0 分析软件进行分析,多样本间比较采用单因素方差分析(One-way ANOVA),两两比较采用t检验,重复测量数据选择多变量方差分析方法MANOVA,P<0.05为差异有统计学意义。
2 结 果
2.1 CCK8 检测不同浓度PRF 对成骨细胞增殖的影响 与对照组相比,10%PRF 组、20%PRF 组、30%PRF 组、40%PRF 组和50%PRF 组都显著促进成骨细胞增殖,且PRF 浓度越高,促进成骨细胞增殖的作用越好,其中50%PRF 表现出了最好的促进成骨细胞增殖的作用。见图1。
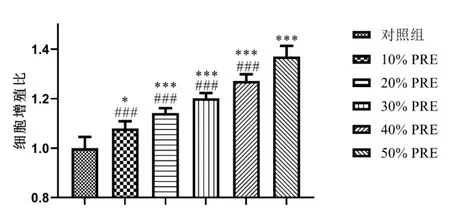
图1 CCK-8检测不同浓度PRF对成骨细胞增殖的影响/n=3
2.2 划痕实验观察不同浓度PRF 对成骨细胞迁移能力的影响 与对照组相比,10%PRF 组、20%PRF组、30%PRF 组、40%PRF 组和50%PRF 组都显著促进了成骨细胞迁移,且PRF 浓度越高,促进成骨细胞迁移能力越强,50%PRF 表现出了最好的促进成骨细胞迁移的能力。见图2。
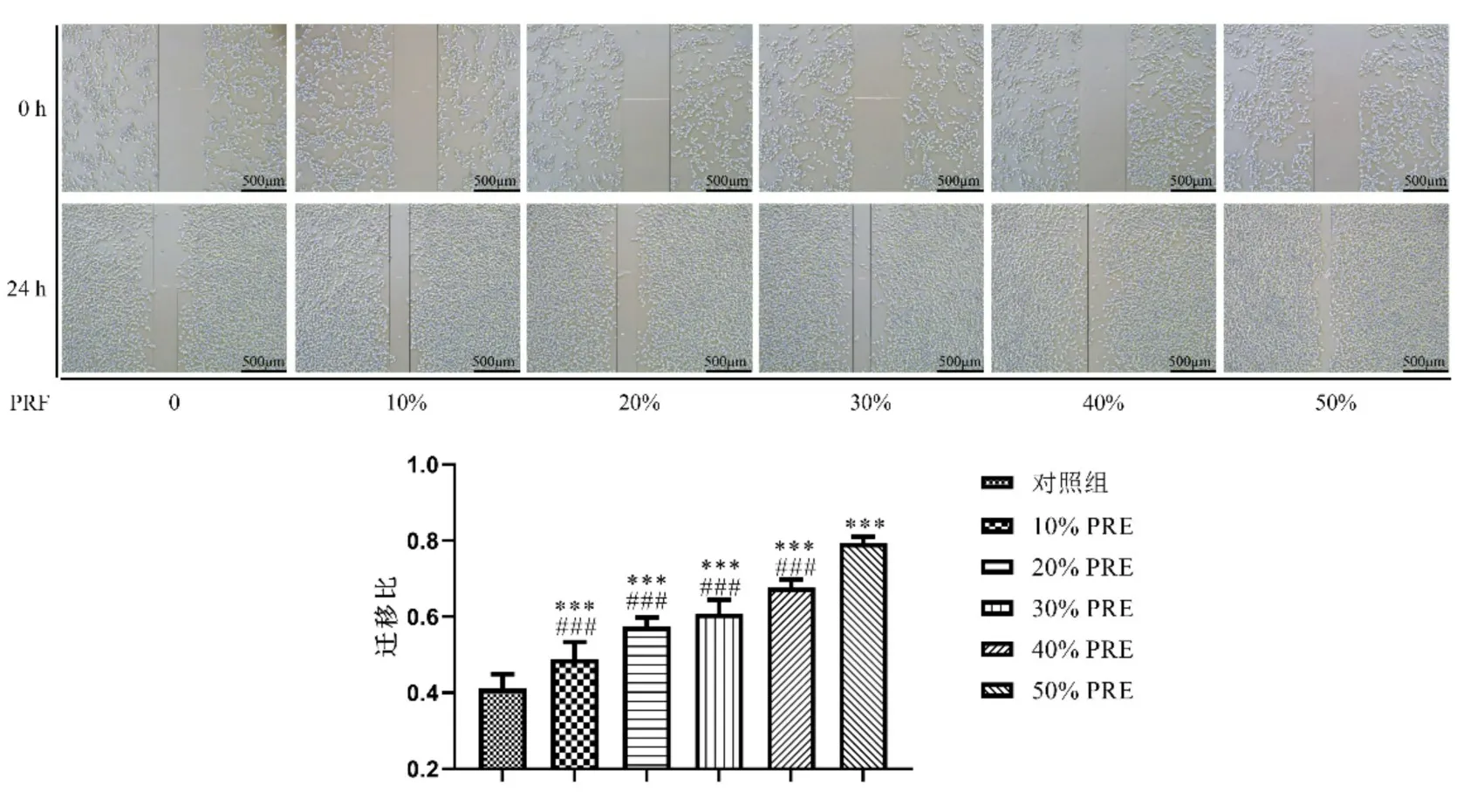
图2 划痕实验检测不同浓度PRF对成骨细胞迁移的影响/n=3
2.3 ELISA 检测不同浓度的PRF 对成骨细胞中ALP 活性的影响 ELISA 结果表明,10%PRF 组、20%PRF 组、30%PRF 组、40%PRF 组和50%PRF 组都显著促进了成骨细胞ALP酶活性,PRF浓度越高,成骨细胞ALP 酶活性越强,其中50%PRF 对成骨细胞ALP酶活性促进作用最好。见图3。
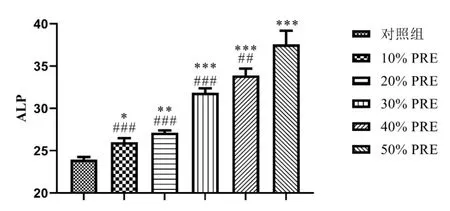
图3 ELISA检测不同浓度PRF对成骨细胞ALP酶活性的影响/n=3
2.4 茜素红染色观察不同浓度PRF 对成骨细胞钙结节形成的影响 对照组可见少量红染,与对照组相比,10%PRF 组、20%PRF 组、30%PRF 组、40%PRF组和50%PRF 组红染面积逐渐增加,此外,从20%PRF 开始出现明显成团的钙化结节,钙化结节数量随着PRF浓度增加而增加。见图4。

图4 茜素红染色观察不同浓度的PRF对成骨细胞钙结节形成的影响/n=3
2.5 ELISA 检测PRF 对β-磷酸三钙支架物中成骨细胞OC 和COL-1 活性的影响 在之前的实验中,50%PRF 表现出最高的促成骨细胞分化及增殖能力,因此在后续实验中我们采用50%PRF 作用于β-磷酸三钙支架物中成骨细胞,分析PRF 和β-磷酸三钙联用对成骨细胞分化的影响。
ELISA 结果表明,与β-磷酸三钙对照组相比,β-磷酸三钙+50%PRF 组在第3 d 和7 d 显著提高了β-磷酸三钙支架物中成骨细胞的OC 和COL-1 活性。见图5。
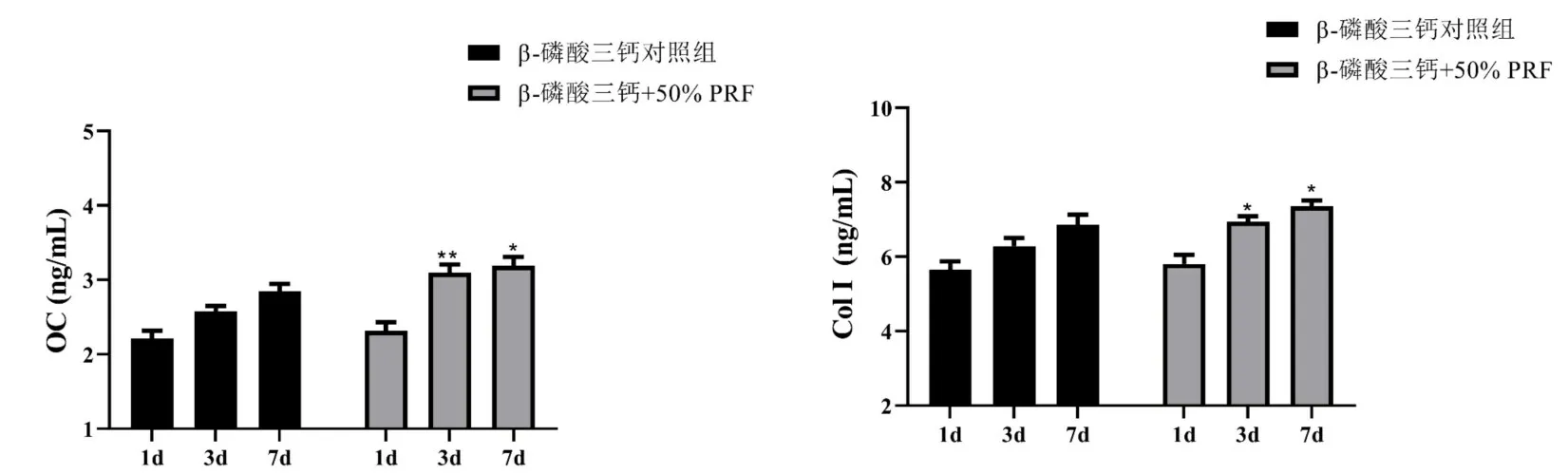
图5 ELISA检测PRF对β-磷酸三钙支架物中成骨细胞OC和COL-1活性的影响/n=3
2.6 WB 检测PRF 对β-磷酸三钙支架物中成骨细胞成骨分化标志物的影响 与β-磷酸三钙对照组相比,β-磷酸三钙+50%PRF 组在第1 d、3 d 和7 d 显著提高了成骨细胞β-catenin、LEF-1、RunX2、Osterix和OPN的蛋白含量。见图6。
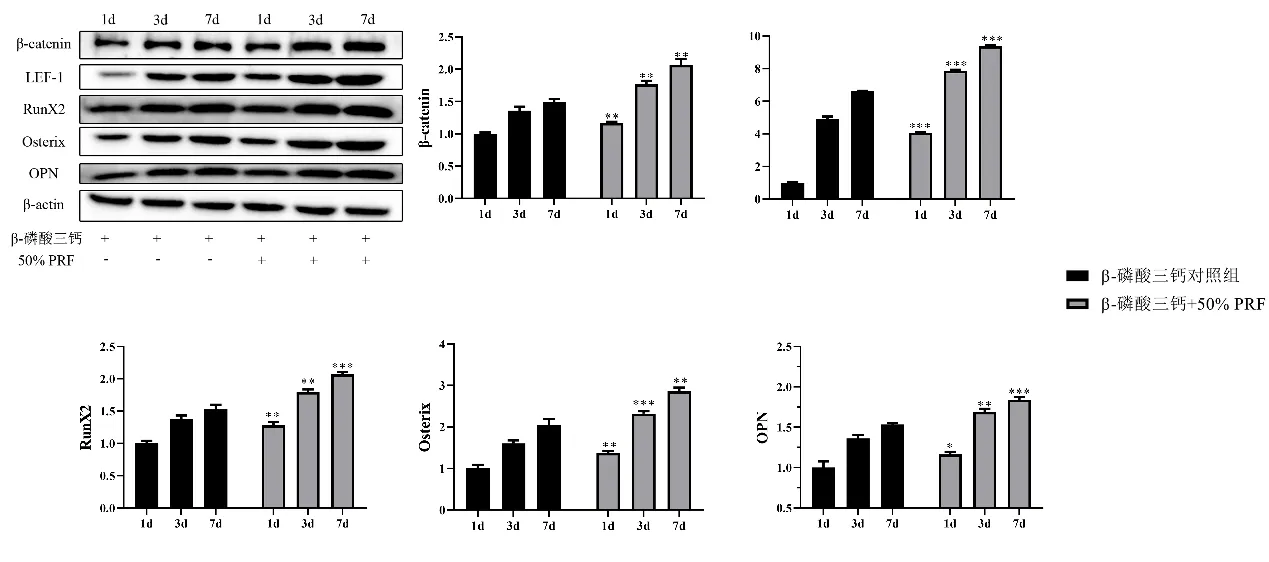
图6 WB检测PRF对β-磷酸三钙支架物中成骨细胞成骨分化标志物的影响/n=3
2.7 抑制β-catenin通路对β-磷酸三钙支架物中成骨细胞活性及分化的影响 ELISA 结果所示:与对照组相比,β-catenin 抑制剂降低了正常成骨细胞ALP 的表达;与β-磷酸三钙+50%PRF 组相比,β-catenin 抑制剂降低了PRF 复合β-磷酸三钙处理的成骨细胞ALP 的表达。见图7A。WB 结果所示,与对照组相比,β-catenin 抑制剂降低了正常成骨细胞β-catenin、LEF-1、RunX2、Osterix和OPN的蛋白表达;同样,与β-磷酸三钙+50%PRF 组相比,β-catenin抑制剂降低了PRF 复合β-磷酸三钙处理的成骨细胞β-catenin、LEF-1、RunX2、Osterix和OPN的蛋白表达。见图7B。
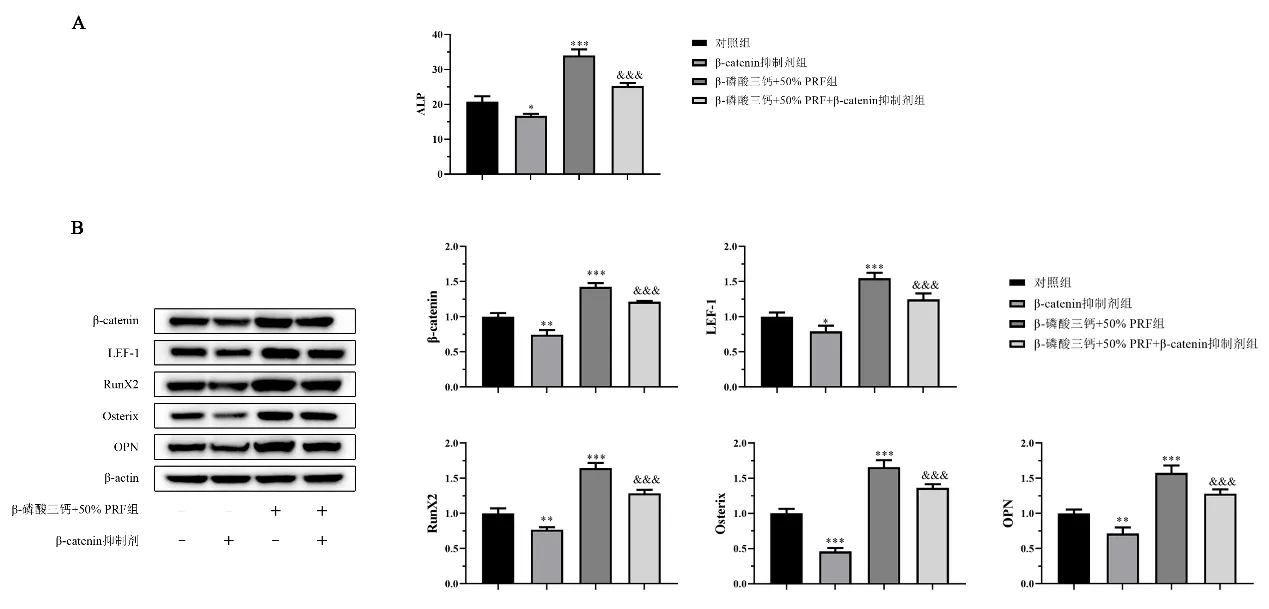
图7 抑制β-catenin通路对成骨细胞成骨分化标志物的影响/n=3
3 讨 论
骨量不足是现今义齿种植需要解决的难点。β-磷酸三钙作为骨再生支架材料已被广泛研究并证实[1,5],PRF 也被证明能够促进成骨细胞增殖分化[4,6],然而PRF 对成骨细胞在β-磷酸三钙支架上增殖分化的影响尚不清楚。我们研究表明PRF 能促进复合β-磷酸三钙的成骨细胞增殖分化,为临床上PRF 和β-磷酸三钙联用提供数据支持。
临床上PRF 一般通过自体血离心形成,具有安全高效、无排异等优点。韩晓谦等[4]研究表明PRF能促进MC3T3-E1 成骨细胞增殖,并提高了成骨细胞ALP 活性。ALP 是成骨细胞早期分化的标志[7],提示PRF 促进了成骨细胞的分化。我们研究表明,10%~50%浓度的PRF 均促进了MC3T3-E1 成骨细胞的增殖能力和迁移能力,并提高了成骨细胞ALP活性,PRF 浓度越高,对MC3T3-E1 成骨细胞增殖和迁移促进作用越强,提高ALP 活性越明显;此外,茜素红染色表明PRF 浓度越高,钙化结节的数量越多。这些数据表明,PRF 能够有效促进MC3T3-E1成骨细胞增殖分化,浓度越高,效果越好,在本试验中50%PRF的效果最好。
β-磷酸三钙与人体骨骼的无机成分相似,具有良好的生物相容性和降解性,其轻度溶解所释放的钙离子和溶解所形成的微碱性环境可有效促进成骨细胞黏附、增殖及分泌基质,促进骨生成[8]。OC和COL-1 是骨形成生物标志物[9-11],骨形成、代谢和再生受COL-1和OC基因的调控,这些基因与钙的有效性有直接关系[11]。我们研究表明,在第3 d 和第7 d PRF 能促进成骨细胞在β-磷酸三钙支架上OC和COL-1 的分泌,表明PRF 促进成骨细胞在β-磷酸三钙支架上的骨生成。
转录因子如β-catenin、Runx2 和Osterix 是成骨细胞分化所必需的[12],OPN 是成骨的重要调控因子[13]。有研究表明β-catenin 通路是调控成骨分化活动的重要途径[14]。β-catenin 转运到细胞核内,可激活与成骨分化相关的基因,如Runx2[15]。LEF-1是β-catenin的下游转录分子[16],LEF-1与β-catenin的相互作用将β-catenin 导入细胞核[17],然后β-catenin与LEF/TCF 形成转录复合物,从而诱导下游基因表达[18]。β-catenin、LEF-1、RunX2、Osterix 和OPN 是成骨分化相关的标志物。进一步我们检测了β-catenin、LEF-1、RunX2、Osterix 和OPN 的蛋白表达,研究发现,与单独使用β-磷酸三钙支架相比,在第1 d、第3 d和第7 d PRF与β-磷酸三钙联用显著促进β-catenin、LEF-1、RunX2、Osterix和OPN的蛋白表达,表明血小板纤维蛋白与β-磷酸三钙联用通过活化β-catenin通路,上调成骨调控因子RunX2、Osterix和OPN的蛋白表达,促进了骨生成。最后,通过使用β-catenin抑制剂表明抑制β-catenin 通路可以降低成骨细胞活性和阻止成骨分化。
本研究在体外证明,与单独使用β-磷酸三钙相比,PRF 复合β-磷酸三钙通过促进β-catenin 通路显著提高小鼠成骨细胞分化效果,但PRF 复合β-磷酸三钙在体内对成骨细胞分化的效果并不清楚,因此,针对PRF 复合β-磷酸三钙对成骨细胞分化的影响仍需要进一步研究。
