钙离子抑制系膜细胞中转化生长因子β1诱导的自噬和胞外基质蛋白表达
2022-03-24张嘉文李加林吴素珍
张嘉文,李加林,张 蒙,吴素珍
(1. 赣南医学院2019级硕士研究生;2. 赣南医学院药学院;3. 赣南医学院心脑血管疾病防治教育部重点实验室;4. 赣南医学院2017级本科生物技术专业;5. 赣南医学院基础医学院,江西 赣州 341000)
转化生长因子β1(Transforming growth factor β1,TGF-β1)在高糖诱导的糖尿病肾病细胞模型和链脲佐菌素(Streptozotocin,STZ)诱导的糖尿病肾病动物模型中的表达均上调。在长期高糖和TGF-β1的刺激下,系膜细胞大量表达胞外基质蛋白并沉积在肾小球内会引起肾小球硬化,最终导致肾脏纤维化[1-3]。
钙敏感受体(Calcium-sensing receptor,CaSR)是G 蛋白偶联受体(GPCR)家族的成员,它不仅控制钙稳态,而且在细胞增殖、凋亡、分化、基因表达和心血管疾病等许多细胞过程中发挥关键作用[4]。目前,大约30%的获批药物针对GPCR,其中一些用于治疗糖尿病[5]。高糖诱导的新生大鼠原代心肌细胞中CaSR 表达下调,新生大鼠原代心肌细胞中的线粒体结构和功能也受到高糖损伤,CaSR 的激动剂NPS568 可上调CaSR 的表达,恢复新生大鼠原代心肌细胞线粒体结构和功能[6]。
细胞外Ca2+是第一个被证实通过激活CaSR 发挥作用的配体[7]。此外,多价阳离子如Mg2+、Gd3+、新霉素和精胺也是CaSR 的激动剂[8]。在前期发表的研究中,我们揭示了CaSR 的激动剂GdCl3可以改善TGF-β1诱导的系膜细胞(Mesangial cells,MCs)中胞外基质蛋白FN的表达。本研究将进一步揭示CaSR的配体CaCl2是否可以抑制MCs 中TGF-β1诱导的细胞外基质蛋白FN的表达。
自噬在慢性肾脏病中的功能仍存在争议。JIANG M等早在2010年就报道,抑制自噬会导致肾损伤并促进缺血再灌注诱导的肾小管细胞凋亡[9]。另一项研究也表明,UUO联合ATG5敲除(自噬受到抑制)小鼠肾间质纤维化加重[10],这些结果均表明促进自噬对肾功能损害有保护作用。相反,在某些情况下,抑制自噬反而发挥了器官保护作用。LIU X 等首次证明自噬在肾纤维化过程中被激活,通过G-Rb1 治疗抑制自噬可以减轻HK-2 细胞的肾纤维化[11]。YANG X 等研究也表明WISP-1 过表达可以加剧UUO小鼠模型中的自噬,然后增加肾纤维化,WISP-1可抑制UUO 小鼠的自噬进而减轻肾纤维化[12]。本文将探讨Ca2+是否对TGF-β1诱导的MCs 自噬有影响。
1 材料与方法
1.1 药品与试剂 胎牛血清(FBS)、DMEM培养基(美国Gibco公司);兔抗大鼠fibronectin(FN,1∶10 000,Merck Millipore,Chemicon),Smad2 and p-Smad2(1∶10 000,CST),β-actin(1∶1 000,CST)。辣根过氧化物酶(HRP)标记的二抗(武汉博士德公司);电化学发光(ECL)液(美国Thermo 公司);BCA 蛋白浓度测定试剂盒(美国Thermo 公司);其他化学试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养和处理 原代大鼠系膜细胞(MCs)在含有20%胎牛血清、100 U·mL-1青霉素和100 mg·mL-1链霉素的DMEM 培养基中于37 ℃、5%CO2细胞培养箱中培养。选择第8~16代之间的细胞用于实验。用4 mM CaCl2预处理MCs 30 min,然后用10 ng·mL-1人 重 组TGF- β1(R&D Systems,Minneapolis,U. S. A)共同作用24 h,最后通过蛋白质印迹方法检测目标蛋白的表达。
1.2.2 蛋白质提取和蛋白质印迹 用预冷的PBS洗涤MCs 两次,然后用RIPA 裂解液裂解,再用BCA蛋白质测定试剂盒测定蛋白质浓度。每个样品取30µg 总蛋白通过SDS-PAGE 分离,然后将蛋白质从凝胶转移到(PVDF)膜上,用5%脱脂牛奶封闭膜后,将膜与相应的一抗在4 ℃下孵育轻轻振摇过夜,将膜与相应的辣根过氧化物酶偶联的二抗在室温下孵育2 h。最后,将膜与增强的ECL发光液一起孵育,并用Bio-Rad Chemi-Doc MP 及成像系统检测信号。使用Image J软件量化条带的灰度值。
1.2.3 MTT 法检测细胞活力 在实验前一天,在96 孔板中接种细胞(105/孔),每个浓度设置3 个复孔,然后用不同浓度的氯化钙处理系膜细胞24 h。次日,在96孔板中加MTT溶液(5 mg·mL-1)孵育4 h,接下来用DMSO 去溶解紫色结晶,然后用酶标仪分别测570 nm 和690 nm 波长处的光吸收值。采用GraphPad Prism 6 软件计算不同浓度氯化钙处理的相对细胞活力,细胞活力值都以PBS 处理的对照组为参考进行计算。
1.3 统计学方法 采用SPSS 21.0 统计学软件对所得结果进行统计分析。各组数据以平均值±标准差表示,多组样本均数之间的总体比较采用单因素方差分析,组内各指标的多重比较采用SNK检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度氯化钙对系膜细胞活力的影响
CaCl2浓度为20~100 mM 时,细胞活力<0.5,6.4~4 mM 时,细胞活力接近1(图1A)。CaCl2处理细胞24 h 后,在光学显微镜下拍摄细胞照片,20~100 mM CaCl2处理的细胞形状似乎不规则,6.4~4 mM CaCl2处理的细胞形状则更规则(图1B)。

图1 不同浓度CaCl2对系膜细胞活力和形态的影响(×100)
2.2 TGF-β1对mTOR 和P70S6K 磷酸化的抑制作用被Ca2+逆转 与对照组比较,TGF-β1治疗组p-mTOR/mTOR 及p-p70S6K 表达下调;与TGF-β1治疗组比较,TGF-β1和Ca2+共处理组p-mTOR/mTOR 及p-p70S6K 表达上调,差异均有统计学意义(P<0.05)(图2)。
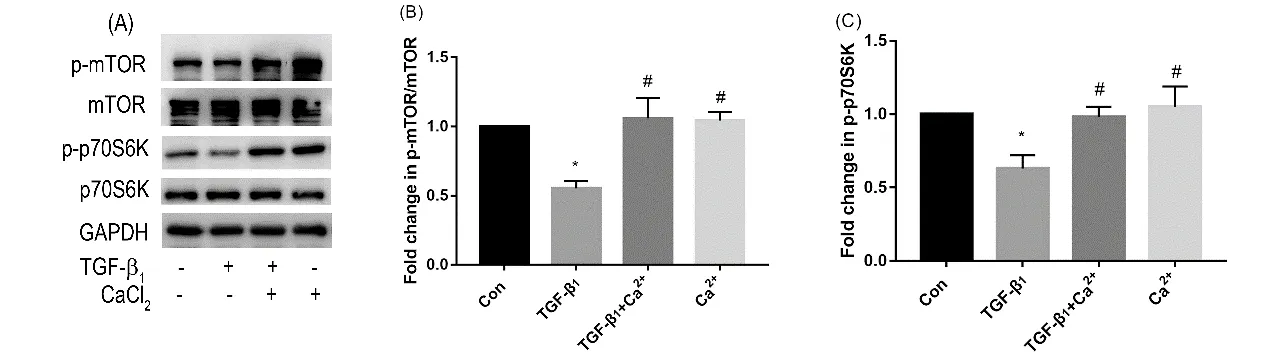
图2 CaCl2抑制TGF-β1诱导的自噬
2.3 Ca2+抑制TGF-β1诱导的Beclin-1 的表达上调和P62 的表达下调,抑制胞外基质蛋白FN 的表达
与对照组比较,TGF-β1治疗组Beclin-1、FN表达上调,P62 表达下调;与TGF-β1治疗组相比,TGF-β1和Ca2+共处理组Beclin-1、FN 表达下调,P62 表达上调(图3)。

图3 Ca2+抑制TGF-β1诱导的Beclin-1的表达上调和P62的表达下调,抑制TGF-β1诱导的FN表达
3 讨 论
CaSR 是G 蛋白偶联受体C 家族成员,其显著的作用是控制钙稳态,CaSR 还参与细胞增殖、分化和凋亡[13-14]。精胺是CaSR 的一种激动剂,在糖尿病、心肌病中发挥保护作用[15]。同样,Ca2+作为CaSR 的天然激动剂,Ca2+信号传导被证明参与了1型糖尿病和2 型糖尿病,且在慢性肾病中CaSR 的表达降低[16-18],Ca2+是否能够抑制系膜细胞中TGF-β 诱导的自噬还未见文献报道。
TGF-β 长期以来被认为是纤维化的驱动因素[13],有研究发现TGF-β 也能够影响自噬。自噬是一把双刃剑,在不同的实验条件下,自噬可能起到截然相反的作用。有很多研究表明,自噬是慢性肾脏病的保护因素;然而也有文献报道过度自噬会加重肾脏疾病,抑制过度自噬则发挥肾脏保护作用。还有研究发现TGF-β1在足够血清条件下可诱导原代系膜细胞自噬,抑制该自噬可抑制剥夺血清诱导的细胞凋亡[19],还有研究报道在UUO 小鼠模型和TGF-β1诱导的肾小管上皮细胞(TECs)中自噬是激活的,而抑制自噬可以减轻TGF-β1诱导的TECs 和UUO 小鼠模型中的肾纤维化[12],这一研究说明自噬是有害的。mTOR/p70S6K 信号通路对自噬具有负调控作用。而另有研究发现mTOR的抑制剂雷帕霉素可通过阻断mTOR/p70S6K 信号通路促进自噬来改善糖尿病大鼠的肾损伤[20],说明自噬具有保护作用。我们的研究发现,TGF-β1刺激系膜细胞可抑制mTOR/p70S6K的磷酸化和P62的表达,上调Beclin-1的表达,Ca2+和TGF-β1共同处理可以上调mTOR/p70S6K 的磷酸化和P62 的表达,同时降低Beclin-1的表达,并且抑制TGF-β1诱导的FN 表达。本实验结果支持前人研究提出的过度自噬会加重肾脏疾病,抑制过度自噬则发挥肾脏保护作用的论点。
综上所述,本研究发现,在没有剥夺血清的情况下,TGF-β1刺激系膜细胞24 h 可以诱导自噬,而这种自噬可以被钙离子抑制;同时还发现TGF-β1诱导的胞外基质蛋白FN 的表达也被钙离子抑制。由此,我们推断Ca2+可以改善系膜细胞中TGF-β1诱导的自噬和胞外基质蛋白表达。然而,Ca2+抑制TGF-β1诱导FN 的表达是否与其抑制TGF-β1诱导的自噬相关,将在后续研究中进一步探讨。
