盐酸雷洛昔芬固体脂质纳米粒的制备与体内药动学研究
2022-03-24龚麟凤
张 琪,龚麟凤
武汉市红十字会医院药剂科,武汉 430015
盐酸雷洛昔芬(raloxifene hydrochloride,RLX)是由美国礼来公司开发的第二代选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs),临床上用于预防和治疗绝经后的骨质疏松症,改善绝经后更年期症状,并有潜在的心血管保护作用[1-2]。然而,RLX属于生物药剂学分类系统(biopharmaceutics classification system, BCS)Ⅰ类药物,在水中几乎不溶解(为2 μg·mL-1),且具有极强的肝脏首过效应,口服生物利用度较低,小于2%[3-4]。为了提高RLX的溶解度,提高其生物利用度,研究人员已将其开发成多种新型给药系统,包括固体分散体[5]、脂质纳米粒[6]、介孔碳纳米颗粒[7]、自乳化释药系统[8]和环糊精包合物[9]等。固体脂质纳米粒(solid lipid nanoparticles, SLNs)是以生物相容性好的固态天然或合成的类脂为载体,将药物吸附或包裹于脂质中制成的新一代纳米粒给药系统,在提高难溶药物的溶解度和口服生物利用度方面得到广泛关注[10-11]。因此,本研究采用热熔乳化-高压均质法将盐酸雷洛昔芬制备成固体脂质纳米粒,并通过大鼠体内药动学评估药物的生物利用度,为提高盐酸雷洛昔芬的口服生物利用度提供一种有效的解决方案。
1 仪器与试药
1.1 仪器
HWCL-5型集热式恒温磁力搅拌器(郑州长城科工贸有限公司);SRH500-45高压均质机(ATS工业系统有限公司);TD5G台式过滤离心机(长沙湘锐离心机有限公司);Malvern Zetasizer Nano ZS90纳米粒径电位分析仪(英国Malvern公司);日立Chromaster高效液相色谱仪(日立高新技术公司);JEM-2100 Plus型透射电子显微镜(日本电子株式会社);ZRS-8GS型智能溶出试验仪(天津海益达科技有限公司);DSC3型差示扫描量热仪(梅特勒-托利多国际有限公司);L-90K型超速离心机(美国贝克曼公司)。
1.2 试药
盐酸雷洛昔芬原料药(质量分数99.5%,批号ST200817-1,重庆圣华曦药业股份有限公司);山嵛酸甘油酯(德国巴斯夫公司);大豆磷脂(上海太伟药业股份有限公司);泊洛沙姆188(德国巴斯夫公司);乙醇(国药集团化学试剂有限公司);纯化水(实验室自制)。
2 方法与结果
2.1 RLX-SLNs的制备
通过对制备工艺进行预实验考察,采用热熔乳化-高压均质法制备RLX-SLNs[12]。称取盐酸雷洛昔芬100 mg、山嵛酸甘油酯2 000 mg和大豆磷脂200 mg加入装有10 mL乙醇的梨形瓶中,搅拌至固体完全溶解,通过旋转蒸发去除乙醇,并放置在真空干燥箱中过夜,得到无色固体脂质混合物,将固体混合物放置在85 ℃水浴中形成熔融状透明油状溶液,恒温保存,作为油相,备用;称取泊洛沙姆18 850 mg加入装有50 mL纯化水的烧杯中,搅拌溶解,水浴加热至85 ℃,恒温保存,作为水相,备用;在2 500 r·min-1磁力搅拌速度下将油相缓慢滴加到水相中,滴加结束后持续搅拌10 min,形成乳白色乳状液;将该溶液进行高压均质处理,设定均质压力为500 bar,循环均质5次,冰水浴冷却,加水定容至50 mL,即得到外观呈乳白色的RLX-SLNs,4~8 ℃低温保存,备用。
2.2 包封率测定
量取RLX-SLNs 4 mL置于高速离心管中,以15 000 r·min-1离心1.5 h后溶液分层,上层为澄清透明溶液,下层为白色沉淀物,移取上层溶液1.0 mL,置于10 mL量瓶中,加流动相定容,得到待测液(W游离);另取RLX-SLNs 1.0 mL,置于50 mL量瓶中,加乙腈超声破乳,再加入流动相定容,得到待测液(W总)。取上述2份样品,分别用高效液相色谱法(high performance liquid chromatography,HPLC)[13]检测药物含量。用包封率=[(W总-W游离)/W总]×100%计算RLX-SLNs的包封率。计算得包封率为97.8%±1.6%,说明大部分RLX被包裹或吸附在纳米粒中,游离药物极少。
2.3 粒径分布及Zeta电位测定
取RLX-SLNs 0.1 mL,置于聚苯乙烯样品池中,再加入3 mL纯化水稀释,使用Malvern Zetasizer Nano ZS90纳米粒径电位分析仪测定粒径分布与Zeta电位。仪器参数设置:光源为氦-氖激光器,激光功率为4 mW,波长为633 nm,环境温度为25 ℃。结果见图1。
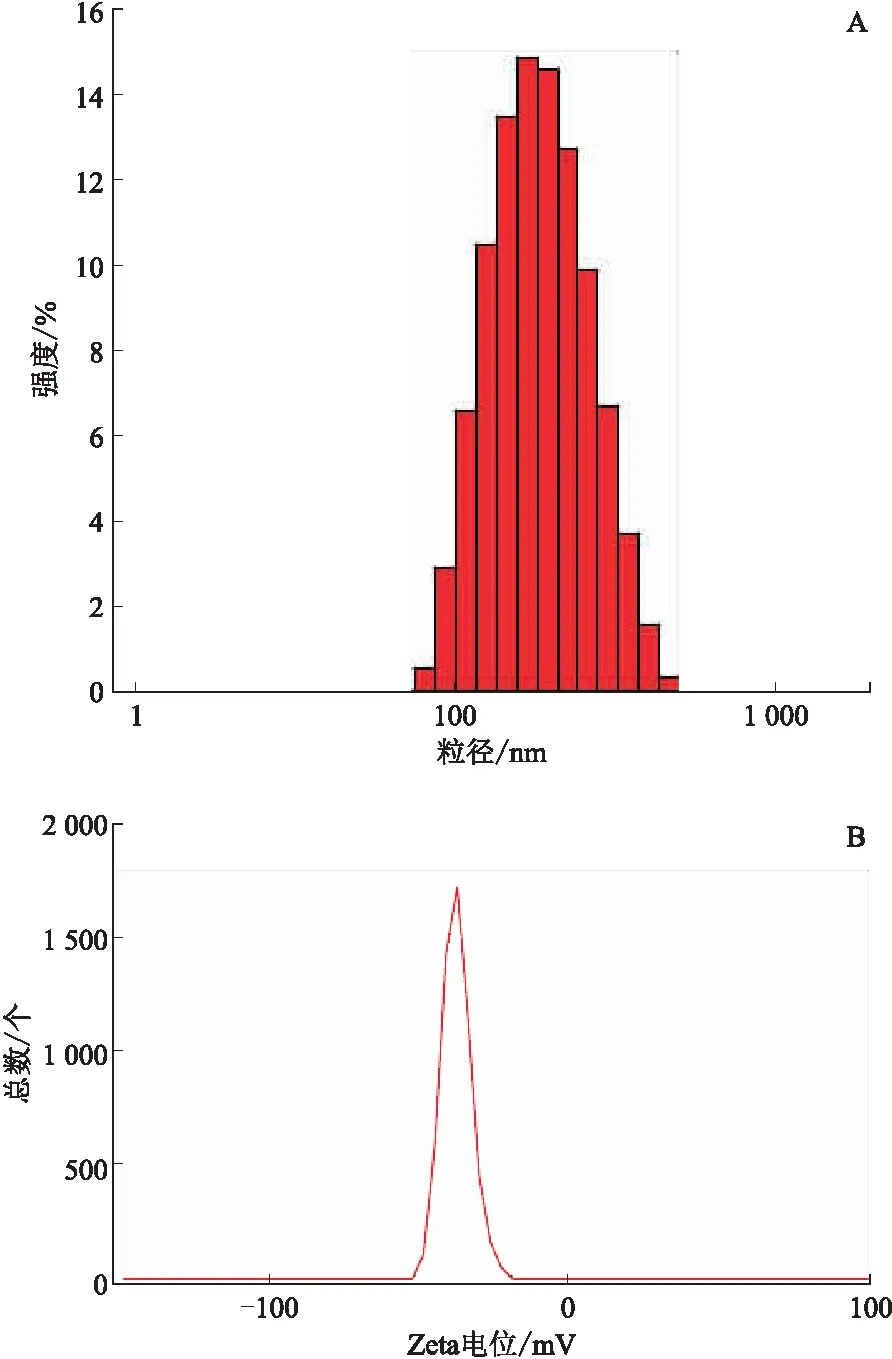
注:A. RLX-SLNs的粒径分布;B. RLX-SLNs的Zeta电位图。
经测定RLX-SLNs的粒径为(194.5±8.5) nm,粒径较小,有利于被小肠上皮细胞通过内吞作用摄取[14];RLX-SLNs的多聚分散指数(polydispersity index, PDI)为0.183±0.08,说明纳米粒的粒径分布较窄,粒径大小较为均匀;RLX-SLNs的Zeta电位为(-34.3±1.5) mV,有利于体系稳定[15]。
2.4 透射电镜观察
取少量RLX-SLNs,加入纯化水稀释,用滴管取1滴上述稀释液滴加到碳涂层铜网上,均匀铺展,再滴加1滴质量浓度为5 mg·mL-1的磷钨酸钠溶液,负染10 min,之后用滤纸从液体边缘处吸取多余的水分,并放置在红外灯下干燥,在透射电镜下观察,并拍摄照片,见图2。在透射电镜下可清楚地观察到RLX-SLNs呈球形,表面光滑,大小较为均匀,无聚集,未观察到药物晶体。
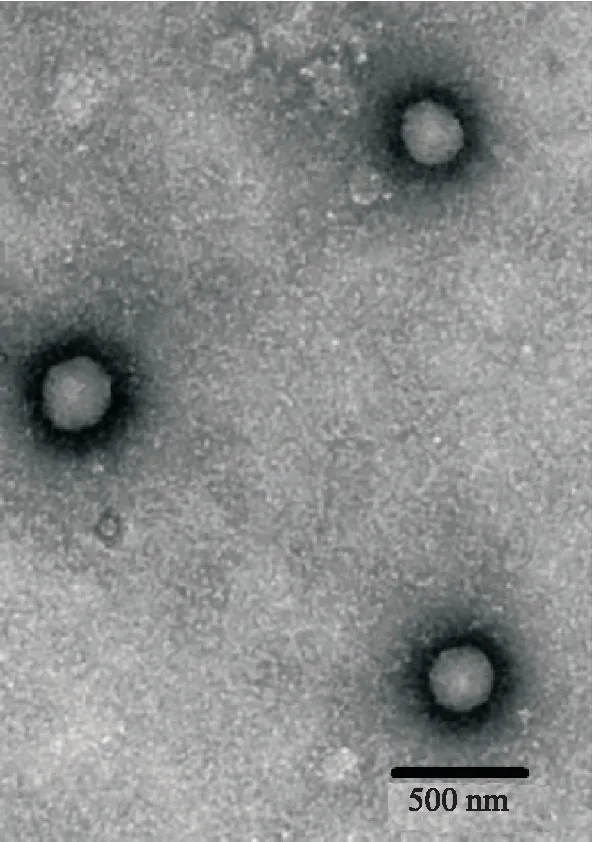
图2 RLX-SLNs的透射电镜照片
2.5 差示扫描量热法分析
使用差示扫描量热仪对RLX原料药、脂质熔融物、RLX原料药与脂质的物理混合物以及RLX原料药与脂质形成的熔融物进行热分析。精密称取上述4种样品各5 mg放入铝锅中,密封,固定到样品板上,另将空的铝锅密封后固定到另一个样品板上,作为对照,开通氮气,流速为30 mL·min-1,以10 ℃·min-1的速率加热,温度范围为50~350 ℃。结果见图3。
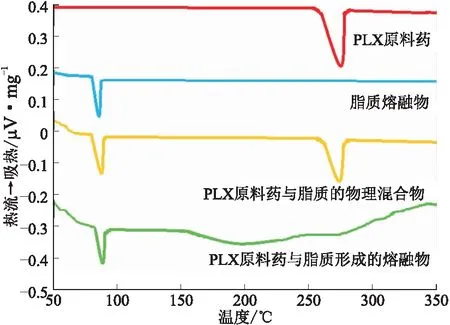
图3 差示扫描量热图
DSC热分析结果显示,RLX原料药在271.2 ℃处出现吸热峰,该吸热峰为RLX的熔点,固体脂质熔融物的熔点均在80 ℃左右,RLX原料药与脂质的物理混合物中脂质的熔点为80.4 ℃,药物的熔点为271.2 ℃,熔点均未发生变化,而RLX原料药与脂质形成的熔融物只出现了脂质的吸热峰,未检测到RLX的吸热峰,说明RLX以分子状态分散在固体脂质中[16]。
2.6 不同pH稀释稳定性
RLX-SLNs经口服进入胃肠道需经历pH改变和被稀释的过程,其物理性质有可能发生变化,进而影响到药物的吸收,因此用不同pH值介质溶液稀释RLX-SLNs来模拟其在胃肠道环境中的稳定性[17]。取RLX-SLNs 1.0 mL分别经pH 1.2、4.5、6.8、7.4溶液稀释50和200倍,在37 ℃条件下放置6 h,检测其粒径分布。结果见表1。
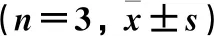
表1 RLX-SLNs用不同pH值介质溶液稀释稳定性结果
研究表明,RLX-SLNs经不同pH值介质稀释后,在放置过程中均未出现絮凝或沉淀现象,粒径大小基本无变化,具有较强的抗稀释性,可以初步预测RLX-SLNs进入胃肠道后不会因为体液稀释或pH改变而发生絮凝或沉淀。
2.7 体外药物释放
采用反向透析法考察RLX-SLNs在不同pH介质溶液中的体外药物释放情况[18]。取RLX-SLNs 2 mL置于透析袋中,系紧两端,放入100 mL释放介质中,释放介质分别选择pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和pH 7.4磷酸盐缓冲液,介质中均添加了质量浓度为5 mg·mL-1的吐温-80,水浴温度为(37±0.5) ℃,磁力搅拌速度为100 r·min-1,并在设定时间点(0.5、1、2、4、6、8、12、24 h)取3 mL介质溶液,经过滤、稀释,用HPLC法检测药物含量,绘制药物累积释放度-时间曲线。见图4。
由图4可见,RLX-SLNs在4种介质中表现出相似的药物释放速率,均为双相释放模式,即前期药物释放为突释,在初始2 h药物释放量约为35%,这主要是来自于游离的和吸附在固体脂质纳米粒表面RLX的释放;后期表现为缓释,在24 h药物释放量约为85%,主要是来自于固体脂质纳米粒内部药物的释放。
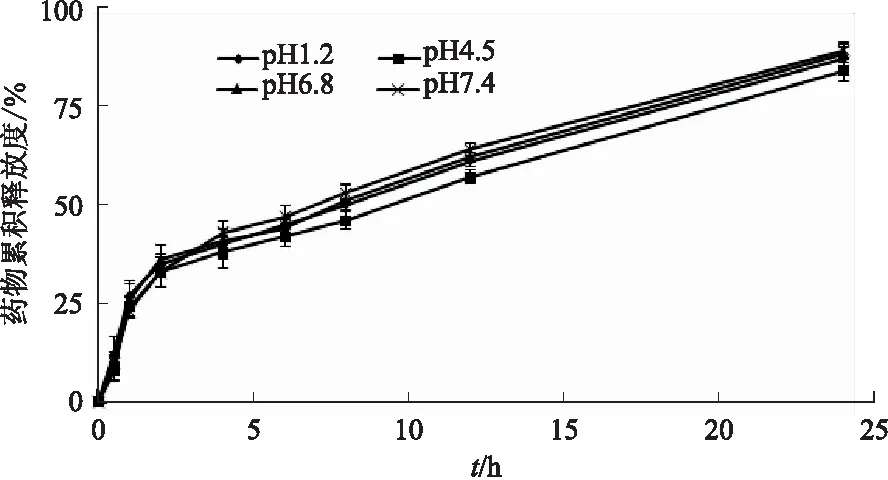
图4 RLX-SLNs在4种不同pH介质溶液中体外释放度-时间曲线
2.8 体内药代动力学
2.8.1血样前处理 取100 μL大鼠血浆样品转移到5 mL离心管中,加入乙酸乙酯2 mL涡旋5 min,使血浆蛋白充分沉淀,以5 000 r·min-1离心10 min,取上清液置于另一只5 mL离心管中,放入真空干燥箱中挥干有机溶剂,残留物用100 μL流动相重新溶解,涡旋振荡2 min。按照如下所述色谱条件检测:色谱柱为ZORBAX SB-C8(150 mm×4.6 mm,5 μm),流动相为20 mmol·L-1醋酸铵缓冲液(用醋酸调节至pH=4.5)-乙腈(63∶37),流速为1.0 mL·min-1,检测波长为289 nm,柱温为35 ℃。方法学验证结果表明,血浆中RLX的质量浓度在50.0~5 000.0 ng·mL-1范围内的标准曲线为y= 0.018 4x+0.010 2(R2=0.999 6),方法的定量限为20 ng·mL-1,低(50 ng·mL-1)、中(1 000 ng·mL-1)和高(5 000 ng·mL-1)3个质量浓度的药物提取回收率分别为93.9%、94.1%、93.1%,日间和日内精度RSD值均低于5%,说明该方法的提取回收率高,精密度好,可用于血浆样品的分析。
2.8.2动物实验 取12只雌性Wistar大鼠,体质量为(220±20) g,大鼠禁食12 h,期间只提供饮用水。将大鼠分成A、B组,每组6只,A组大鼠用喂食针口服给予RLX混悬剂,B组大鼠用喂食针口服给予RLX-SLNs,给药剂量均为15 mg·kg-1,在规定的时间点(0.5、1、2、4、6、8、12、24 h)用乙醚麻醉大鼠,使用毛细管通过眼眶后静脉丛穿刺取血,血样以4 000 r·min-1离心10 min,分离血浆,收集上清液(血浆)置于-20 ℃条件下冷冻保存,检测前室温解冻,按照色谱条件进样检测药物含量,使用软件WinNonLin©分析血药质量浓度-时间数据,计算药动学参数。结果见表2、图5。
表2 大鼠口服给予RLX混悬剂和RLX-SLNs后药动学参数的比较
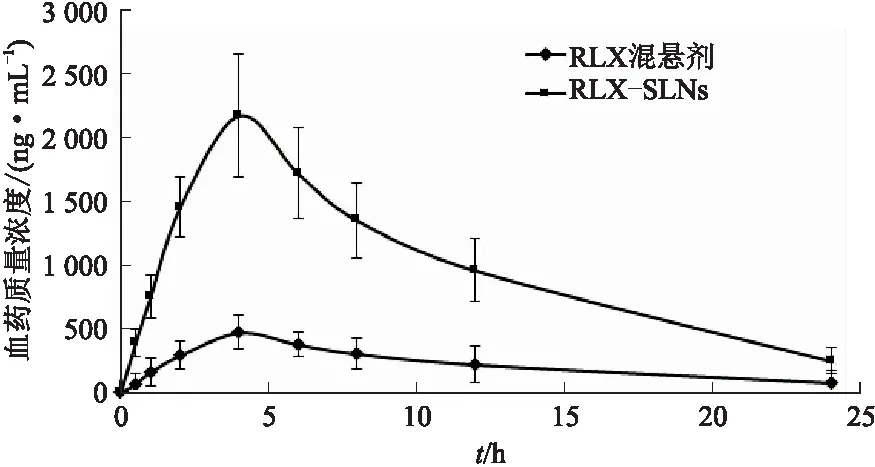
图5 血药质量浓度-时间曲线
3 讨论
本研究制备的RLX-SLNs采用山嵛酸甘油酯作为固体脂质,其熔点约为80 ℃,经DSC检测证实RLX是以分子形态溶解到固体脂质中,这样有利于提高药物的溶解度。另外,由于RLX-SLNs的粒径约为200 nm,粒径极小,故拥有巨大的比表面积,可提高对肠壁的生物黏附性,延长了其在胃肠道中的停留时间。
药动学参数检测结果显示,与大鼠口服RLX悬浮剂相比,大鼠口服RLX-SLNs后的半衰期(t1/2)有所延长,达峰时间(tmax)有一定的滞后,达峰血药质量浓度(Cmax)显著提高(P<0.05),为RLX悬浮剂的4.7倍,口服生物利用度显著提高(P<0.05),约提高了5.4倍。一方面,RLX-SLNs的外表面是由亲水性的大豆磷脂和泊洛沙姆188构成,改善了纳米粒的润湿性;另一方面,RLX-SLNs通过肠道中的M细胞和淋巴运输被直接吸收进入体循环,减弱了肝首过效应,促进了药物的口服吸收[19]。
