替莫唑胺联合干扰素-α治疗晚期恶性黑色素瘤的疗效与安全性Meta分析
2022-03-24肖渝夏萍张漾杰肖砚斌康建平朱昱衡
肖渝 夏萍 张漾杰 肖砚斌 康建平 朱昱衡
作者单位:1云南省肿瘤医院 昆明医科大学第三附属医院骨外二科,云南 昆明 650118
2 昆明医科大学第一附属医院干部医疗心内科,云南 昆明 650032
恶性黑色素瘤是源于神经嵴的恶性肿瘤,虽然死亡率自1980年以来基本保持稳定[1],但发病率长期位于所有肿瘤发病率前五位[2],据WHO 统计,全球每年有超过13 万的新发恶性黑色素瘤病例[3]。恶性黑色素瘤的生存率与其诊断分期有很大关系,未发生转移者经手术干预能获得较高的治愈率,但是一旦发生转移则预后较差[4]。如何改善晚期恶性黑色素瘤患者的生存期及预后,已成为现阶段研究的热点。
晚期恶性黑色素瘤的治疗方法较多,其中手术是早期恶性黑色素瘤患者最主要的治疗手段,但要求手术切除彻底,因为残留的癌细胞以及卫星病灶是出现复发和转移的原因[5,6]。近年来随着靶向治疗和免疫治疗的发展,对恶性黑色素瘤的治疗取得了一定进展[7,8],但高昂的成本以及疗效的不确定仍需要进一步研究[9,10]。相比之下,化疗仍是我国晚期恶性黑色素瘤患者的主要治疗手段。
替莫唑胺(TMZ)是一种口服咪唑四嗪类化合物,具有毒性小、能通过血脑屏障等优势,已被广泛应用于晚期恶性黑色素瘤患者,尤其是伴有中枢转移者,是治疗晚期恶性黑色素瘤的首选药物之一[11~13]。干扰素-α 是1995年美国FDA 首先批准作为黑色素瘤切除后的辅助治疗用药,具有调节免疫、诱导分化和抗血管形成等作用,通过增强免疫细胞活力来发挥抗肿瘤作用,是生物治疗中的重要药物之一[14~16]。通过将化疗与生物治疗相结合,采用生物化疗的方式来改善晚期恶性黑色素瘤患者的病情逐渐成为热点[17]。但相关研究多以单臂研究为主,缺乏有效对比。本研究通过搜集相关的临床随机对照研究,运用Meta分析比较TMZ 联合干扰素-α与TMZ 单药对晚期恶性黑色素瘤的疗效及安全性差异,从而为临床治疗提供客观数据支持。
1 材料与方法
1.1 文献检索采用“temozolomide”、“interferon”、“melanoma”以及与之关联的同义词、主题词搜索PubMed、Cochrane Library、Ovid 数据库;用“替莫唑胺”、“干扰素”、“黑色素瘤”以及与之关联的同义词、主题词搜索中国知网、万方、维普数据库。筛选从数据库建库至2021年8月发表的所有文献。
1.2 文献纳入标准①有明确的病理诊断,且经系统治疗后疾病进展或无法接受手术治疗的晚期恶性黑色素瘤患者;②研究类型:随机对照研究。实验组为TMZ 联合干扰素-α,对照组为TMZ 单药,同一研究内TMZ 用法用量统一,28 天为1 个周期,直到疾病进展或出现不能耐受的不良反应;③研究指标包含近期疗效、无进展生存期、不良反应;④研究数据准确。
1.3 文献排除标准①非随机对照研究、单臂研究以及未明确说明药物使用剂量和方法的研究;②重复发表及同一作者不同研究使用相同数据的研究;③病例报告、会议报告、社论、手术技术说明、综述、仅含摘要、动物或细胞实验研究。
1.4 文献质量评价根据Jadad 评分标准对纳入文献进行综合质量评价,整个过程由6 位作者分别独立完成,意见分歧则协商统一。评价内容及标准如下:①随机:否为0 分,不清楚为1 分,是为2 分;②隐藏随机方式:否为0 分,不清楚为1 分,是为2 分;③盲法:否为0 分,不清楚为1 分,是为2 分;④退出或失访:否为0 分,是为1 分。总分为7 分,1~3分为低质量文献,4~7 分为高质量文献。
1.5 偏倚风险评价根据Cochrane 偏倚风险评价手册对纳入文献进行偏倚风险评价。评价内容及标准如下:①是否有随机序列的产生;②是否分配隐藏;③是否对研究者和受试者施盲;④研究结果是否盲法评价;⑤结果数据是否完整;⑥是否选择性报告研究结果;⑦是否有其他偏倚来源。以此将纳入文献质量分为“低偏倚风险”、“偏倚风险未知”、“高偏倚风险”。其中评价结果“是”为 “低偏倚风险”、“未知”为“偏倚风险未知”、“否”为“高偏倚风险”,并统计各类占比获得最终偏倚风险评价。
1.6 统计学分析采用RevMan5.4 软件进行Meta分析。二变量资料采用比值比(OR)及其95%可信区间(95%CI)为效应量。无进展生存期风险比(HR)的对数值为效应量。各项研究结果间的异质性检验采用Q检验,检验水准P=0.05。采用I2进行定量分析,当I2<50%时采用固定效应模型,当I2>50%时采用随机效应模型,并对异质性来源进行敏感性分析或描述性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 文献检索结果共检索文献143 篇(英文90 篇,中文53 篇)。排除重复文献25 篇,通过阅读文献题目、摘要后剔除明显不符合要求的文献101 篇,阅读全文后依据纳入和排除标准排除文献13 篇,最终纳入文献4 篇。见表1。
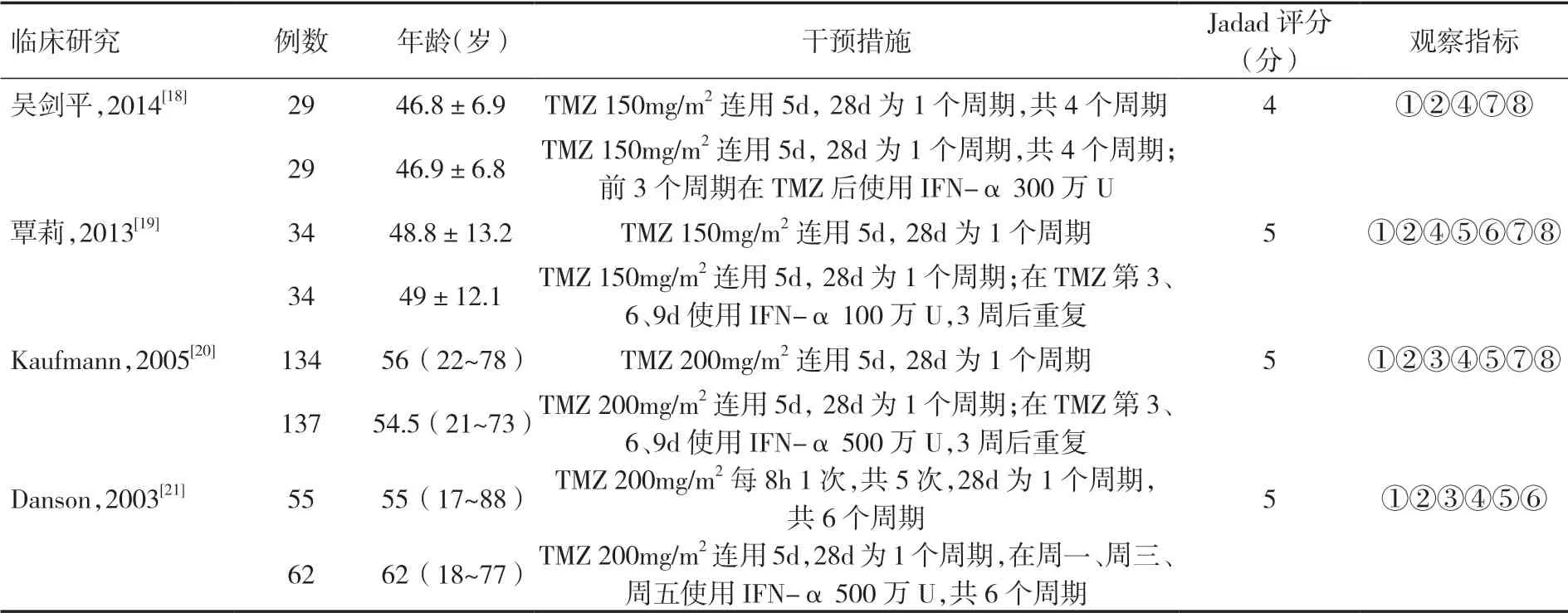
表1 纳入文献信息
2.2 文献质量评价纳入的4 篇文献均为RCT 研究,依据Jadad 评分标准,1 篇评分4 分,3 篇评分5分,均为高质量文献。
2.3 偏倚风险评价纳入的4 篇文献均为RCT 研究,根据Cochrane 偏倚风险评价手册,随机序列的产生中4 篇均为“低偏倚风险”;分配隐藏中有2篇为“低偏倚风险”,2 篇为“偏倚风险未知”;对研究者和受试者施盲中有1 篇为“高偏倚风险”,3 篇为“偏倚风险未知”;研究结果盲法评价中4 篇均为“偏倚风险未知”;结果数据的完整性中4 篇均为“低偏倚风险”;选择性报告研究结果中4 篇均为“低偏倚风险”;其他偏倚来源中4 篇均为“低偏倚风险”。
偏倚风险评价结果:纳入的研究中3.57%的评价为“高偏倚风险”,64.3%的评价为“低偏倚风险”,32.1%的评价为“偏倚风险未知”。见图1。

图1 偏倚风险
2.4 Meta分析结果
2.4.1 近期疗效 客观缓解率共纳入4 项研究[18~21],各研究间无明显异质性(P>0.05,I2=0),故采用固定效应模型分析,Meta分析结果如图2,实验组与对照组的客观缓解率差异具有统计学意义[OR=2.23,95%CI(1.44,3.47),P<0.05],实验组较对照组治疗晚期恶性黑色素瘤的客观有效率更高。疾病控制率共纳入4 项研究[18~21],各研究间无明显异质性(P>0.05,I2=36%),故采用固定效应模型分析,Meta分析结果如图3,实验组与对照组的疾病控制率差异无统计学意义[OR=1.37,95%CI(0.95,1.98),P>0.05]。
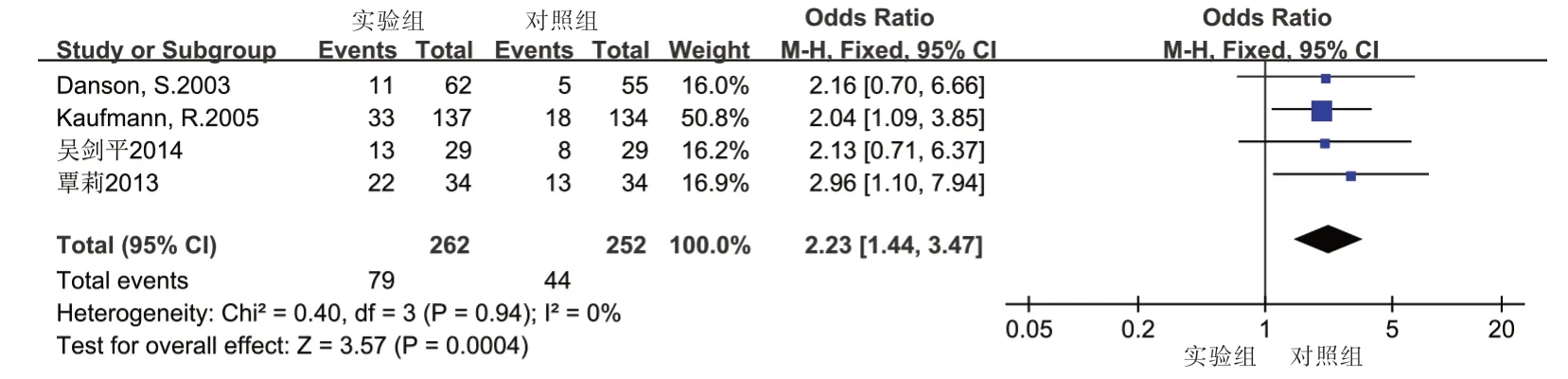
图2 实验组与对照组客观缓解率的Meta分析
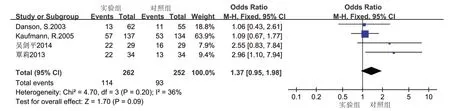
图3 实验组与对照组疾病控制率的Meta分析
2.4.2 无进展生存期 无进展生存期共纳入2 项研究[20,21],各研究间无明显异质性(P>0.05,I2=0),故采用固定效应模型分析,Meta分析结果如图4,实验组与对照组的无进展生存期无显著性差异[HR=1.14,95%CI(1.00,1.30),P>0.05]。
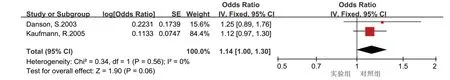
图4 实验组与对照组无进展生存期的Meta分析
2.4.3 不良反应分析 白细胞减少(图5A)、血小板减少(图5B)、血红蛋白减少(图5C)、恶心呕吐(图5D)、肝损伤(图5E)共5 项3 级以上不良反应。白细胞减少共纳入4 项研究[18~21],各研究间存在异质性(P<0.05,I2=84%),采用随机效应模型,Meta分析结果如图5A,实验组与对照组差异无统计学意义[OR=1.68,95%CI(0.52,5.42),P>0.05]需进行亚组分析确定异质性来源。血小板减少共纳入3 项研究[19~21],各研究间无明显异质性(P>0.05,I2=0),采用固定效应模型,Meta分析结果如图5B,对照组较实验组血小板减少出现更少[OR=4.51,95%CI(2.44,8.34),P<0.05]。血红蛋白减少共纳入2 项研究[19,21],各研究间无明显异质性(P>0.05,I2=0),采用固定效应模型,Meta分析结果如图5C,实验组与对照组出现血红蛋白减少无明显差异[OR=1.61,95%CI(0.87,3.01),P>0.05]。恶心呕吐症状共纳入3 项研究[18~20],各研究间无明显异质性(P>0.05,I2=0),采用固定效应模型,Meta分析结果如图5D,实验组与对照组出现恶心呕吐症状无明显差异[OR=0.85,95%CI(0.46,1.60),P>0.05]。肝损伤共纳入3 项研究[18~20],各研究间无明显异质性(P>0.05,I2=0),采用固定效应模型,Meta分析结果如图5E,实验组与对照组出现肝损伤无明显差异[OR=1.39,95%CI(0.67,2.88),P>0.05]。
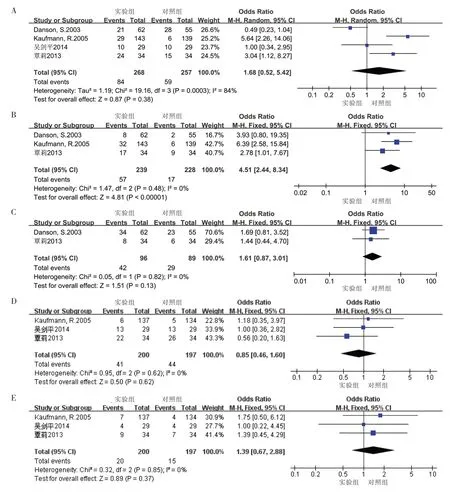
图5 实验组与对照组不良反应的Meta分析
2.4.4 亚组分析 依据纳入研究的药物治疗周期进行分组,其中2 项研究明确提及用药总周期[18,21],另外2 项研究中无用药总周期描述[19,20],亚组分析结果如图6,其中用药总周期明确时,实验组与对照组治疗晚期恶性黑色素瘤出现白细胞减少不良反应无明显差异[OR=0.63,95%CI(0.33,1.21),P>0.05]。用药总周期不明确时,实验组与对照组出现白细胞减少不良反应有明显差异[OR=4.26,95%CI(2.17,8.36),P<0.05],实验组更容易出现白细胞减少。
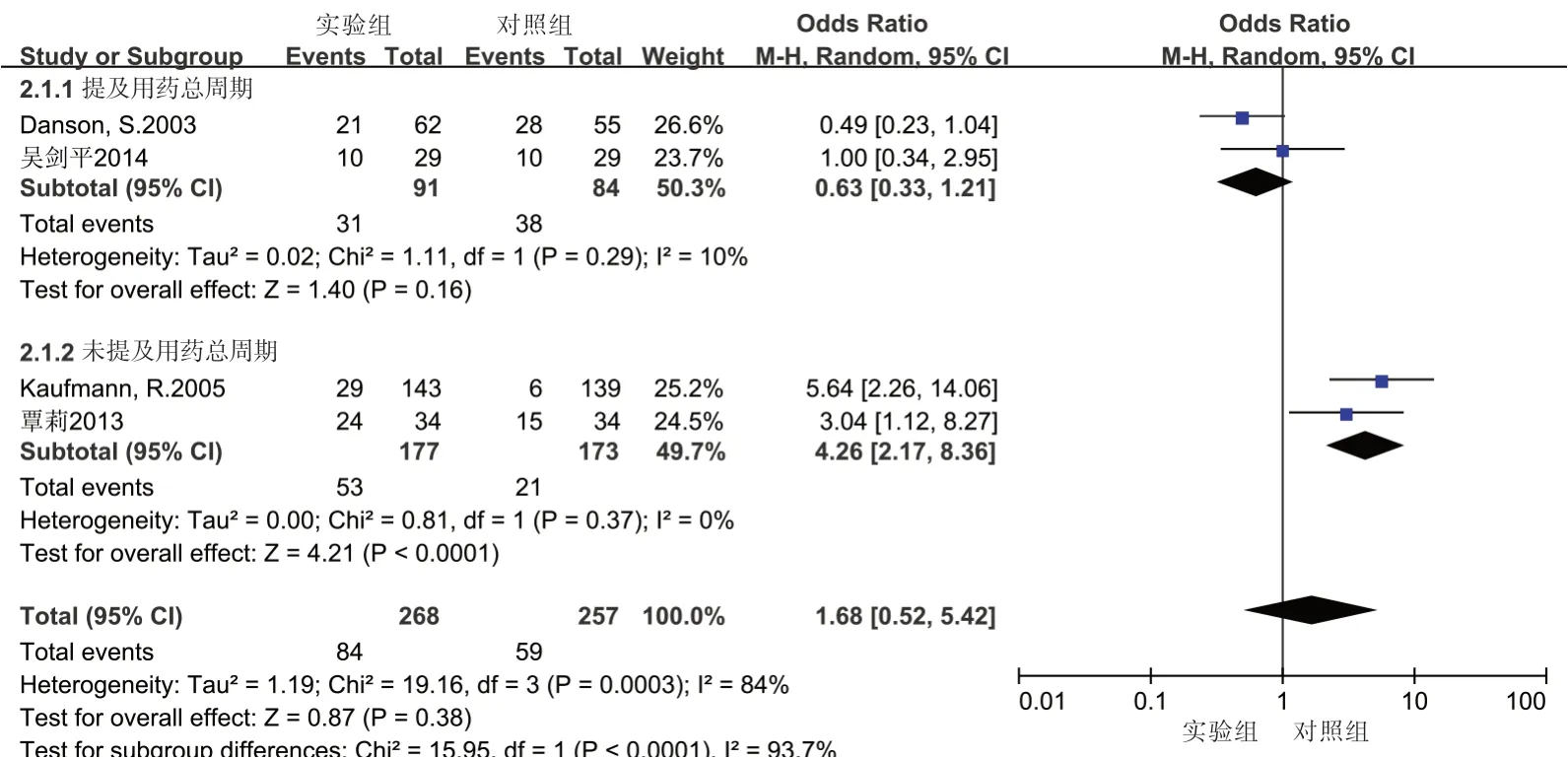
图6 实验组与对照组致白细胞减少不良反应的亚组分析
3 讨论
此次Meta分析结果显示,虽然TMZ 联合干扰素-α治疗晚期恶性黑色素瘤的客观缓解率较TMZ 单药有明显改善,但在疾病控制率和无进展生存期上与TMZ 单药相比无明显差异。联合用药与TMZ 单药相比,近期疗效明显,但对远期生存情况无明显改善。Danson 等[21]研究发现,联合用药的中位生存期和1年无进展生存期、2年无进展生存期均高于TMZ 单药治疗,有记录生存期可延长至(24±65.5)个月[22]。但另有研究发现,联合用药组虽能维持较长的无复发生存率,但对总生存率并无明显改善[23],对延长患者生存期亦无明显帮助[24,25]。Coker等[26]认为对于晚期患者,联合用药可增加不良反应的发生率,并且不良反应程度会加重,而早期患者能接受更长时间的联合用药治疗,因此推荐早期患者采用联合用药。两组患者用药后3 级以上不良反应除血小板减少和白细胞减少情况更严重外,血红蛋白、消化道症状和肝脏损伤均无明显差异。
本研究表明,联合用药患者的客观缓解率较对照组明显提高,但未能转化为生存期的延长。经过分析,考虑原因如下:①TMZ 联合干扰素-α 用药具有一定的协同作用。研究发现,TMZ 联合干扰素-α 能够通过影响细胞的G2/M 期阻止细胞的有丝分裂,这与TMZ 单独用药时机制完全不同,并且二者能够协同促进肿瘤细胞的凋亡和自噬[27]。另外,TMZ 能透过血脑屏障[28],与干扰素-α 联用对伴有脑转移的患者可同时起到抗外周和中枢肿瘤的作用;②干扰素-α 是通过与特定的细胞表面受体结合后激活细胞,才能发挥其作用[29],且由于干扰素-α 具有一定的细胞毒性,能够非选择性地抑制细胞增殖,因此对正常组织细胞亦具有毒性作用,这在一定程度上增加了不良反应发生风险,尤其对肿瘤细胞具有协同杀伤作用,同时对正常组织细胞的毒性作用亦有一定程度的增强,引起不良反应发生率增加,或程度加重[30];③在TMZ 与干扰素-α 联合用药时,血液系统相关不良反应发生的严重程度更高[31],首先考虑与二者抗肿瘤治疗时不良反应叠加有关,其次是随着治疗用药周期的延长,药物毒性的积累导致不良反应逐渐显现。
单用或联合大剂量干扰素-α 是目前国内外许多研究都倾向使用的一种治疗方式,认为其剂量与最终抗肿瘤治疗效果呈现一定的正比关系,并且认为患者的获益大于不良反应增加所带来的风险[14,23,32]。在本次Meta分析中纳入研究的干扰素使用剂量在100~500 万U,尚未达到大剂量使用的要求,但也观察到了3 级以上不良反应,尤其在血液系统毒性方面更为明显。然而既往文献研究表明,TMZ 对恶性黑色素瘤患者除细胞毒性外,还具有免疫调节功能,能够增加机体内成熟CD8+细胞数量[33],但这一特点并未在此次研究结果中得到体现,导致这一矛盾结果的具体机制仍有待进一步研究。但从目前各项研究的最终评价来看,TMZ 联合干扰素-α 的治疗方案仍然是安全可行的。
综上,本研究虽然证实TMZ 联合干扰素-α治疗方案能够提升晚期恶性黑色素瘤患者的客观缓解率,改善生存期内患者生活质量,但对于疾病的控制以及远期疗效仍未见明显改善,这可能与纳入的研究样本较少有关。另外,本次Meta分析纳入的研究中对用药的总周期缺乏统一意见,用药时间长短可能造成疗效以及不良反应结果的偏倚,对最终结果的分析造成影响。因此,仍然需要纳入更多相关研究进行补充,才能得出更为科学和可靠的结论。
