宫颈癌患者放疗敏感性与癌组织中HPV16-E6、p53 mRNA表达的关系分析
2022-03-24乔炳礼兑伟华王钖唐亚辉
乔炳礼 兑伟华 王钖 唐亚辉
作者单位:1 郑州市第三人民医院肿瘤科,河南 郑州 450000
2 郑州黄河科技学院,河南 郑州 450000
宫颈癌发病率在女性恶性肿瘤中排第二位,而在某些发展中国家其死亡率位于首位[1]。近些年的研究显示[2],我国宫颈癌发病率逐年增高,其原因可能与人乳头状瘤病毒(human papillomavirus,HPV)感染率增高及国家对宫颈癌筛查工作的大力投入,导致部分隐形宫颈癌患者得以确诊等有关。放疗是宫颈癌主要治疗方法之一,但不同个体对放疗敏感度不同[3]。因此,评估患者个体的放疗敏感度,并以此设计个性化的放疗方案对提高放疗疗效具有重要意义。HPV感染是宫颈癌发生、发展的重要危险因素[4],HPV 16-E6、p53 mRNA 则是一组与宫颈癌发生、发展密切相关的癌/抑癌基因,但关于该组基因对患者化疗疗效的影响,临床研究较少。本研究探讨宫颈癌组织中人乳头状瘤病毒(HPV)16-E6、p53 mRNA 表达及与放疗敏感性的关系,现报道如下。
1 材料与方法
1.1 一般资料选取2018年1月~2020年1月在我院治疗的宫颈癌患者76 例,年龄45~62 岁。纳入标准:①均经病理学确诊为宫颈鳞癌;②符合国际妇产科联盟(FIGO)分期中的Ⅰ~Ⅱ期;③患者及家属知情同意。排除标准:①非初治患者;②合并有肝肾功能障碍、急慢性感染、血液系统疾病等其他严重疾病者。
1.2 放疗方法根治性放射治疗方案:照射射线为直线加速器6/10 MV X 射线,选用X 线模拟定位,给予患者进行体外三维适形照射,每次剂量为2Gy,每周5 次,总剂量为30Gy。同时给予患者后装腔内照射,每次剂量为6Gy,每周1 次,总剂量为30~42Gy。后装放疗时间需与三维适形放疗错开,不可于同一天进行[5]。
1.3 检测方法根据患者放疗疗效分为放疗敏感及放疗抗拒两组,并于放疗前后活检取样,选用Trizol法提取RNA,取1μg RNA 进行反转录反应,将获取的DNA 作为RT-PCR 样本。PubMed.SNP 数据库查询HPV16-E6、p53 基因序列,引物由上海生工提供,PCR 反应体系为:2μl 样本,1μl 上、下游引物,10μl PCR-mix,8μl 灭菌双蒸水。反应条件设置如下:95 ℃,8min;94 ℃,40s;63 ℃,38s;72 ℃,40s,共32 个循环,选用苏州雅睿生物技术有限公司生产的MA-6000 实时荧光定量PCR 仪读取结果。
1.4 疗效标准完全缓解(CR):病灶消失,至少维持4 周及以上;部分缓解(PR):病灶体积较治疗前缩小>50%,至少维持4 周及以上;疾病稳定(SD):病灶体积较治疗前缩小≤50%,或增加<25%;疾病进展(PD):病灶体积较治疗前≥25%或出现新病灶。其中放疗敏感为CR+PR,放疗抗拒为SD+PD。
1.5 统计学方法采用SPSS 22.0 软件,计量资料采用±s表示,两组间比较使用t检验,计数资料比较使用χ2检验,采用Pearson 进行相关性分析。检验水准:双侧α=0.05。
2 结果
2.1 放疗疗效76 例患者中,放疗疗效达到CR 10例,PR 45 例,SD 14 例,PD 7 例,放疗敏感率为72.37%;放疗敏感和抗拒者年龄等一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 放疗敏感和抗拒者一般资料比较
2.2 放疗敏感和抗拒者放疗前后HPV16-E6、p53 mRNA 表达比较放疗敏感和抗拒者放疗后HPV16-E6 mRNA 相对表达量较放疗前降低(P<0.05),而p53 mRNA 相对表达量较放疗前升高(P<0.05);放疗敏感者放疗后HPV16-E6 mRNA相对表达量明显低于放疗抗拒者(P<0.05),而p53 mRNA 相对表达量明显高于放疗抗拒者(P<0.05)。见表2。
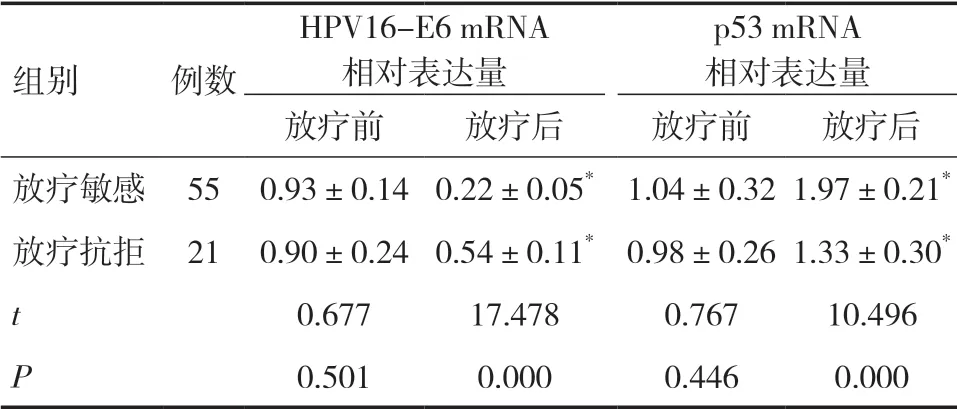
表2 放疗敏感和抗拒者放疗前后HPV16-E6、p53 mRNA表达比较
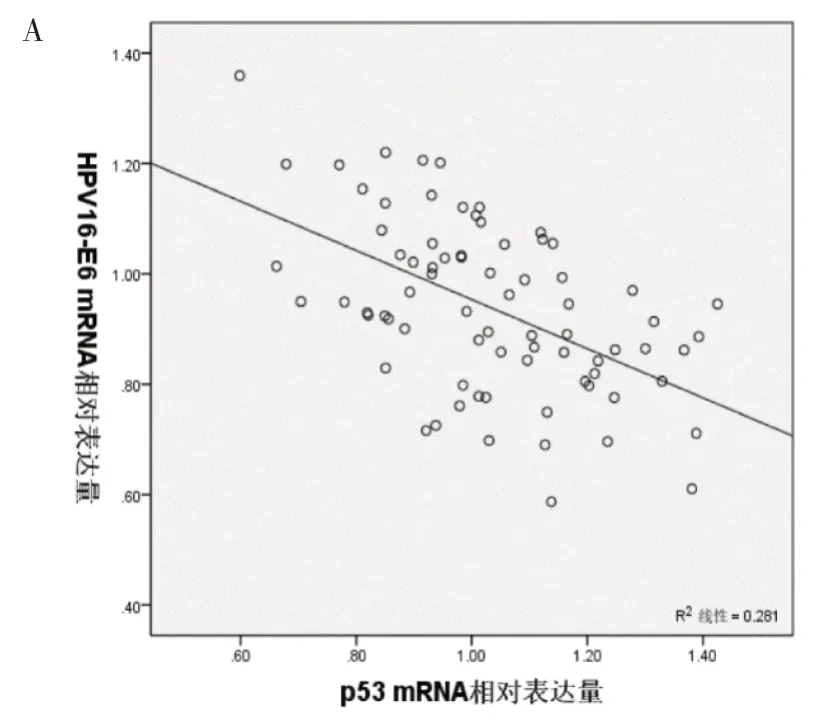
2.3 相关性分析将患者HPV16-E6 与p53 mRNA相对表达量进行相关性分析,结果显示:放疗前、放疗后HPV16-E6 与p53 mRNA 相对表达量呈负相关(r=-0.530 和-0.754,P<0.05)。见图1。
3 讨论
放疗是一种借助放射能量破坏细胞DNA 双链,进而杀伤癌细胞的治疗技术[5]。本研究76 例宫颈癌患者中,放疗疗效达到完全缓解(CR)10 例,部分缓解(PR)45 例,疾病稳定(SD)14 例,疾病进展(PD)7 例,放疗敏感率为72.37%,与同类研究[6]结果相似,提示放疗是一种有效的宫颈癌治疗方法。宫颈癌患者放疗敏感性受病理分型、病灶体积及位置、放疗方案以及HPV 病毒水平等因素影响,为探讨HPV 病毒相关mRNA 对宫颈癌放疗敏感性的影响,我们进行了本次研究。
HPV 属于双链嗜上皮性DNA 病毒,可通过整合宿主基因并破坏E2 病毒基因及对应染色体位点,进而导致细胞增殖失控,最终发生恶性病变[7]。HPV 具有多种分型,其中HPV16、HPV18 等高危型是宫颈癌的独立危险因素[8]。HPV16、HPV18 具有抑制抑癌基因表达、促进增殖基因表达、增强细胞恶性生物学行为等功能[9]。临床研究显示[10],HPV16-E6 是宫颈癌发生、发展的重要介质,E6 转化基因及其功能是HPV16 诱导宫颈癌的关键。E6蛋白具有促端粒酶逆转录酶转录能力,并以此维护、修复染色体端粒末端重复DNA,进而促进细胞的不断增殖[11]。HPV感染所引发的鳞状上皮病变组织内可见明显E6 蛋白高表达情况,而应用RNA干扰技术抑制沉默HPV16-E6 后,组织样本内的HPV16 DNA 表达水平显著下降,其复制功能也随之降低,癌细胞生长、增殖速度下降[12]。有研究发现[13],HPV16-E6 蛋白高表达,而p53 蛋白低表达是口腔癌进展的重要原因。p53 是抑癌基因的一种,该基因的突变是多种恶性肿瘤疾病的危险因素。HPV16-E6 蛋白与野生p53 蛋白结合后,p53 蛋白结构及其功能将随之改变,p53 蛋白对细胞G1 期的阻滞功能将大幅衰退,细胞将快速进入S 期,进而出现增殖失控情况,最终参与肿瘤发生、发展[14]。本研究中,放疗敏感者放疗后HPV16-E6 mRNA 相对表达量明显低于放疗抗拒者,而p53 mRNA 相对表达量明显高于放疗抗拒者,表明HPV16-E6、p53 mRNA 异常表达与宫颈癌患者放疗敏感度密切相关,分析其原因可能为:不同细胞具有的DNA 修复能力不同,细胞放疗后的DNA 修复能力直接影响着患者的放疗疗效[15]。野生型p53 蛋白具有促细胞凋亡能力,而一旦p53 mRNA 突变,其蛋白的促细胞凋亡功能将减弱,细胞的DNA 修复能力将异常化,放疗敏感性也随之降低。HPV16-E6 mRNA 可与突变p53 基因相互结合,并在突变p53 基因生成对应功能前将其灭活,避免突变p53 基因诱导细胞恶性病变。有研究发现[16],p53 基因高表达可增强宫颈癌患者放疗敏感性,这与本研究结果相似。本研究还发现,放疗前、放疗后HPV16-E6 与p53 mRNA 相对表达量呈负相关,分析其原因可能为:HPV16-E6蛋白可通过结合p53 蛋白来影响其功能,导致p53蛋白失去对细胞周期的调控能力,促使细胞异常复制,进而导致细胞恶性增殖能力增强,并降低细胞对放疗的敏感性。
本研究发现,HPV16-E6、p53 mRNA 表达不仅与宫颈癌发生、发展有关,还与患者放疗敏感性有关。临床可在放疗之前对患者HPV16-E6、p53 mRNA 表达水平进行检查,并根据患者HPV16-E6、p53 mRNA 表达水平选择合理的放疗方案及放疗剂量,确保放疗的有效性。此外,临床还可靶向干预HPV16-E6、p53 基因的表达,以此增强患者的放疗敏感性。受限于基础条件,本研究还存在样本量较小等不足,有待后期进行大数据分析。
综上所述,宫颈癌组织中HPV16-E6、p53 mRNA表达与患者放疗敏感有关,值得进一步研究。
