三叉神经电刺激对创伤性脑损伤小鼠认知功能障碍的作用
2022-03-24刘黎嘉琪徐静范胜诺杨仟伍少玲马超
刘黎嘉琪 徐静 范胜诺 杨仟 伍少玲 马超
创伤性脑损伤(TBI)是一种临床上常见的外 伤性疾病,它不仅会给患者带来运动、言语功能障碍,还会使患者产生认知障碍[1,2]。研究表明,TBI病史会提高人群患阿尔兹海默病(AD)、帕金森综合征等痴呆疾病的风险,也增加delta 裂解酶(AEP)加速APP 的裂解,促进β-淀粉样蛋白(Aβ)的产生[3,4]。这表示TBI 可能会使大脑AD 相关病理进展加快,并最终导致认知损害。在临床康复中,虽然有深部脑刺激、迷走神经电刺激等用于TBI 后的治疗[5,6],但对TBI 所产生的认知障碍,仍然缺少安全有效的干预手段。三叉神经电刺激(TNS)对抑郁症、癫痫、意识障碍等疾病有改善作用[7-9]。TNS 可以引起交感神经和副交感神经系统的协同作用,产生交感神经介导的系统血压低频振荡模式,减轻全身炎症,改善失血性休克的结局[10]。此外,研究发现,TNS 可以显著激活下丘脑外侧核和三叉神经脊核的神经元活动,提高昏迷大鼠的脑电信号,促进意识恢复,TNS 还可以促进海马区细胞增殖,并激活孤束核、蓝斑等脑区的神经活动[11]。本研究采用TNS 治疗TBI 后小鼠的认知障碍,并探讨其可能的机制,为TBI 后的认知障碍患者提供新的治疗方案。
1 材料和方法
1.1 实验动物 SPF 级C57BL/6J 小鼠60 只,周龄8-12 w,体重(26±3)g,均购于中山大学实验动物中心[生产许可证号码SCXK(粤)2016-0029]。实验过程中,小鼠以每笼5-6 只饲养于温度恒定,保持12 h 昼夜循环的环境下,并提供充足的水与饲料。所有操作均符合中山大学实验动物伦理规章制度,经由中山大学实验动物福利伦理审查小组批准。
1.2 分组与造模 将60 只小鼠均分为3 组,分别是假手术组(sham)、脑损伤组(TBI)和电刺激组(TNS)各20 只。参考相关文献[12],在异氟烷气体麻醉下采用自由落体(Weight-Drop)模型,构建小鼠TBI 模型,sham 组只行头皮切开及缝合操作,各组麻醉时间保持一致,手术结束后放回笼内,予保暖至小鼠正常苏醒。
1.3 仪器与试剂材料 (1)仪器:小动物气体麻醉机(R500 通用型,瑞沃德生命科技有限公司)、自由落体撞击器(瑞沃德生命科技有限公司)、电刺激仪器(A-M System)、Morris 水迷宫视频分析系统(上海欣软信息科技有限公司)、蛋白质免疫印迹电泳槽(BIO-RAD)、免疫荧光自动扫片仪(Leica)。(2)试剂:抗LC3A/B 抗体(Cell Signaling Technology)、抗Iba1 抗 体(Wako)、抗APP 抗 体(Abcam)、BCA 蛋白检测试剂盒(Thermo Fisher)。
1.4 三叉神经电刺激方案 造模结束后第1 h 与24 h,在异氟烷气体麻醉下,于3 组小鼠三叉神经V2 支体表处安放电极,进行双侧电刺激,sham 组与TBI 组不通电。刺激参数:频率40 Hz;电流0.1mA;30s on,30 soff;持续30 min。
1.5 行为学评估 造模结束后第48 h,参考相关文献[13],对每组各10 只小鼠进行Morris 水迷宫测试。测试共6 天。第1 天行可见平台训练,设置一个可见平台,将小鼠从各个象限背对水池放入池中120 s 寻找平台,使其适应环境并测试其游泳能力,避免因脑损伤造成行动受限而影响实验结果。第2-5 天进行隐藏平台测试,将平台放于SE象限,每天从不同象限将小鼠放入水池中120 s 寻找平台,若小鼠在120 s 内找到平台则让其在上面停留15 s,如果超过120 s 小鼠仍未找到平台,则引导其在平台上停留15 s。第6 天进行探索测试,将平台拿走,从SW 象限放入小鼠,测试小鼠的空间记忆能力。每天测试均在固定时间进行,测试结束后小鼠进行保暖烘干,放回笼中。
1.6 蛋白质免疫印迹 造模结束后48 h,每组各5 只,在异氟烷深度麻醉下断头取脑,每只小鼠取海马,液氮速冻后置于-80℃冰箱中保存,待所有样本取材完成后进行Western Blot(WB)实验。将小鼠海马样本加入含有蛋白酶抑制剂的强RIPA裂解液,使用自动冷冻研磨机进行组织匀浆,提取蛋白。采用BCA 法测定蛋白浓度后使蛋白变性,后进行上样、电泳分离,并转膜至PVDF 膜上,使用5%脱脂奶粉封闭1 h 后,4℃孵育一抗过夜。次日使用TBST 洗涤后室温孵育二抗1 h,再洗膜进行显影,获得图像后使用Image J 软件进行灰度分析。
1.7 免疫荧光技术 造模结束第48 h,经心脏灌注生理盐水与4%多聚甲醛取脑,全脑置于4%多聚甲醛中,在4℃下固定24 h。固定后将样本浸泡在30%蔗糖溶液中脱水48 h,使用OCT 包埋剂包埋,在冰冻切片机中进行切片,片厚40 μm。切片后使用PBS 洗净包埋剂,PBST(0.4%Triton X-100)配置10%山羊血清封闭,封闭后使用一抗4℃过夜。次日将标本置于室温2 h 后,使用PBST 洗涤,避光使用对应荧光二抗,室温孵育2 h。PBST 洗涤后以DAPI 染色,后将切片转于载玻片上,并滴加荧光抗淬灭剂,盖上盖玻片。
1.8 统计学分析 使用SPSS 25.0 软件与Graphpad Prism 8 进行统计学分析与绘图。数据均以(±s)形式体现,数据符合正态分布,若方差齐则采用单因素方差分析法,方差不齐采用K-W 检验。以P<0.05 为有显著性差异。
2 结 果
2.1 三组TBI 小鼠的认知能力比较 Morris 水迷宫测试中,TBI 组小鼠和TNS 组小鼠之间的平均游泳速度并无差异,首先排除了TBI 有可能导致的运动功能损伤给认知测试带来的影响。在第6 日的测试中,TNS 组小鼠的平台穿越次数与目标象限时间占比两个指标都明显优于TBI 组小鼠(P<0.05)。见图1。

图1 Morris 水迷宫测试结果(注:与TBI 组进行比较,*表示P<0.05)
2.2 三组TBI 后小鼠海马自噬水平与清除能力比较 TNS 组小鼠的海马区LC3 表达水平显著升高(P<0.01),见图2。在TNS 组小鼠海马组织中,Iba1 表达水平显著高于TBI 组(P<0.01),见图3。
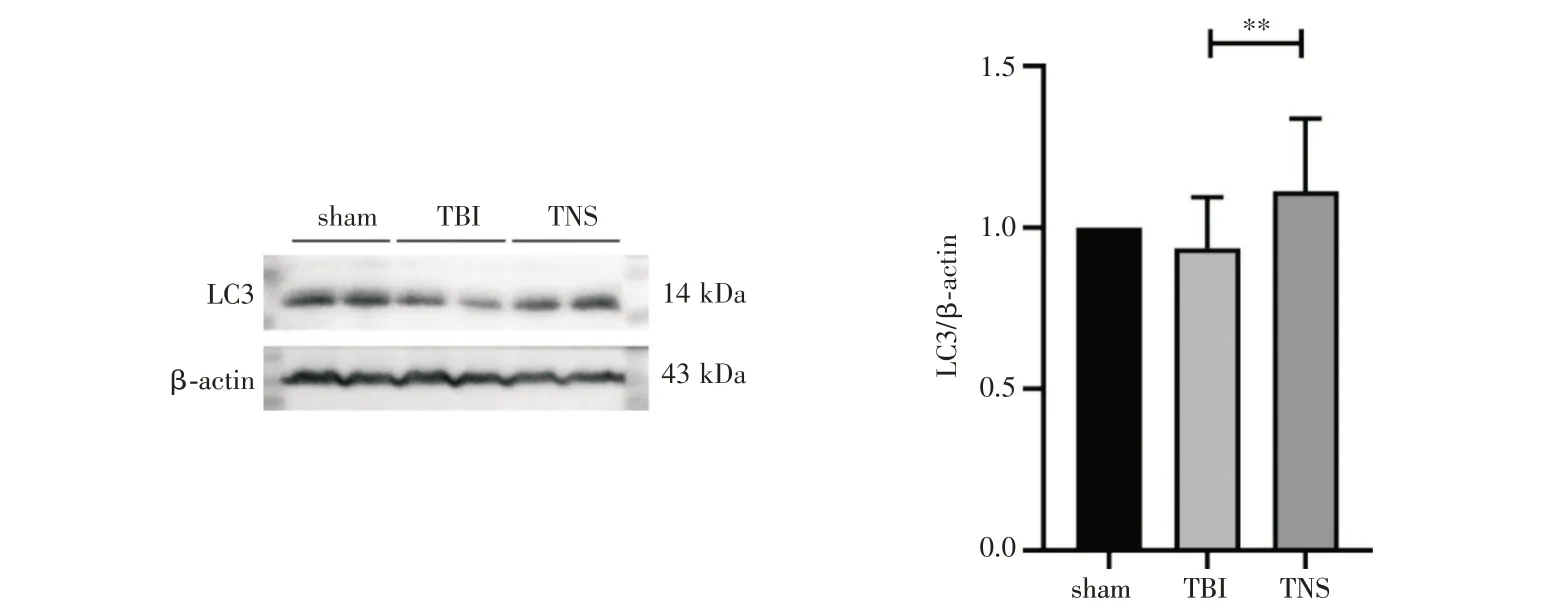
图2 各组海马区LC3 蛋白表达水平(注:与TBI 组进行比较,**表示P<0.01)
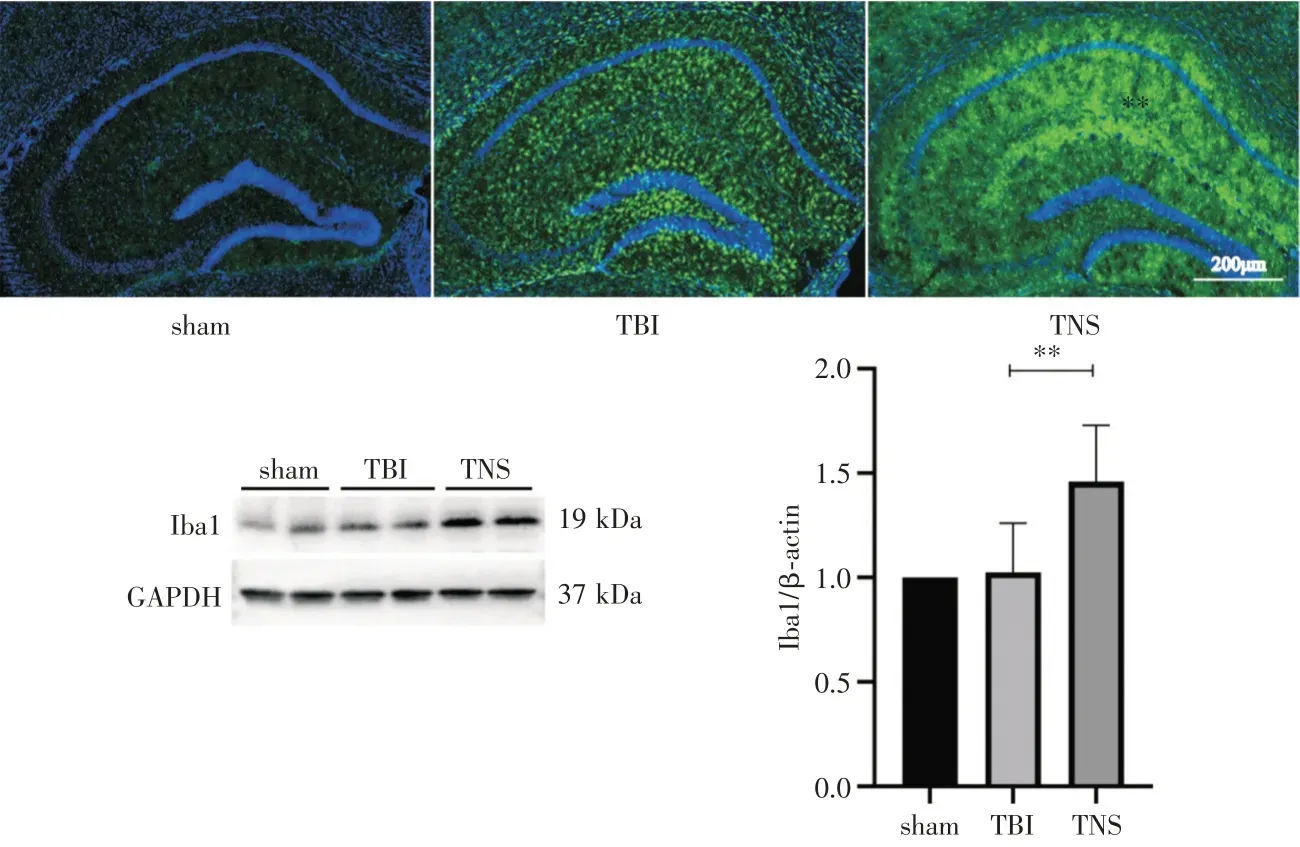
图3 各组海马APP 蛋白表达水平各组小鼠海马区Iba1 免疫荧光染色与Western Blot 中Iba1 蛋白表达水平
2.3 三组TBI后APP水平的比较 在损伤后48 h,APP 的累积较TBI 组明显减少(P<0.05),见图4。
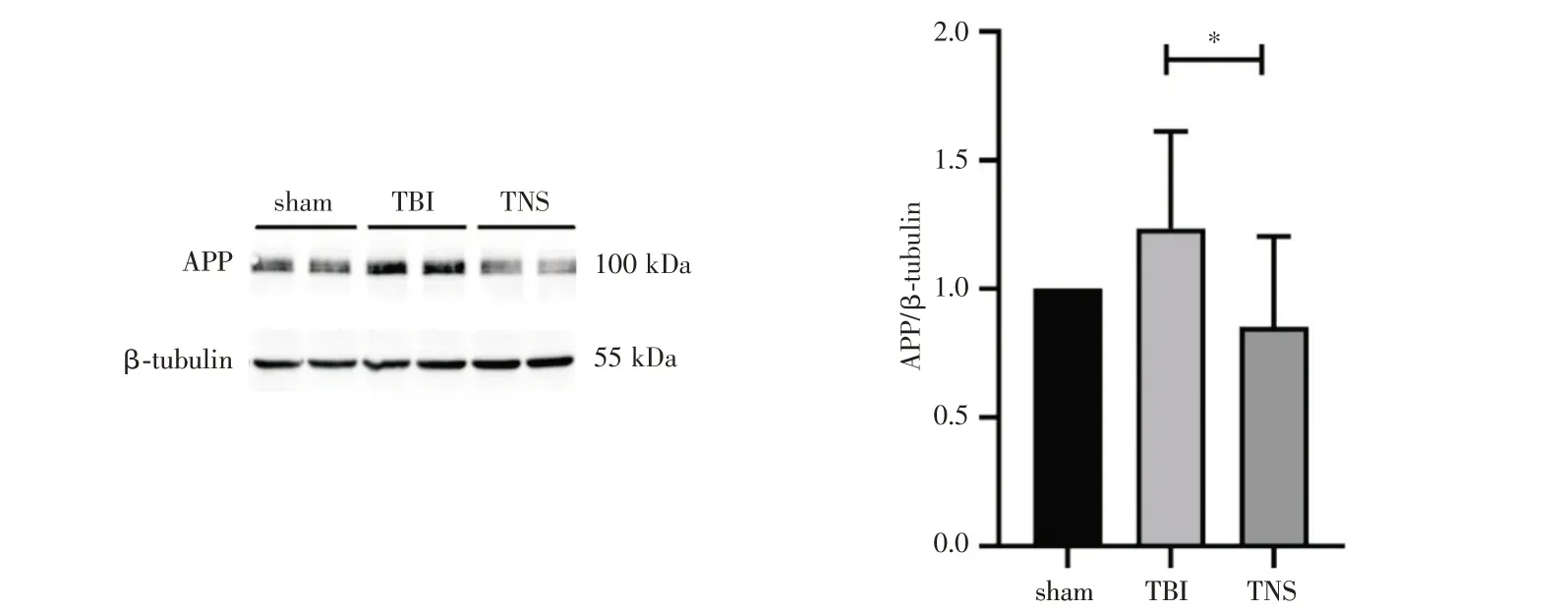
图4 各组海马APP 蛋白表达水平(注:与TBI 组比较,*表示P<0.05)
3 讨 论
本研究结果显示,TNS 治疗可改善TBI 小鼠的空间记忆功能,TNS 显著改善了TBI 后小鼠大脑的自噬水平,并在急性期激活了更多的小胶质细胞,减轻了Aβ 相关蛋白的累积,故推测改善认知能力的机制与此相关。
3.1 损伤后大脑的自噬水平改变 由于溶酶体功能障碍,导致早期自噬底物sequestosome 1 的累积,使自噬水平受到影响,这样的累积在TBI 后1-3天达到峰值并最终导致大脑神经元的死亡,在TBI后1 天通过抑制PLA2G4A/cPLA2 恢复自噬水平,能够逆转TBI 小鼠大脑皮层和海马的神经元死亡情况,并改善小鼠的运动协调性[14,15]。这表明自噬水平可作为TBI 后干预的一个重要靶点。外力冲击大脑造成轴突损伤,并伴随APP 大量累积在此类受损轴突中,APP 是Aβ 的前体蛋白,这可能是大量研究中TBI 后Aβ 斑块积聚的原因。有研究使用药物治疗TBI 通过改善自噬水平,减轻了APP 与Aβ 的负荷,并最终改善了小鼠的认知障碍[16]。因此,在TBI 急性期保证自噬功能的正常水平,可减轻TBI 给大脑带来的不良病理变化,对后续的功能恢复有重大意义。本研究观察到TNS组小鼠海马组织自噬标志物LC3 水平的增高,并伴随着APP 水平的下降,说明TNS 对TBI 可以有较显著的治疗效果。
3.2 小胶质细胞在TBI 中的作用 小胶质细胞是TBI 的第一类反应者,在中枢神经系统中扮演“哨兵”的角色。在TBI 的急性期,小胶质细胞可以快速将自身分支向受损部位延伸,并向受损部位进行定向迁移,限制受损的扩散;脑血管旁的小胶质细胞通过嘌呤能受体P2RY12 介导可以在血脑屏障受损时帮助其修复闭合,维持大脑血脑屏障[17]。Nagamoto-Combs 等在恒河猴受到TBI 的大脑中发现,病变部位周围小胶质细胞还可以表达神经营养因子及其对应受体,在其长期的恢复过程中有营养性的作用[18]。在Willis 等的实验中,TBI 后重新填充增殖的小胶质细胞可以通过白细胞介素-6 促进海马神经细胞的发生,从而帮助TBI 后认知障碍的恢复[19]。对TBI 后神经免疫学范式转变时间点总结的综述也表明,在TBI 后的急性期,小胶质细胞的增多,有利于TBI 后期的恢复[20]。而在本研究中,在急性期通过TNS 治疗可使小胶质细胞增多,这可能增强了小胶质细胞对受损部位的吞噬、清除以及神经保护能力。
综上所述,TNS 作为一种安全、有效的治疗TBI 的手段,可以提高认知能力,其机制可能与提高TBI 后的自噬水平和小胶质细胞的清除保护能力,减轻Aβ 相关蛋白的负荷相关。
