酸性钒溶液中锰的脱除研究进展
2022-03-24张菊花常雨微惠旭杰
张菊花 ,梁 月 ,常雨微,惠旭杰
(1.武汉科技大学,钢铁冶金及资源利用省部共建教育部重点实验室,湖北 武汉 430081;2.武汉科技大学,省部共建耐火材料与冶金国家重点实验室,湖北 武汉 430081;3.武汉科技大学材料与冶金学院,湖北 武汉 430081)
0 引言
钒是一种重要的战略资源[1],主要赋存于钒钛磁铁矿和石煤中。钒钛磁铁矿精矿经过高炉-转炉得到钒渣[2],钒渣是工业提钒的主要原料,除V2O5外,钒渣还含有铁、锰、钙、镁、硅、铝等大量杂质。常用的提钒工艺一般有钠化焙烧-水浸提钒、钙化焙烧-酸浸提钒、亚熔盐法提钒、无盐氧化焙烧提钒、熔融钒渣氧化提钒和直接浸出法提钒等。相对于目前工业上技术相对成熟的钠化焙烧-水浸提钒而言,钙化焙烧-酸浸提钒是一项颇具有工业应用前景的提钒技术,其焙烧工序清洁高效、添加剂价廉易得、原料适用性强、废液和尾渣易于回收利用。钒渣经氧化钙化焙烧、酸浸处理,浸出过程中部分杂质如铁、铝可以在弱酸性范围内通过调节体系pH 控制其溶解度,并使其水解脱除,但是杂质锰在浸出过程中约10%~60%会进入到酸性钒溶液中,影响后续钒的沉淀率和钒产品的质量,所以要经过特定的净化处理,去除酸浸液中的锰。此外,生产过程产生的废水中含有高浓度的锰,排放到自然界中会对环境造成严重污染,并且造成大量资源浪费。脱除回收溶液体系中的锰一方面可以提高伴生矿中目标金属产品的质量,另一方面可以实现锰资源的回收利用,节约资源并大大降低重金属排放对环境造成的影响[3]。近年来,国内外关于溶液体系中锰的脱除进行了大量研究,但是针对于酸性含钒溶液中脱除杂质锰的研究鲜有报道。
锰的价态有很多,有0 到+7 价之间所有的价态。酸性钒溶液中杂质锰的浓度较高,主要以Mn2+的形式存在,且目标元素钒在酸性较高或碱性体系中均易与溶液中其他离子形成沉淀,给该溶液体系脱除锰带来困难。笔者梳理了关于酸性含钒溶液中锰脱除的研究现状,对近年来溶液体系中锰的脱除技术的研究进展进行综述,阐明了不同除锰方法的原理、脱除条件及脱除效果,目的是找到一种高效、高选择性、低成本的去除含钒酸浸液中杂质锰的方法。
1 酸性含钒溶液中杂质锰脱除条件的探讨
图1 是 25 ℃和100 ℃下的Mn-H2O 系E-pH关系,从图1 可见,无论温度为25 ℃或者100 ℃时,当pH 值高于7.6 之后,Mn2+就不能稳定存在。

图1 25 ℃和100 ℃下的Mn-H2O 系E-pH 关系Fig.1 E-pH graph for Mn-H2O system at 25 ℃ and 100 ℃
酸性钒溶液中杂质锰的脱除效率要综合考虑锰的脱除率和钒的损失率,同时要避免向体系中引入新离子。不同于镍、钴、锌等含锰溶液体系中,目标元素在pH<6.0 范围内均能以稳定的二价阳离子形式存在(如图2 所示)。钒溶液中钒的存在形式与体系pH 值关系密切,由图3 可知,当pH 值低于2.5 时,V(V)以阳离子VO2+形式存在,随着体系pH值升高,其质子化转化为钒酸,当pH 值大于4.5(100 ℃)或者5.0(25 ℃)时,钒酸逐渐去质子化转化为钒酸根阴离子,而这些阴离子极容易与溶液中的杂质离子Ca2+、Mg2+、Mn2+形成钒酸盐沉淀,同时体系中以正硅酸形式存在的杂质硅随着pH 升高,其聚合反应速率加快,pH 为5.0 时,其稳定性最差,凝聚时间最短。所以要想在尽量保证不损失钒的前提下回收溶液中的锰,就要适当的调整溶液体系的酸碱度和钒的浓度,避免溶液中钒转化成阴离子,避免溶液中杂质硅大量絮凝而产生无选择性吸附。所以,酸性钒溶液中杂质Mn 的脱除需在pH≤5.0 的范围内进行。上述原因为该溶液体系中杂质Mn 的高效、高选择性脱除带了诸多困难。

图2 25 ℃下Me-H2O 系E-pH 关系Fig.2 E-pH graph for Me-H2O system at 25 ℃

图3 25、55 ℃和100 ℃下的V-H2O 系E-pH 关系Fig.3 E-pH diagram for V-H2O system at 25,55 ℃ and 100 ℃
2 溶液体系中锰脱除的研究进展
近年来,关于溶液体系中杂质锰脱除的研究日益成熟,主要有化学沉淀法、萃取法、吸附法、电化学法和离子交换法等。这些研究为酸性含钒溶液中锰的脱除提供了新思路及技术指导。
2.1 化学沉淀法
2.1.1 高锰酸钾沉淀法
高锰酸钾是一种强氧化剂,可以把溶液中的二价锰氧化为二氧化锰,同时自身还原成二氧化锰沉淀,反应式为:
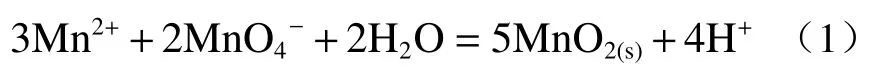
在酸性溶液中,高锰酸钾的氧化还原电位为1.69 V,在碱性的溶液中,高锰酸钾的氧化还原电位为1.14 V,低于酸性溶液中的氧化还原电位。所以高锰酸钾在酸性溶液中的除锰效果更佳。应皆荣[4]利用高锰酸钾去除酸性氧化钴溶液中的Mn2+,研究结果表明,一定用量的高锰酸钾在酸性条件下可以将溶液中的Mn2+氧化为二氧化锰沉淀,从而去除锰离子。周风云[5]利用高锰酸钾作为氧化剂去除硫酸镍浸出液中的锰,控制浸出液的pH 在4 左右时,锰的脱除率可以达到92%左右。陈莹博[6]利用高锰酸钾去除废旧锂电池正极材料酸浸液中的锰,研究发现,当溶液的pH 为5.5,反应温度为10 ℃,反应时间控制在10 min 左右时,溶液中的锰得以有效去除。
2.1.2 SO2/O2沉淀法
SO2是一种还原剂,适当比例的SO2/O2混合物是一种强氧化剂,可以有效地去除溶液中的锰[7]。主要反应机理为:

在pH 为1~6 和温度为25~80 ℃的范围内,Mn2+会自发的氧化为沉淀MnO2/Mn2O3,在pH<3 时,Mn2+的氧化速度较慢,pH>4 时,Mn2+的氧化速度迅速增加[8]。Zhang[9]利用SO2/O2氧化沉淀法对红土废液中的锰进行脱除。结果发现,在pH 为6~7 范围内,当锰含量小于10 mg/L 时,锰的去除率达到了99.5%。Menard[10]在80 ℃下向中性浸锌溶液中通入SO2和O2的混合气体来氧化沉淀锰,研究发现控制合适的SO2和O2的比例和气体流速等因素,SO2和O2混合气体可以有效地去除中性浸锌溶液中的锰。
2.1.3 氢氧化物和碳酸盐沉淀法
溶液中的金属离子以氢氧化物和碳酸盐形式沉淀脱除是湿法冶金中溶液净化的主要方法。Zhang[11]研究了通过NaOH 和NaCO3对典型红土镍矿废液中的锰进行去除和回收。在溶液温度为60 ℃,pH 为8 左右时,NaOH 和NaCO3对溶液中锰的去除与回收均有一定效果,锰的沉淀率达到了90%。Silva[12]利用石灰石去除低锰(16.5 mg/L)工业废水中的锰,研究发现使用粉末状的方解石灰石对锰的去除效果良好,溶液初始pH 影响除锰效果。当溶液初始pH 为5.5 时,溶液中锰的去除率仅有42.6%,当溶液pH 为8.8 时,锰的去除率达到了97%。Silva[13]又尝试用碳酸钠和石灰石混合物去除高锰(2 000 mg/L)矿井水中的锰,研究发现当溶液的pH 高于8.5 时,锰的去除率达99.9%。
2.1.4 CO2沉淀法
虽然碳酸盐沉淀被认为是一种有效的除锰方法,但这种传统方法所得碳酸锰沉淀物纯度低。有学者研究向高浓度含锰废液中鼓入CO2来回收其中的锰。MnCO3的溶度积低于CaCO3和MgCO3的溶度积,所以MnCO3沉淀更容易生成,反应机理如下[14]:的浓度随着pH 的升高而升高。根据式(13)和式(14)可以计算出碳酸锰完全沉淀时所需的理论pH 值为6.6,此时溶液中的接近饱和,如果pH 过高会生成难溶的CaCO3和MgCO3沉淀,从而影响了MnCO3沉淀的纯度。

在该溶液体系中,
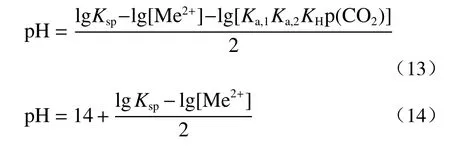
杜兵[15]利用CO2和氨水回收电解锰滤渣液中可溶性锰,用氨水调节电解液的pH 为7.5,此时锰的溶出率为75%左右;Wang[16]向电解锰滤渣液中同时鼓入CO2和氨气,发现氨气和CO2组合使用沉淀锰的效果较好,且在pH 为6~12 时锰的沉淀效果更好。杜冬云[17]和梅颖[14]利用CO2选择性分离含锰废水中的锰,研究发现当控制pH 为6.6 时,锰的回收率可达到99.79%。
2.1.5 过硫酸铵沉淀法
过硫酸铵是一种强氧化剂,可以将Mn2+氧化为继续与硫酸锰发生反应生成MnO2沉淀。反应式为:
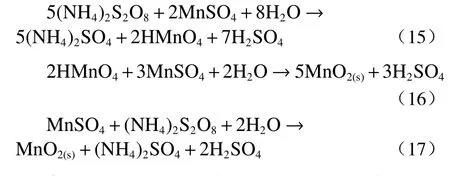
使用过硫酸铵去除溶液中的锰离子对溶液含锰量没有强制要求,但是其他条件例如体系pH 值要严格控制。过硫酸铵在ZnSO4溶液体系中应用较为广泛,并且表现出良好的除锰效果。范兴祥[18]选择过硫酸铵法去除ZnSO4溶液中的Mn2+,通过一系列的试验发现,最佳的pH 值为5.4,在此pH 下,Mn2+易被氧化为亚二氧化锰沉淀,但是若提高pH 值,使pH 超过5.6 时,硫酸锌水解会产生氢氧化锌沉淀。杨志锋[19]研究了过硫酸铵在湿法炼锌系统中的应用,发现pH 控制在5.2~5.4 范围内除锰效果最好,锰脱除率达到了95%以上。笔者以往研究[20]尝试将过硫酸铵作为氧化剂应用到酸性含钒溶液中以达到除锰的目的。研究发现,当反应温度为80 ℃,过硫酸铵的加量系数为1.0,搅拌时间为3 h,静置时间为3 h,pH 为5.0 的条件下,锰的去除率可达到85.44%,但与此同时,钒的损失率也达到了31.34%。
2.1.6 草酸盐沉淀法
在酸性条件下,草酸根离子易与溶液中锰离子结合生成溶解度较低的草酸锰沉淀,从而使得杂质锰从溶液体系中去除。有学者利用草酸盐去除酸性钒液中的锰,并对最佳试验条件进行了一系列探究。杨晓[21]利用草酸钠、草酸钾和草酸铵去除提钒酸浸液中的锰,通过一系列的试验对比发现,草酸铵、草酸钠和草酸钾的除锰效果接近,但是草酸铵作为除锰剂时,钒的损失率很高。草酸钠和草酸铵的除锰率相近,但是草酸钠的成本较低,所以草酸钠是最合适的除锰剂,在pH 为3、反应温度为20 ℃、反应时间为60 min 的条件下,除锰率可达到92%,钒的损失率达到0.5%以下。笔者采用草酸作为除锰剂回收酸性沉钒母液中的锰离子,研究[2]发现,当溶液的pH 从2.0 上升至4.0 时,除锰率也随之上升,从20%提高到75%,再增大pH 值,除锰率无太大波动。草酸加量系数增加,锰回收率也随之增加,α=n(C2H2O4)/n(Mn2+)=1.5 是最佳草酸加量系数。若草酸加入量过多,则后期会消耗大量的过氧化氢来去除溶液中残留的草酸,成本太高。反应温度和反应时间对锰的回收率也有一定影响,当反应温度控制在50 ℃,反应时间控制在60 min 时,除锰率最高。所以,pH 为4.00±0.05,加量系数为1.5,反应温度为50 ℃,反应时间为60 min 时,除锰率最高,达到94%以上。
2.2 萃取法
溶剂萃取是从溶液中分离各种组分的有效方法,利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一溶剂所组成的溶液里提取出来。不同的溶液体系需选择不同的萃取剂。
田青云[22]等人利用P204(二乙基己基磷酸酯,D2EHPA)对高锰含铬溶液进行处理,去除溶液中的锰。研究发现当pH 在1.0~4.5 范围变化,pH 值为3.5 时,萃取效果最好。Hossain[23]利用改性二乙基己基磷酸酯(D2EHPA)去除钴电解液中的锰,通过引入Co2+,将D2EHPA 转化为Co-D2EHPA 来萃取溶液中的锰离子。研究发现,当pH 达到3.5 时,体积浓度为25%的Co-D2EHPA 可以去除溶液中70%以上的Mn,且不会影响钴的回收率,当pH>5,锰的去除率会提高,但钴的损失率达10%,所以最佳pH 值为3.5。
在提钒工艺中,萃取法常用于含钒浸出溶液的净化,通过选用不同萃取剂、反萃剂、稀释剂等对含钒溶液进行净化除杂,将钒与锰、镁、铝等杂质分离。郭秋松[24]为制备超纯硫酸氧钒溶液,采用D2EHPATBP-磺化煤油作为协同萃取体系,通过三级逆流萃取及二级逆流反萃取,脱除硫酸浸取石煤获得的含钒溶液中的铁、锰、铬杂质。探究初始pH 值、相比、反萃综合条件等因素对萃取过程的影响。结果表明,调整初始溶液pH 值为2.6,相比为2∶1,对载钒有机相用低浓度纯钒液洗涤后,用0.6 mol/L 硫酸在相比为2∶1 条件下进行反萃取,铁、锰、铬等杂质去除率为99.1%。
2.3 离子交换法
离子交换法是借助固体离子交换剂中的离子与溶解在溶液或气体中的离子进行交换,当液相中的锰离子被离子交换剂吸附于其表面时,离子交换剂随后释放出等价离子到溶液中,从而达到除锰的目的。离子交换树脂按照化学活性基团的种类可以分为阳离子树脂和阴离子树脂两大类,它们可分别与溶液中的阳离子和阴离子进行离子交换。离子交换树脂吸附Mn2+的过程如下:

其中,R-树脂母体;M+-树脂上可交换的离子。
庄海波[25]采用Sinco-430 型阳离子交换树脂脱除磷酸中的锰离子,考察了流量、磷酸溶液初始锰浓度、温度对吸附效果的影响。研究发现:增大进液流量、提高溶液初始锰浓度以及升高温度均有利于缩短树脂饱和时间,但进液流量的增大会降低树脂的吸附率,而温度的升高则会降低树脂的饱和吸附量。张翔宇[26]通过静态吸附试验、中试动态试验的方法,研究了不同类型离子交换树脂对锰离子的吸附性能及回收特性。对比了D113、732 和D851三种同类型吸附剂对Mn2+的吸附能力,结果表明:D851 树脂性能最优。Kononoval[27]等人研究了利用长链交联剂(LCA)合成的阳离子和阴离子交换剂回收不同酸碱度的溶液中的Cr6+和Mn2+。研究发现,这种交换剂具有很好的离子渗透性、选择性和动力学性能。表1 为浓度为5 g/L 的锰离子在酸性水溶液中的吸附情况,所有的阳离子交换剂对锰的吸附能力都很高。在阳离子交换剂KB-2M 和KB-2T 上观察到Mn2+的定量回收,分别与DVEDEG(7%)和TVEPE (4%)交联。其他树脂对锰离子的吸附率大于90%。然而,锰在阳离子交换剂KB-2D(交联剂DVB)上的吸附率不超过78%~82%。
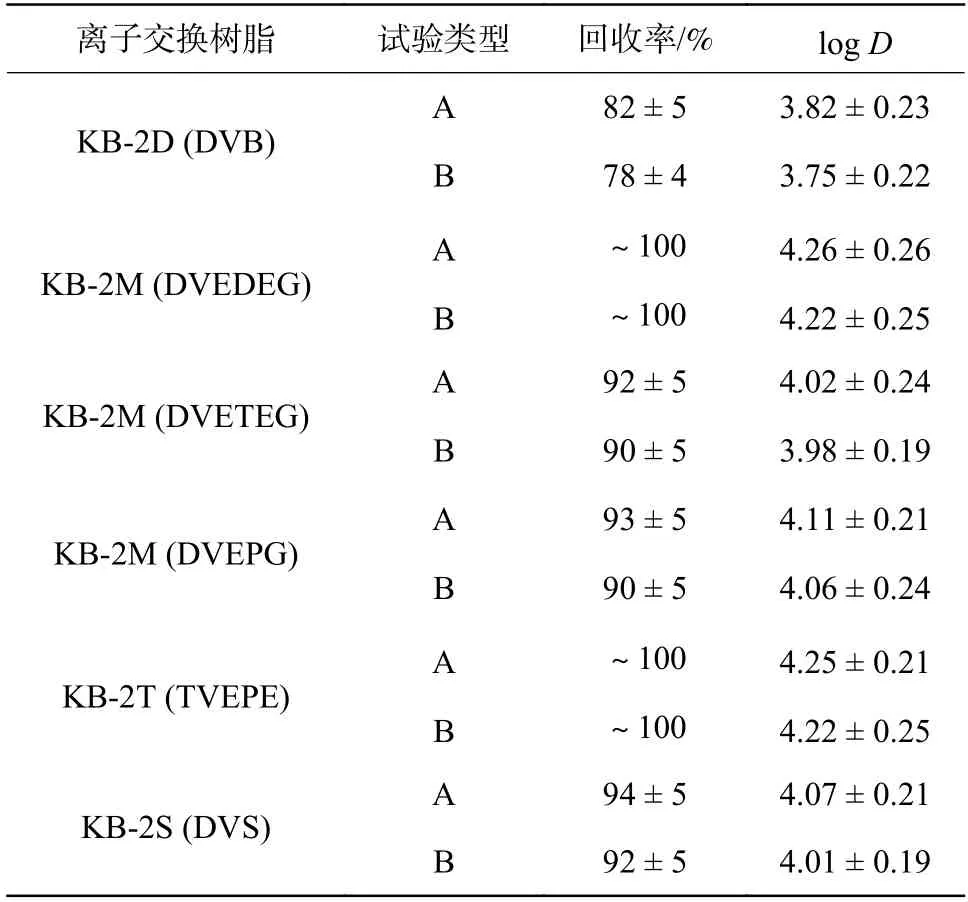
表1 不同酸度水溶液中锰的吸附回收率Table 1 Sorption recovery of manganese (II) from aqueous solutions with different acidity
在提钒工艺中,离子交换法常用于含钒浸出溶液的净化。通过离子交换剂吸附含钒溶液中的钒,使其与溶液中的杂质离子分离以达到净化目的。万洪强[28]研究发现,在低酸条件下,型D301 树脂对石煤酸浸液中钒的吸附能力较强,平衡吸附容量达272 mg/g。当浸出液pH<2.5 时,钒同时存在阴离子和阳离子状态,不同的pH 值会改变其状态平衡关系,pH 值越高,吸附能力越大。
2.4 吸附法
吸附是一种物质从液相转移到固体表面并通过物理化学作用结合到一起的过程。吸附剂有很多种,如活性炭、聚合物吸附剂和一些天然吸附剂,其吸附特点和吸附效果均不同,不同酸碱度溶液中选用的吸附剂类型也不同。
Goher[29]研究了颗粒活性炭(GAC)和AmberliteIR-120 H(AIR-120 H)对排入伊斯梅利亚运河的废水中的铝、铁和锰的去除效果。通过间歇平衡试验发现,在室温下,pH 为7,接触时间为30 min时除锰的效果最好,可以达到96.65%。García[30]采用经NaCl 溶液改性处理的沸石凝灰岩去除水溶液中的锰,试验发现除锰的最佳pH 为6。Muhammad[31]以家禽粪和农家肥料衍生的生物炭作为吸附剂去除水溶液中的锰,结果表明,在pH 值为6、温度为25 ℃、接触时间为3 h 时的吸附效果最好,并且吸附等温线符合Freundlich 模型。Nevenka[32]以塞尔维亚矿床的天然沸石凝灰岩作为吸附剂吸附水中的锰离子,研究表明锰离子主要吸附在斜沸石内。在25 ℃下,吸附等温线可以用Langmuir-Freundlich 或Sips 模型来描述,符合二阶模型。当pH 值从3 升高至6 时,锰离子的吸附量逐渐增加。当pH 大于6 时,吸附量有所下降。
2.5 电化学法
电化学法是一种有效的处理重金属废水的方法,并且其运行成本低,基本不需要添加其他化学物质,不会造成二次污染。电化学法中常用的阳极材料是铝和铁,在电场作用下金属电极产生的阳离子形成“微絮凝剂”-铁或铝的氢氧化物,这种絮凝剂可以使水中的颗粒和一些胶体污染物凝聚在一起,或者沉淀并吸附污染物颗粒[33]。
贺宁[34]等人使用周期换向电凝法来处理含锰废水,并且探究了pH、电流密度、初始浓度对除锰效果的影响。结果表明,初始pH 值越高,除锰效果越好,最佳pH 为9,但是pH 过高会影响废水中其他离子的絮凝效果。另外废水中锰含量越高除锰效果越好。Ganesan[35]采用电凝法去除工业废水中的锰,以镁为阳极,镀锌铁为阴极,当pH 为7,除锰率可达97.2%。Shafaei[36]以铝为电极,运用电凝法去除废水中的锰,研究了初始pH 值、外加电流密度、电解时间、溶液电导率和初始金属浓度对除锰率的影响。研究结果表明锰离子直接在阴极表面进行还原,通过水解与氢氧化铝形成氢氧化物,最佳的pH值为7,溶液电导率对除锰率没有明显作用,但初始电导率很高,可降低能耗。当锰含量很高时(400 mg/L),电混凝的效率会降低,但锰离子的去除量增加。陈燕[37]采用电解法处理工艺,回收提钒废水中的锰,实现金属锰的资源化利用。研究发现,控制电流密度150~350 A/m2、温度40 ℃、槽电压小于6 V、阴极pH 值为7.0~8.5,通过向阴极区泵入新液以保持阴极区Mn2+在46 g/L,电解24 h 可以将99%以上的锰提取出来。
上文综述了溶液体系除锰方法以及应用实例,除锰方法有很多,但并不是每种方法都适用于酸性含钒溶液体系。需要综合酸性含钒溶液体系pH、含锰量以及是否具备经济和环保效益等条件,多方面综合考量此方法是否适用。
3 酸性含钒溶液杂质锰高效脱除的可行性分析
去除酸性含钒溶液中的锰时,必须保证不引入Na+、K+等新的杂质离子,并且保证整个除锰过程中溶液体系pH≤5.0,避免钒液中杂质离子如Mn2+、Ca2+、Mg2+与钒酸根阴离子反应生成钒酸盐沉淀以及溶液中Si4+形成胶体吸附溶液中的钒,否则会影响后续的钒沉淀率、氧化钒的纯度以及沉钒母液的循环利用。上文已综述溶液体系中常用的除锰方法有化学沉淀法、萃取法、吸附法、电化学法和离子交换法等。
高锰酸钾作为强氧化剂对于酸性溶液中锰的脱除具有一定效果,但高锰酸钾的用量难以控制,添加过多的高锰酸钾会出现“返锰”现象,影响除锰效果。另外,利用高锰酸钾除锰向酸性含钒溶液中引入了新的杂质K+,后期难以脱除,在铵盐沉钒过程中与产生竞争,导致产品中K 含量升高,所以并不适用于脱除酸性含钒溶液中的锰。氢氧化物水解沉淀、碳酸盐沉淀和CO2沉淀脱除锰所需pH 远高于5.0,我们已知脱除酸性含钒溶液中杂质锰的首要条件是整个过程溶液体系pH≤5.0,所以这些方法并不符合条件。SO2作为还原剂极易将酸性含钒溶液的高价钒还原成低价钒,并且此方法适用于pH>5.0 的溶液。草酸能够在弱酸性范围内高效除锰,但其与SO2/O2一样,更适于脱除沉钒母液中的锰。如式(19)~(22)所示,V(V)转化为V(IV)和V(III)的标准电极电位远高于采用这两种方法分离锰以净化酸性含钒溶液的同时,会使溶液中五价钒还原为低价钒,而后续沉钒工序中又需将低价钒全部转化为五价钒,这使整个工艺流程的工序更加复杂,且原辅料消耗增加,成本升高。

由上文研究可知,过硫酸铵氧化法在酸性含钒溶液中有一定的除锰效果,并且整个除杂过程pH值均在5.0 以下,符合脱锰条件。另外,与高锰酸钾等其他氧化试剂相比,利用过硫酸铵除锰不会引入钾离子等难处理的杂质离子,因为在后续沉钒过程中也要引入铵根离子,所以产生的铵根离子并没有对溶液体系本身造成太大的影响。但是据目前的研究来看,过硫酸铵氧化法除锰面临的最大问题是其选择性不佳,造成除锰过程中钒损失率较高,所以如何保证提高除锰率的同时将钒的损失降到最低是目前急需解决的问题。
离子交换法具有选择性强、富集比高、工作环境好等优点。在提钒工艺中,离子吸附常用于含钒浸出液的净化与分离。浸出液中五价钒酸根阴离子可与树脂上的阴离子交换基团相互交换,从而与杂质离子分离。以目前研究来看,去除溶液体系中的杂质锰通常使用阳离子树脂交换溶液体系中的Mn2+,然而当酸性含钒溶液的pH<2.5 时,溶液中钒的离子存在形式较为复杂,阴离子和阳离子共存,如果选用阳离子交换剂除锰,在一定程度上会导致一部分钒离子被交换,从而造成钒的损失。另外,离子吸附容量小,并且耗时久。
溶剂萃取法选择性强、处理能力大、平衡速度快,在溶液体系除锰和净化除杂酸性含钒溶液方面都表现出了良好的效果。上文已有研究表明,在pH为2.6 左右时,选用D2EHPA-TBP-磺化煤油协同萃取剂,通过二段协同萃取方式可以净化酸性含钒溶液,使溶液中铁铬锰有效去除。然而在酸性条件下,为了提高萃取体系对钒与铁之间的选择性,通常在进行萃取前使用还原剂将溶液中的钒还原为四价钒,沉钒时又需将四价钒再次氧化为五价钒,使净化工序流程变长、成本増高。另外,当酸性钒液中杂质Al、Si 含量较高时,溶剂萃取过程易出现三相、浑浊等现象。
吸附剂吸附除锰为物理吸附,选择性较差。利用吸附剂处理酸性钒溶液中的杂质锰时,会将钒离子同杂质锰一同吸附上来,造成钒的大量损失。吸附法多用于处理高浓度的重金属废水,并不适用于溶液净化工序。如果利用电絮凝法处理酸性钒液中的锰,阳极和阴极分别发生氧化还原反应产生絮凝剂吸附溶液体系中的锰,由于絮凝剂的选择性很差,会将溶液体系中的钒一并吸附上来,造成大量钒损失。另外,电化学法除锰能耗大,电流效率很低,并不符合当下节能减排的环保要求。
综上所述,在酸性钒液脱锰研究中,过硫酸铵氧化法、萃取法和离子交换法在一定程度上具有良好的脱锰效果。通过试验探究过硫酸铵、萃取剂和离子交换剂等条件,以达到“保钒除锰”的目的。另外若单一萃取剂或离子交换剂并不能达到良好的试验效果,可以尝试多种萃取剂或离子交换剂进行联合使用。
4 结论
总结来说,去除酸性含钒溶液中的锰时,必须保证不引入Na+、K+等新的杂质离子,并且保证整个除锰过程中溶液体系pH≤5.0。溶液体系中常用的除锰方法有化学沉淀法、萃取法、离子交换法、吸附法和电化学法等。
就目前的研究来看,吸附法、电化学法、高锰酸钾沉淀法、SO2/O2沉淀法、氢氧化物和碳酸盐沉淀法、CO2沉淀法和草酸盐沉淀法并不是很适用于酸性含钒溶液中锰的脱除。过硫酸铵氧化法、萃取法和离子交换法在理论上对于脱除酸性含钒溶液中杂质锰可行。最佳脱除方案仍需根据溶液体系的pH等条件展开进一步探究。
酸性含钒浸出液中锰的有效脱除为后续净化沉钒等工作提供了便利,同时也为钙化提钒清洁制备五氧化二钒工艺进一步发展与应用提供一种新思路和理论依据。
