超声与CT检查在诊断甲状腺乳头状癌颈部淋巴结转移中的对比分析
2022-03-23赵佳航罗渝昆何红莹汪龙霞
赵佳航,张 艳,罗渝昆,唐 杰,兰 雨 ,何红莹,肖 静,李 文,汪龙霞
1解放军医学院,北京 1008532中国人民解放军总医院第一医学中心超声诊断科,北京 100853
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)通常生长缓慢,预后较为良好,但20%~60%的患者可发生颈部淋巴结转移(cervical lymph node metastasis,CLNM)[1]。局部转移淋巴结的浸润及压迫可影响患者生存率[2]。目前关于分化型甲状腺癌的治疗方式仍存在争议,而术前对CLNM的诊断是解决问题的关键。超声和计算机断层扫描(computed tomography,CT)是临床上常用的影像学检查方法,但既往研究中两者对于颈部淋巴结的诊断效能存在差异。本研究通过回顾性收集PTC患者的术前超声及CT检查资料,比较两者在诊断PTC颈部淋巴结转移中的价值,并探讨其联合诊断的效能。
对象和方法
对象选取2016年1月至2021年1月于中国人民解放军总医院行外科治疗且病理确诊为PTC的患者,术前均行超声和CT检查。所有患者均行颈部中央区淋巴结清扫,若术前超声和/或CT提示颈侧区存在可疑淋巴结,则对相应部位淋巴结进行清扫。以术后病理结果为金标准判断有无颈部淋巴结转移。排除标准:(1)患者临床资料不完整;(2)有其他恶性肿瘤病史(如肺癌、乳腺癌、头颈部恶性肿瘤等);(3)CT或超声图像质量差;(4)手术未行淋巴结清扫者;(5)既往颈部手术、放疗和化疗史。最终纳入322例甲状腺癌患者,其中,男性112例,女性210例,平均年龄(45.76±12.24)岁(13~80岁)。本研究经中国人民解放军总医院伦理委员会批准(S2021- 123- 01)。
影像学检查方法超声检查采用飞利浦EPIQ7、IU22和飞依诺VINNO V70高分辨率超声仪器,探头频率为7~12 MHz。患者取仰卧位,对双侧颈部I~VII区淋巴结进行全面的检查,保存每个颈部平面有代表性的灰阶和彩色多普勒图像。CT检查采用西门子SOMATOM Definition双源CT扫描仪。患者取仰卧位,扫描范围从颅底至主动脉弓水平,层厚3.0 mm。用高压注射器以2~3 ml/s流速经肘静脉团注碘普罗胺注射液80 ml,延迟35~40 s行增强扫描。超声和CT检查的间隔时间不超过3个月。
诊断标准超声诊断颈部淋巴结转移的判断标准[3]:(1)淋巴结内有微钙化;(2)淋巴结内有液化或囊性区;(3)淋巴结长径短径比(L/S)<2,呈圆形或类圆形;(4)淋巴门消失;(5)淋巴结内出现团块样高回声;(6)血供丰富或较丰富,出现边缘型或混合型血流。淋巴结具备(1)和(2)中任意1项,或具备(3)~(6)中的2项或2项以上,诊断为转移性淋巴结。CT诊断颈部淋巴结转移的判断标准[4- 5]:淋巴结为明显强化(CT值≥40 HU)或不均匀强化、短径>1 cm、有囊性变、微钙化,当出现上述可疑特征之一时,诊断为转移淋巴结。由2名中级及以上职称的超声科医师和2名放射科医师采用盲法对超声和CT图像进行分析和诊断。当判读结果不一致时,由同专业的2名医生协商一致后确定。
颈部淋巴结分区参考《中国浅表器官超声检查指南》[6]将头颈部淋巴结自上而下分为7个区域:Ⅰ区即颏下和颌下淋巴结;Ⅱ~Ⅳ区分别为颈内静脉淋巴结上、中和下组;Ⅴ区即颈后三角区淋巴结;Ⅵ区即颈前中央区淋巴结,包括喉前、气管前和气管旁淋巴结,上界为舌骨,下界为胸骨上切迹;Ⅶ区为前上纵隔淋巴结,包括气管前、气管旁和气管食管沟淋巴结,上界为胸骨上切迹,下界为无名动脉。其中Ⅵ区又称中央区,Ⅰ~Ⅴ区又称颈侧区。
颈部淋巴结分区的良恶性划分:在超声或CT图像上,若某一颈部淋巴结分区内无转移淋巴结征象,则该区域定义为转移淋巴结阴性;若某一颈部淋巴结分区内存在转移淋巴结征象,则该区域定义为转移淋巴结阳性。当超声或CT任何一个检查提示颈部分区内转移淋巴结阳性时,超声联合CT的诊断结果视为阳性,均无转移淋巴结阳性则诊断结果视为阴性。
统计学处理采用SPSS 21.0和MedCalc 9.3软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;计数资料的组间比较采用χ2检验。组间灵敏度、特异度及准确性的比较采用McNemar检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)评价超声、CT和超声联合CT对颈部转移淋巴结的诊断效能,三者AUC之间的比较采用Z检验。P<0.05为差异有统计学意义。
结 果
一般情况322例患者中,160例行中央区+患侧颈侧区淋巴结清扫,4例行中央区+对侧颈侧区淋巴结清扫,55例行中央区+双侧颈侧区淋巴结清扫,103例仅行中央区清扫。病理结果显示:242例患者存在CLNM,其中64例为中央区CLNM,30例为颈侧区CLNM,148例为中央区及颈侧区CLNM;80例无CLNM。患者年龄(χ2=20.34,P<0.001)、原发灶最大径(χ2=27.34,P<0.001)在CLNM组与非CLNM组之间的差异有统计学意义。颈侧区CLNM组的淋巴结最大径大于非CLNM组,差异有统计学意义[(1.72±0.95)cm比(1.13±0.48)cm;χ2=4.30,P<0.001],而中央区淋巴结最大径在CLNM与非CLNM组之间的差异无统计学意义[(0.83±0.38)cm比(0.91±0.38)cm;t=-1.00,P=0.330](表1)。
超声及CT对PTC颈部淋巴结转移的诊断情况2名超声科医师和2名放射科医师对PTC颈部淋巴结转移的诊断组内一致性良好(Kappa值分别为0.80、0.82)。在中央区、颈侧区和中央区+颈侧区,超声诊断CLNM的灵敏度(χ2=82.26,P<0.001;χ2=114.01,P<0.001;χ2=82.26,P<0.001)、准确度(χ2=20.27,P<0.001;χ2=15.56,P<0.001;χ2=44.00,P<0.001)均高于CT,与超声联合CT间差异无统计学意义(P均>0.05);而超声诊断中央区和颈侧区CLNM的特异度低于CT(χ2=17.01,P<0.001;χ2=21.29,P<0.001),但在中央区+颈侧区两者差异无统计学意义(χ2=3.28,P=0.070)。此外,单一超声或CT诊断颈侧区CLNM的灵敏度(χ2=15.34,P<0.001;χ2=3.89,P=0.049)、准确度(χ2=4.06,P=0.040;χ2=6.62,P=0.010)均高于中央区。
ROC曲线分析结果显示,在中央区、颈侧区和中央区+颈侧区,超声诊断CLNM的AUC均高于CT(Z=2.99,P=0.003;Z=3.86,P<0.001;Z=4.47,P<0.001)(图1),与超声联合CT间差异无统计学意义(Z=1.87,P=0.062;Z=1.68,P=0.093;Z=1.61,P=0.107)(表2)。单一超声或CT诊断颈侧区CLNM的AUC(Z=3.58,P<0.001;Z=2.71,P=0.007)高于中央区。
超声与CT诊断不一致病例分析在242例病理证实为CLNM的患者中,超声诊断正确而CT漏诊93例(38.43%)(图2、3),CT诊断正确而超声漏诊8例(12.50%)。在80例病理证实为非CLNM的患者中,超声诊断正确而CT误诊7例(8.75%),CT诊断正确而超声误诊12例(15.00%)。
讨 论
超声对于甲状腺结节的诊断具有显著优势,是国内外公认的甲状腺结节的首选检查方法,诊断准确度优于其他影像学检查,CT目前作为诊断PTC的检查手段之一,在临床中也较常应用[7]。淋巴结是甲状腺检查中必须评估的项目之一,因其与甲状腺结节的性质及预后密切相关,是临床决策的重要依据。关于超声及CT对于PTC颈部淋巴结转移的诊断价值已有不少研究,但结论尚存争议[8- 9]。
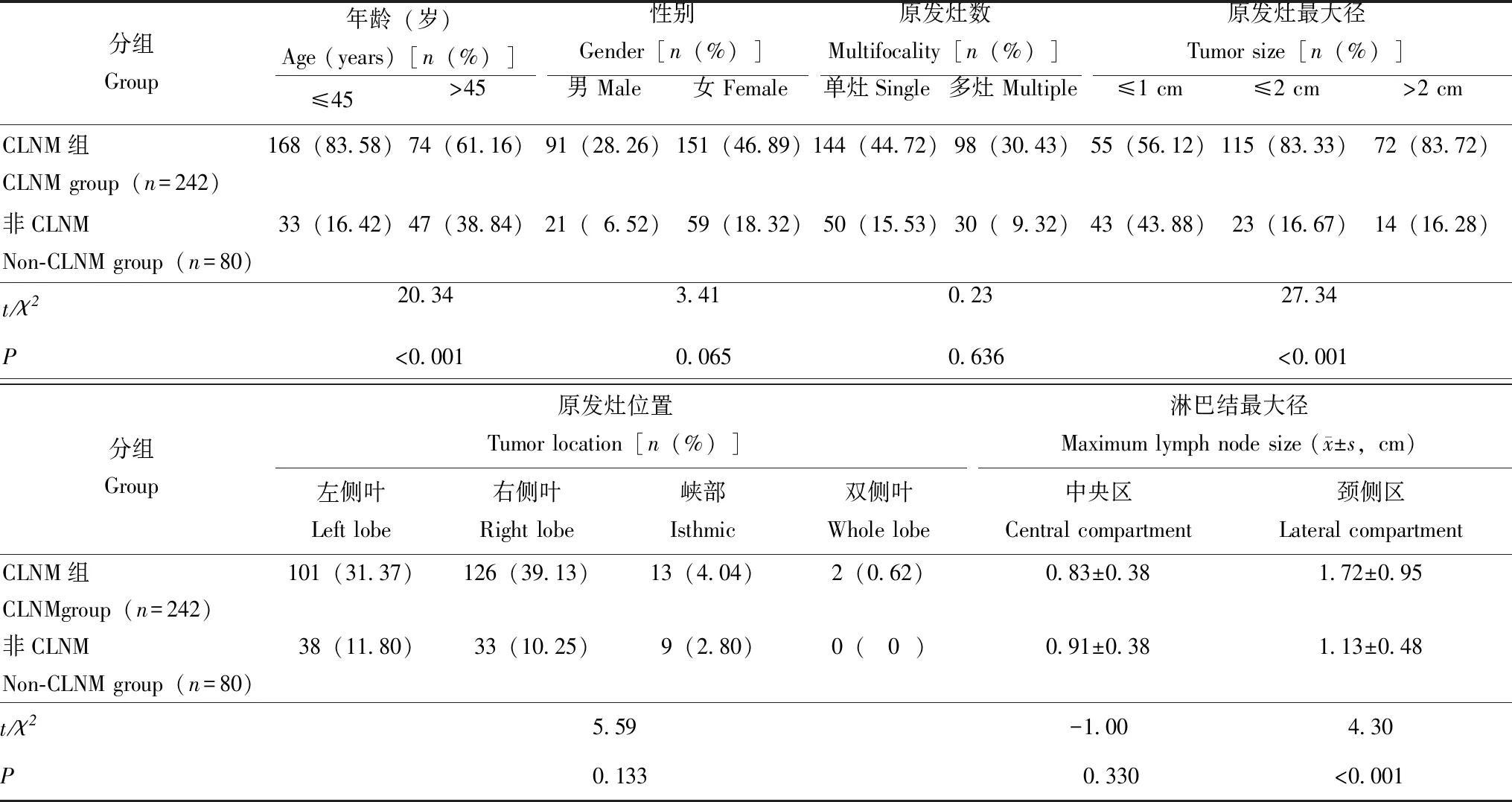
表1 322例甲状腺乳头状癌患者的一般情况
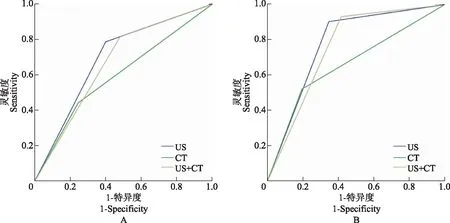
US:超声;CT:计算机断层扫描;US+CT:超声联合计算机断层扫描
PTC患者淋巴结转移风险与患者年龄密切相关[10- 11],本研究中年龄≤45岁组比>45岁组有更高的淋巴结转移率,这与既往研究结果[12- 13]相符。原发灶大小是影像学检查容易获得的参数,有研究表明,原发灶越大,颈部淋巴结转移的风险越高[14- 15]。本研究结果显示原发病灶>1 cm的患者淋巴结转移率更高。因此,对于年龄≤45岁,原发灶>1 cm的PTC患者,应注意对淋巴结的仔细检查。此外,本组研究显示在颈侧区CLNM组的最大径大于非CLNM组(P<0.001),而在中央区淋巴结的最大径在CLNM组与非CLNM组之间的差异无统计学意义(P=0.330),这可能与生长空间受限有关,造成了该区域检出率低的情况。
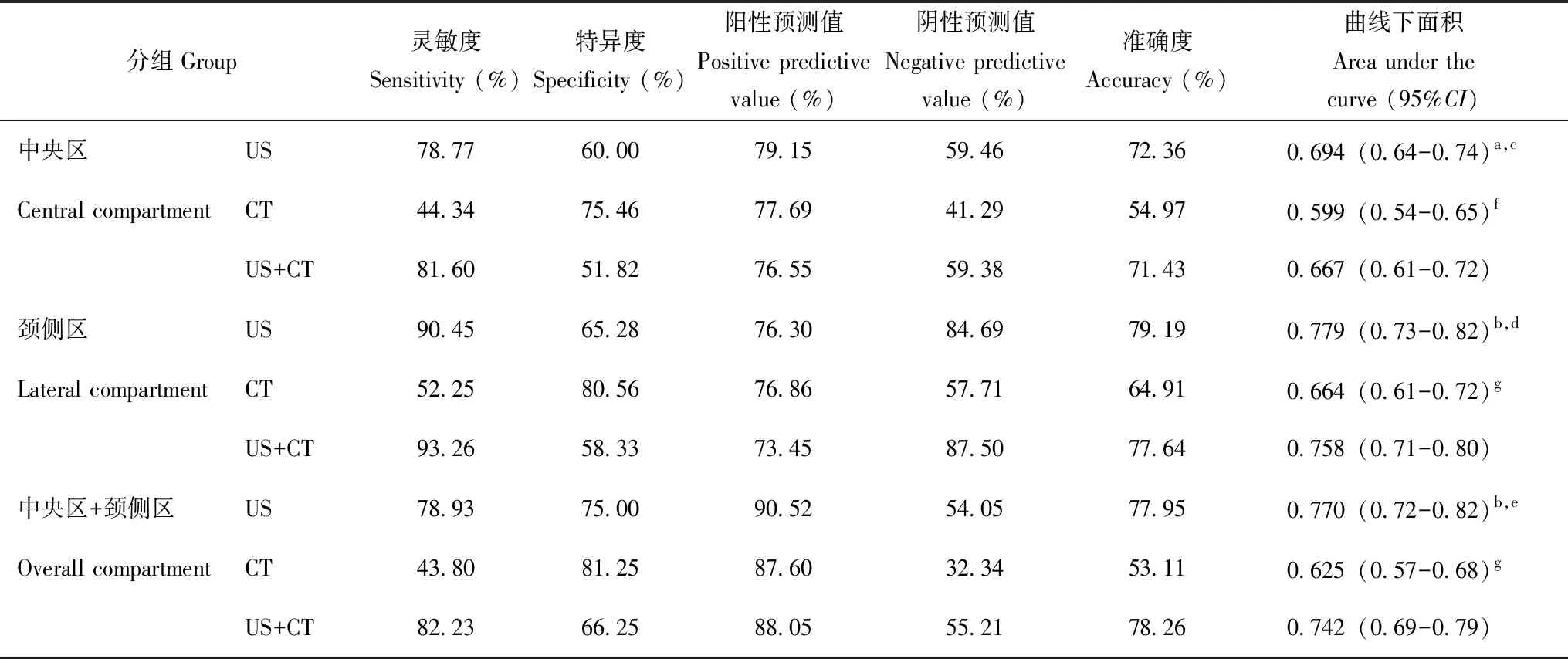
表2 超声、CT及超声联合CT对甲状腺乳头状癌颈部淋巴结转移的诊断准确性的比较
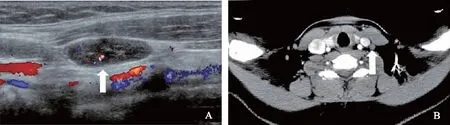
A.转移淋巴结(箭头)形态规则,内可见微钙化和点状血流;B.转移淋巴结(箭头)形态规则,内部呈均匀强化
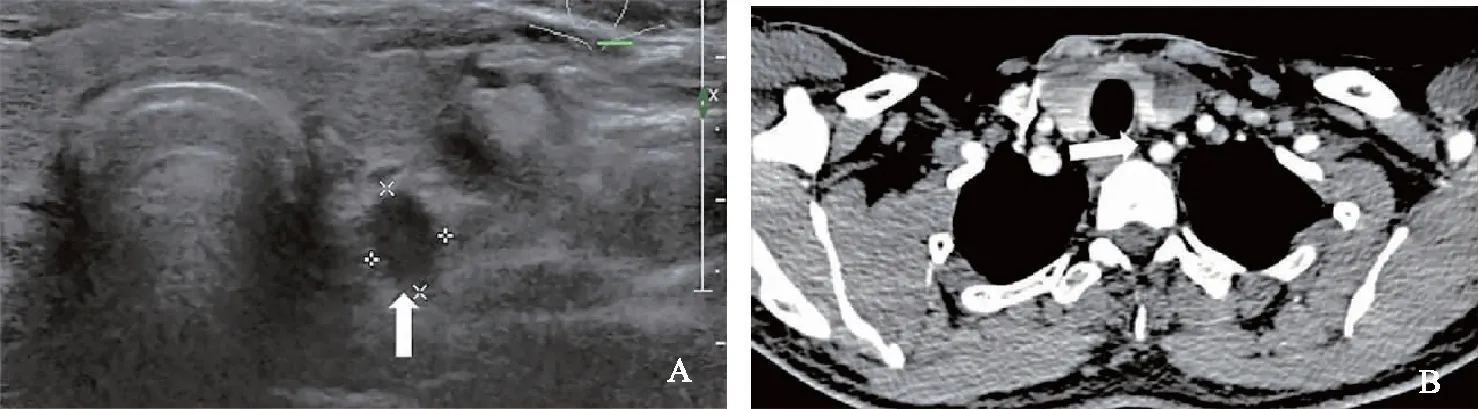
A.转移淋巴结(箭头)边界欠清晰,淋巴结长径短径比<2,其内未见微钙化;B.相同区域未见异常淋巴结(箭头)
就诊断能力而言,本研究将颈部淋巴结按照区域进行对比研究,结果显示,超声在中央区、颈侧区和中央区+颈侧区诊断CLNM的灵敏度、准确度及AUC均优于CT。高频超声对于浅表淋巴结具有良好的分辨率,基于超声波的声学特性和成像原理,能够清晰地发现由液化性坏死、凝固性坏死及胶体析出导致的囊性变、微钙化和不均匀高回声等声阻抗差值较大的界面,且有研究指出在发现CLNM中是否存在微钙化和囊性变方面,超声比CT具有更高的灵敏度[16]。超声还能显示淋巴结内部及周边粗细不均、形态扭曲的血流[17],从而准确捕捉到有价值的CLNM声像图特征[18],此外,实时动态扫查也是其诊断的优势之一。而CT诊断CLNM的特异度优于超声,行增强CT检查时,因PTC颈部转移淋巴结具有与甲状腺相同的吸碘特性,内部及周边血供丰富,在注入对比剂(碘普罗胺注射液)后可出现明显的强化或不均匀强化[19],且形态常不规则,而非转移淋巴结常表现为无明显强化,且形态规则。增强CT通过区分淋巴结的强化程度差异及形态异常[20- 21],获得对CLNM较好的诊断能力。
此外,超声及CT对颈侧区转移淋巴结的诊断效能均优于中央区。因中央区淋巴结位置深,直径小,易发生微转移,常不具备转移淋巴结的典型影像学特征[22],故超声和CT识别难度均较大。CT因扫描时层厚的限制及软组织分辨率较低,其无法对最大径<5 mm的淋巴结性质进行准确判断[5],其次,如吞咽运动伪影、颈椎及锁骨高密度影产生的硬化束伪影等颈部平面伪影也可掩盖病变[23],为诊断带来难度。相对而言,超声诊断中央区CLNM比CT敏感[24],高分辨率超声可以检出2~3 mm的小淋巴结,通过调节声波频率、图像深度及增益补偿等参数,多方位多角度灵活扫查可以发现隐匿的中央区淋巴结,因此,需要操作医生提高警惕,并具备熟练的扫查技术。
通过对超声和CT诊断不一致的病例分析发现,超声对CLNM诊断高灵敏度的同时,对非CLNM的误诊也相对较多。临床上,颈部淋巴结增大及回声异常的情况可见于多种疾病,例如自身免疫性甲状腺炎、免疫性淋巴结炎及其他头颈部炎症等[25]。炎症较重时淋巴门结构显示欠清或结核性淋巴结出现陈旧性钙化灶也可导致淋巴结良恶性鉴别困难,从而引起误诊[26]。与超声不同的是,除了淋巴门消失及微钙化等超声和CT均可识别的典型CLNM的影像学特征外,CT还可以通过淋巴结强化程度的差异来鉴别异常淋巴结,在识别非CLNM方面具有一定优势,因此,对于存在自身免疫性炎症、头颈部炎症或结核病等的可疑病灶,可联合CT进一步诊断。
本研究尚存在一定的局限性:(1)术前影像学检查显示的颈部淋巴结与术后病理淋巴结无法保证一一对应,只能评估区域淋巴结诊断的效能,有待前瞻性研究进一步验证。(2)本组病理结果未见Ⅶ区转移淋巴结的病例,因超声对此区域扫查受限,选择病例的偏倚可能低估CT的诊断效能,有待扩大样本量进一步深入探讨。
综上,与CT检查相比,超声在颈部淋巴结的诊断中更具优势,临床实践中应提高警惕,对高风险人群进行重点检查,对超声诊断不确定的病例可行CT检查进一步补充诊断。
