妊娠合并垂体催乳素腺瘤6例临床特点分析
2022-03-23和鑫玫李珊珊陈梦圆张杰平
和鑫玫,李珊珊,陈梦圆,张杰平,王 瑜
(1.河南大学人民医院,郑州 450000;2.恩施州中心医院,恩施 445000;3.河南大学第一附属医院,开封 475000)
垂体催乳素腺瘤(pituitary prolactinoma)约占垂体腺瘤的30%,且约占功能性垂体瘤的50%~60%[1]。垂体催乳素腺瘤是指由于瘤体过度分泌催乳素(prolactin,PRL),导致女性月经紊乱、不孕、排卵障碍等一系列疾病,多发于20~50岁左右的育龄期女性,且90%以上为直径<10mm的微腺瘤[2-3]。目前,催乳素瘤在临床上有发病率增高的趋势。当血清PRL大于2000mU/L时,应高度怀疑是肿瘤所致。妊娠状态时,胎盘分泌的高雌激素水平可导致垂体前叶催乳素细胞受到刺激,垂体体积可比孕前增大2倍,并出现PRL分泌持续增多。肿瘤增大可能导致神经系统出现压迫症状,如头痛、晕厥及视野缺损等,严重者甚至会因为肿瘤的不断生长扩大,瘤体突然出血或坏死,出现头痛、视力模糊、意识不清、血压下降等一系列并发症,称为垂体卒中。因此,妊娠期垂体腺瘤的治疗与管理需要关注。现通过总结河南省人民医院收治的6例妊娠合并垂体催乳素腺瘤患者的病例资料,探讨妊娠合并催乳素腺瘤患者的管理与治疗。
1 资料与方法
回顾分析2017年12月1日至2021年5月1日河南大学人民医院收治的6例妊娠合并催乳素腺瘤患者的临床资料。
病例1,女,37岁,以“停经8+月,间断胸闷头晕1+月,加重2天”为主诉入院。10年前因月经不规律,检查发现垂体微腺瘤,规律口服溴隐亭(Bromocriptine,BRC)治疗,PRL控制在25ng/mL以下,月经规律来潮。G3P1,人工流产1次,剖宫产1次。确认妊娠后停药。一般情况:神志清,精神差,双侧瞳孔等大等圆,心肺听诊无异常,腹膨隆,双下肢水肿。神经系统查体未见异常。入院后行垂体MRI示(图1A)垂体右份微腺瘤可能。入院后给予促胎肺成熟、营养神经等治疗,效果欠佳,与家属沟通后,择期于孕34+6周剖宫产终止妊娠,以头位助娩一男活婴,Apgar评分10分。术中生命体征平稳,术后常规预防感染、促宫缩等治疗。新生儿转入NICU观察治疗。术后恢复可,母乳喂养。随访6月,患者恢复良好,新生儿健康。
病例2,女,25岁,以“停经9+月,发现垂体腺瘤4+月”为主诉入院。2+年前因月经不规律,检查发现PRL偏高,间断口服BRC治疗。G2P1,剖宫产1次。此次孕5+月后出现频繁头晕、头痛,遂于我院行垂体MRI(图1B),考虑垂体腺瘤。恢复BRC规律治疗后,自觉头痛无明显改善。一般情况:神志清,精神差,痛苦面容,双侧瞳孔等大等圆,无视野缺损,心肺听诊无异常,腹膨隆如孕周,神经系统查体无明显异常。入院后给予预防垂体危象、营养神经等对症支持治疗,头痛无缓解。复查垂体MRI(图1C),考虑垂体腺瘤,较前可疑增大。与患者及家属商议后,孕37+4周剖宫产终止妊娠,以头位助娩一男活婴,Apgar评分10分。术中生命体征平稳,术后常规给予抗凝、预防感染等治疗,并继续给予BRC治疗。未哺乳,随访6月,患者头晕、头痛症状缓解,恢复可。
病例3,女,32岁,因“停经1+月,恶心、呕吐2周,加重1天”入院。1+年前因月经量少,检查发现血清PRL升高,行垂体MRI示(图1D)垂体右份微腺瘤。经BRC治疗后,PRL降至正常。半年前体检发现“抗磷脂抗体综合征”。G2P0,因“稽留流产”人工流产1次。入院后一般情况:神志清,精神差,双侧瞳孔等大等圆,心肺听诊无异常,神经系统查体无异常。入院后给予肝素抗凝、改善循环、补充水电解质、止吐、保胎等对症治疗,3日后复查彩超提示胚胎停止发育,与患者及家属商议后,择期清宫终止妊娠。术后继续BRC治疗,门诊随访6月,监测PRL在正常范围内,恢复良好。
病例4,女,31岁,以“停经9+月,要求入院待产”为主诉入院。2+年前因停经2+月,检查发现脑垂体瘤,给予BRC治疗后,月经复潮。此次孕28周后停药。G1P0。入院后一般情况:神经系统查体未见异常。2019年10月24日行垂体MRI示(图1E)垂体左份微腺瘤可能。入院后给予补充蛋白质及维持水电解质等对症支持治疗,孕39+6周剖宫产终止妊娠,以臀位助娩一女活婴,Apgar评分9分。因新生儿肌张力高,出生后转NICU观察。术中生命体征平稳,术后常规给予抗感染、促宫缩等治疗。出院后门诊随访6月,患者恢复可,新生儿母乳喂养,身体健康。
病例5,女,31岁,以“停经5+月,发现胎儿生长受限14天,阴道出血6天”为主诉入院。1+年前因月经量少,检查发现垂体催乳素微腺瘤,MRI(图1F)考虑垂体微腺瘤。规律口服BRC,孕期逐渐减量,定期监测PRL,控制可。G1P0,孕22周时行彩超检查提示胎儿宫内生长受限,后无明显诱因出现阴道出血。入院后检查:腹膨隆小于孕周,阴道可见鲜红色血液伴血块。行彩超提示:胎儿生长受限,脐动脉血流舒张期血流消失;大脑中动脉阻力降低;静脉导管PI增高,羊水少。给予改善循环、抗凝、预防感染、解痉等对症治疗,效果差。复查彩超提示:羊膜囊凸入宫颈管内,宫颈管宽14mm,宫腔内可见不均质低回声,范围约38mm×32mm。宫颈机能不全,宫腔积液。向患者及家属沟通病情,慎重考虑后要求引产,孕24+6周行羊膜腔穿刺利凡诺引产术,4h后自娩一死婴,外观未见异常。产后门诊随访6月,复查彩超、hcg、PRL无异常。
病例6,女,40岁,以“停经9+月,发现胎动减少10h”为主诉入院。2+年前因间断双侧溢乳伴月经量少,检查发现PRL高,行垂体MRI(图1G)考虑垂体微腺瘤。给予BRC,恢复月经后逐渐减量维持治疗。此次孕28周后停药。G4P1,人工流产2次,剖宫产1次。入院情况:神志清,精神可,心肺听诊无异常,腹膨隆如孕周,双下肢轻度水肿。入院后给予改善循环、抗凝等治疗,复查胎心监护考虑胎儿宫内窘迫,与患者及家属沟通后,孕38+3周手术终止妊娠,以头位助娩一女活婴,Apgar评分10分。术中生命体征平稳,术后给予常规治疗,并嘱母乳喂养。随访6月,患者恢复可,无头晕、头痛,新生儿身体健康。
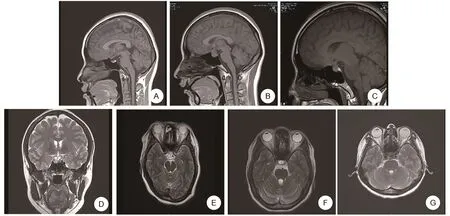
图1 垂体MRI图片
2 结 果
6例患者年龄25~40岁,均为自然妊娠,其中早产1例,足月产3例,早期流产1例,中期引产1例。新生儿出生后随访均未见明显异常。患者临床表现主要为月经异常,双侧溢乳。病例3合并抗磷脂抗体综合征。病例2孕期出现频繁头晕、头痛,复查垂体MRI提示肿瘤可疑增大并出现压迫症状,给予药物控制病情稳定后结束妊娠,产后继续用药。病例1确认妊娠后停药,病例4、6于孕28周后停药,病例3、5持续用药。见表1。
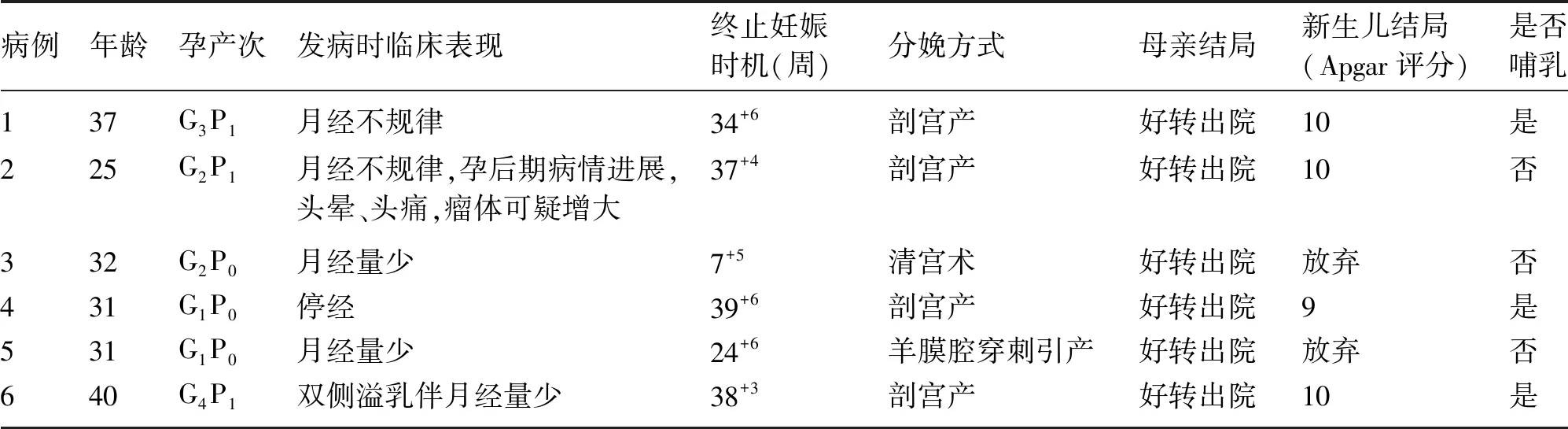
表1 妊娠合并垂体瘤患者临床资料
3 讨 论
3.1 妊娠合并催乳素瘤的风险 雌二醇在垂体中是PRL分泌的主要刺激因子。妊娠期间,受到母体高水平雌激素的影响,正常垂体的催乳素细胞增生肥大,PRL水平可增加多达10倍[3-4]。整个妊娠期间,垂体的体积和高度可增加约30%~45%,甚至产后也会持续一段时间[5]。分娩后,血清PRL水平迅速下降,但在哺乳妇女中,PRL仍会维持在一个较高的水平[6]。而催乳素瘤患者中,肿瘤细胞表达雌激素受体,受妊娠期高雌激素水平影响,肿瘤体积可显著增大,并分泌更多的PRL[7]。妊娠期间肿瘤增大的风险主要取决于肿瘤的大小,微腺瘤增大的风险较低。一项研究表明[8],微腺瘤在妊娠期间伴有症状性增大的风险<3%。瘤体增大时,主要导致占位性症状。典型的占位症状主要表现:头痛和视野缺损(肿瘤压迫视交叉引起)。妊娠期垂体的血流动力学也会发生相应的变化:雌激素水平的升高,引起垂体充血。同时,垂体泌乳细胞的大小和数量受雌激素影响而增加,体积迅速增加,引起肿瘤的血流供应改变,导致梗塞或出血[9],引起垂体卒中,症状表现为突发性头痛、视力障碍、眼肌麻痹、肾上腺功能不全引起的意识减退,严重时会危及母儿生命。
在非妊娠妇女中,催乳素瘤所致的临床症状主要由高水平的PRL引起,通常表现为溢乳、月经变化(月经流量变化、月经不规则、闭经等)、生殖功能障碍等。高水平的PRL通过改变下丘脑-垂体-卵巢轴直接抑制雌激素产生从而导致卵泡生成及排卵受损[10],还可抑制黄体颗粒细胞的增生,降低其功能,使患者黄体期缩短,孕酮严重分泌不足,使早期胚胎发育受到影响[11],可能导致早期妊娠的丢失。研究发现[12],与不进行治疗者相比,妊娠早期给予多巴胺受体激动剂(BRC 2.5~5mg/d)至妊娠第9周,显著降低了流产率。
3.2 妊娠合并催乳素瘤的治疗 多巴胺激动剂是黄金标准的治疗方法,可有效降低PRL水平、减小催乳素瘤大小、改善患者的压迫和恢复性腺功能。其他治疗手段包括手术、放射治疗等。需要注意的是,Melmed等[13]提出,不建议临床医生对无症状的催乳素微腺瘤患者给予多巴胺受体激动剂治疗。当肿瘤进一步增大出现垂体卒中,或对药物治疗抵抗时,可考虑手术。目前我国临床常用的多巴胺激动剂有BRC和卡麦角林(Cabergoline,CAB)。BRC在妊娠期间的使用最为广泛,有可靠的安全妊娠记录。
3.2.1 催乳素瘤患者的孕前处理 由催乳素瘤所致的高催乳素血症通常与无排卵有关,是导致不孕症的重要原因,因此,治疗需要恢复正常的下丘脑-垂体-卵巢轴,恢复排卵,从而恢复患者的生育力。BRC是治疗的一线用药,常用起始剂量为1.25mg或2.5mg,逐渐加量至每天5~15mg[14]。BRC对80%~90%的微腺瘤患者的治疗有效,血清PRL水平正常化,性腺功能恢复,瘤体缩小[15]。对于大催乳素瘤,给予BRC治疗后,70%患者的PRL水平恢复正常,瘤体得到控制,且肿瘤引起的压迫症状也有所改善。大多数患者在首次给予BRC治疗后的几天内头痛及视野缺损的症状就得到显著缓解改善。研究表明,约25%的患者会对BRC产生耐药。当BRC治疗无效时,CAB常作为治疗的二线用药,80%的BRC耐药患者经CAB治疗后,PRL降至正常[16]。Dos Santos Nunes等[17]研究提出,CAB在药物耐受性、降低PRL分泌、恢复性腺功能和缩小肿瘤体积方面较BRC具有优越性,并认为除特殊情况外,应将CAB作为催乳素瘤或高催乳素血症治疗的首选方案。无论用CAB或是BRC,建议在恢复正常月经周期和排卵至少3个月后再试孕,且避孕期间采用器械避孕的方式。开始药物治疗1个月后应定期监测PRL水平,每年重复MRI检查,以明确病情进展并指导强化治疗。
3.2.2 孕期处理 患者有生育需求时,需考虑两个主要问题,即多巴胺激动剂对胎儿发育的影响以及妊娠对催乳素瘤的影响。胎儿接触所有药物的时间理论上应尽可能短,且微腺瘤在孕期增大的风险较低,故此类患者可在妊娠3~4周后停药。一项对妊娠期间暴露于多巴胺激动剂的流行病学研究显示[18],CAB及BRC并未增加胎儿出生缺陷的风险,早产和流产的风险似乎有所增加,但这点仍需进一步研究。整个孕期每月监护随访,以了解肿瘤生长情况。大催乳素瘤因孕期肿瘤增大的风险较高,推荐在严密监测下继续BRC治疗。如肿瘤增大,应重新开始BRC治疗。若效果不佳,建议足月后尽快终止妊娠,或在孕中期手术治疗,避免发生垂体卒中。建议仅当临床主诉提示肿瘤可能增大后,进行影像学及眼科检查评估。不建议在整个孕期监测PRL,因为肿瘤的生长并不一定与PRL的升高或维持直接相关[19]。本资料中,1例大腺瘤患者孕中期后出现头痛、视野缺损,影像学证实肿瘤体积增大,经积极治疗无明显好转,足月后终止妊娠,症状随之缓解。总之,选择终止药物治疗的时机必须因人而异。
当患者出现剧烈的头痛和视力障碍时,应考虑垂体卒中,需立即进行影像学检查以确诊。首选MRI,如有MRI禁忌证无法检查时,则进行垂体CT扫描检查[20]。治疗包括维持体液和电解质平衡、皮质类固醇冲击治疗和支持措施以确保血流动力学稳定。推荐使用氢化可的松100~200mg静脉注射,然后持续静脉输注(2~4mg/h)或6h肌肉注射(50~100mg)。若经治疗后仍无好转,并进一步出现视力严重下降、严重且持续性或恶化的视野缺损或意识水平下降等严重神经眼科体征,结合患者妊娠孕周及多学科会诊,建议行手术治疗。
3.2.3 分娩方法 目前并无文献明确支持对已确诊的妊娠合并催乳素瘤患者进行剖宫产。李莉等[21]提出,临产、分娩都是应激状态,可能激发瘤体突然增大,同时妊娠合并垂体肿瘤患者多数有原发或继发不育史,或高龄等,故其剖宫产率明显增加。文献显示[22-23],部分患有催乳素瘤患者采用阴道分娩结束妊娠。本资料的4例活产均为剖宫产终止妊娠。对于阴道试产是否增加肿瘤增大或垂体卒中等的风险,仍需进一步研究。综上,仍然鼓励孕期病情平稳的催乳素瘤患者,特别是微腺瘤患者在严密监测下进行阴道试产,如有异常及时急诊手术,终止妊娠。
3.2.4 哺乳的选择 没有证据表明,哺乳的风险大于妊娠雌激素对肿瘤的影响。因此,对于孕期无肿瘤体积增大症状的垂体瘤,特别是微腺瘤患者,应鼓励母乳喂养。对于妊娠期间出现肿瘤增大迹象且需干预的患者,需在分娩后尽快进行仔细评估,如影像学检查显示肿瘤压迫了周围的结构(如视交叉或海绵窦),则必须中断哺乳,并继续药物治疗[24]。本文成功分娩的4例患者中,1例因出现病情进展产后继续用药而未哺乳,其余3例产后均正常哺乳,无病情进展。
垂体催乳素腺瘤的发病率逐渐增高,及早诊断并给予个体化治疗和管理方案,孕期加强产前检查,关注神经系统症状和体征,一旦怀疑肿瘤生长,及时行MRI检查,并重新给予多巴胺激动剂进行保守治疗,尽可能延长孕周后终止妊娠,以取得较好的妊娠结局。
